
搭建小鼠活体肠镜平台,直视下建立小鼠结直肠癌原位模型,并观察其转移等生物学行为。
8周龄雄性C57/BL小鼠经麻醉后,分别用自主研发活体结肠软镜及奥林巴斯URF-P5输尿管软镜观察小鼠肠腔,对比成像效果。肠镜直视下将人结肠癌HT-29细胞注射至BALB/c-nu小鼠结肠黏膜下,注射后第3、7、15天复查肠镜,观察肠腔内成瘤情况。当小鼠体质量明显下降、呈恶病质时,予处死,探查腹腔,观察腹腔内成瘤及转移情况,标本送病检。
自主研发搭建的小鼠活体肠镜平台可清晰观察肠腔,未致小鼠死亡。在小鼠活体肠镜直视下行肠黏膜下注射HT-29细胞,穿孔率为15%,小鼠死亡率为33.3%,成瘤率为62.5%,腹腔转移率为60%,肝脏转移率为25%,腹壁转移率为25%。
自主研发搭建的小鼠活体肠镜平台能用于小鼠活体结直肠研究,其成像效果不亚于奥林巴斯URF-P5输尿管软镜;此外,结合黏膜下注射技术,可建立符合结直肠癌临床病理过程的原位模型。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌是常见的消化道恶性肿瘤,其发病率居全球恶性肿瘤第4位[1,2],近年来其在我国的发病率呈逐年增加趋势[3]。因此急需构建合适的活体肿瘤模型,进而改善结直肠癌的临床疗效及预后。
小鼠是研究结直肠癌的重要实验动物,目前已经建立多种人结直肠癌小鼠动物模型,包括诱发模型、皮下移植瘤模型、原位移植瘤模型[4],应用较多的是皮下移植瘤模型,原位模型应用相对较少[5,6]。但这些模型大多脱离了肿瘤微环境(tumor microenvironment),不能准确地模拟人结直肠癌的发生、发展。肿瘤微环境是肿瘤发生、发展的重要影响因素,与肿瘤侵袭和转移密切相关,维持微环境稳定,可增加肿瘤转移和侵袭的能力[7,8,9]。而传统意义上的原位模型并未符合腺癌起源于肠黏膜的特点。
2008年,Donigan等[10]在×10倍放大镜及×100倍显微镜的辅助下经肛门将直肠癌细胞注入小鼠肠壁内,构建了直肠癌原位模型。2011年,Bhullar等[11]经肛门通过电凝法损伤直肠壁,再经肛门灌注癌细胞,构建了直肠癌原位模型。虽然这两种模型都是经肠腔内构建,但无法控制注入层次,移植位点距肛门距离有限。
Huang等[12]在2001年首次报道应用小儿膀胱镜对小鼠进行活体肠镜检查,并通过活检通道获取组织样本。Becker等[13]于2005年对小鼠活体结肠镜进行改进,通过肠镜可获取高清的内镜影像资料,结合色素内镜技术可在肠镜下辨别肠道炎性病变及早期癌变。Kodani等[14]在2013年借助输尿管镜构建了小鼠肠镜成像系统,用于监测小鼠结肠炎症和肠道肿瘤,并在内镜下对肠道病变进行了评分。另一方面,2011年,Zigmond等[15]提出了借助小鼠肠镜,在国际上率先进行黏膜下注射癌细胞,通过微创的方式构建结直肠癌原位模型。该模型具有成瘤快、小鼠耐受性好、可重复性高、可精准控制的优点,是对结直肠癌模型的一个重大技术改进,也是对小鼠活体肠镜应用的延伸。笔者自2014年率先在国内开展了活体小鼠肠镜技术,借助临床胆道镜系统和电子输尿管镜构建活体小鼠肠镜平台[16]。2016年,Bettenworth等[17]在活体肠镜直视下通过黏膜下注射肿瘤细胞,构建了小鼠结直肠癌原位模型,该模型出现了肝转移、腹腔转移,更符合其生物学行为。
上述研究大多都是借助输尿管镜或膀胱镜进行的,其设备价格昂贵[12, 14],不便于推广。因此本课题组自主研发了小鼠活体肠镜,结合黏膜下注射技术构建了较理想的小鼠原位模型,并观察到其肝转移、腹腔转移等生物学行为。
人结肠癌HT-29细胞(中南大学湘雅医院中心实验室细胞库),RPMI-1640细胞培养基、磷酸盐缓冲液(PBS)、胰酶(含乙二胺四乙酸)、青霉素-链霉素混合液(双抗,100×)(美国HyClone公司),胎牛血清(FBS)(中国四季青公司)。8周龄雄性C57/BL小鼠、雌性BALB/c-nu小鼠(湖南斯莱克景达实验动物有限公司)。自主研发的小鼠活体结直肠软镜(自主研发的小鼠活体肠镜),小鼠腹腔镜(中国杭州市桐庐江南医光总厂),奥林巴斯OTV-SI摄像系统、奥林巴斯URF-P5输尿管镜(日本奥林巴斯株式会社),DW3000B小动物人工呼吸机(北京众实迪创科技发展有限责任公司),304不锈钢管(中国荣发金属材料有限公司)。
测量自主研发的小鼠活体肠镜导光束、活检通道、充气孔的直径,检测小鼠活体肠镜的光学参数。
(一)构建小鼠活体肠镜成像系统。将小鼠活体肠镜连接于奥林巴斯OTV-SI摄像系统及光源。肠镜充气孔与小动物呼吸机的进气孔相接(三通转接头连接)。
(二)小鼠术前准备。将20只8周龄C57/BL雄性小鼠于无特定病原体(specific pathogen free,SPF)、24 ℃、昼夜各12 h条件下饲养,自由进饮进食,遵守实验动物保护法并经伦理委员会审批。
术前不禁饮食,称重,灌肠。10%水合氯醛腹腔注射麻醉(0.03 ml/10 g~0.04 ml/10 g)[18,19,20],约5 min后小鼠完全麻醉,仰卧位固定小鼠。无菌生理盐水经肛门灌肠(用1 ml注射器针筒连接静脉输液器管道,导入肛门前排气,75%酒精消毒2~3次,再用无菌石蜡油润滑),灌肠1~2次,1~2 ml/次[16]。
(三)小鼠活体肠镜检查。灌肠排便后,打开摄像系统及光源,肠镜前端用75%酒精消毒2~3次,用无菌石蜡油润滑,缓慢导入肛门,打开小动物呼吸机间断充气,肠管充盈后缓慢导入肠镜,观察肛管、直肠、降结肠、结肠脾曲,录像。每次操作后用75%的酒精消毒肠镜。在操作中,当肠管充盈后关闭三通接头,停止充气,当肠腔塌陷,打开三通接头,间断充气(呼吸机间断充气频率:21次/min,呼吸比为1-1,潮气量10 ml,充气后显示气压波动在1.7~2.4 kPa)。
(四)将肠镜改为奥林巴斯URF-P5输尿管镜,重复上述实验,录像并对比。
(五)在自主研发的小鼠活体肠镜直视下进行肠黏膜下注射。①自制内镜用超长注射针:将2 m长的304不锈钢管(外径0.6 mm、内径0.3 mm),根据肠镜的长度(91 mm),裁剪成1.5 m,用砂轮磨成角度为30°~45°的针尖[16],经测定针道残留液体体积为0.05 ml。②肠镜直视下行黏膜下注射亚甲蓝:将自制注射针用75%的酒精消毒,经活检通道导入,连接于含无菌亚甲蓝的1 ml注射器,在肠镜直视下行肠黏膜下注射,注射点位于结肠脾曲附近,距离肛门约4~5 cm,注射剂量为0.05~0.1 ml。
(六)小鼠腹腔镜探查。将小鼠腹腔镜连接于摄像系统,将含鞘的动脉穿刺针作为气腹针,经右侧腹股沟区进行穿刺,穿刺成功后,拔出针芯,将动脉穿刺针的外鞘与小动物呼吸机的出气孔相接,构建气腹(根据腹腔充盈程度,间断充气),于腹部正中线、剑突下约2.5 cm处附近(视具体情况调整)置入自制穿刺套件,导入腹腔镜观察有无亚甲蓝渗入腹腔,排除肠穿孔(呼吸机间断充气频率20次/min,潮气量15 ml,呼吸比为1-1,充气后压力为2.6~2.8 kPa)。
(七)剖腹探查。在完成黏膜下注射及腹腔镜探查后,行剖腹探查,进一步明确有无亚甲蓝渗入腹腔,排除肠穿孔,评估黏膜下注射的可行性。
(八)小鼠复苏。人工辅助排气,将小鼠置于37 ℃的恒温板上复苏。
(一)BALB/c-nu小鼠。8周龄BALB/c-nu雌性小鼠12只,于SPF、24 ℃,昼夜各12 h条件下饲养,自由进饮进食,遵守实验动物保护法并经伦理委员会审批。
(二)细胞准备。配制人结肠癌HT29细胞106/ml细胞悬液,备用。
(三)BALB/c-nu小鼠术前准备同1.2.2中(二)节。
(四)小鼠活体肠镜检查。肠镜检查BALB/c-nu小鼠(方法同前)。注射癌细胞前,肠镜下观察肠腔情况,排除炎症及肿瘤。
(五)肠镜直视下构建小鼠结肠癌原位模型[15,17]。将自制注射针用75%酒精消毒,连接于含HT-29细胞悬液的1 ml注射器,经活检通道导入,肠镜直视下行肠黏膜下注射(细胞量1×105/0.1 ml,小鼠12只),注射点位于结肠脾曲附近,距肛门约4~5 cm。辅助排气后,置于37 ℃恒温板上复苏;麻醉苏醒后,回笼饲养。监测小鼠体质量,观察进食、排便情况及腹部体征。注射后第3、7、15天复查肠镜,观察成瘤、炎症情况,计算小鼠的成瘤率。当小鼠体质量明显下降、呈恶病质时,处死小鼠,剖腹探查,观察腹腔成瘤情况,留取标本送病检。
(六)腹部增强CT检测。经腹部可触及肿块时,经尾静脉注射碘海醇(碘海醇与生理盐水以1∶1稀释),行增强CT检查。
自主研发小鼠活体肠镜各组成部分的直径参数见表1。
自主研发小鼠活体肠镜各部分的直径参数(mm)
自主研发小鼠活体肠镜各部分的直径参数(mm)
| 名称 | 外径 | 内径 |
|---|---|---|
| 肠镜导光束 | 2.5 | — |
| 肠镜活检通道 | 3.3 | 1 |
| 肠镜充气孔 | 3.3 | 1 |
注:"—"指无此项
(一)分辨率测试。使用线宽标准版进行测试,可分辨出15 μm的线宽(表2)。使用ISO 1233标准分辨率测试卡进行测试,测试结果为:水平视觉分辨率为4 000 LW/PH;垂直视觉分辨率为4 000 LW/PH。

线宽标准版由高精度影像测量仪进行标定
线宽标准版由高精度影像测量仪进行标定
| 象限 | 线宽(μm) |
|---|---|
| 4-5 | 19.650 |
| 5-1 | 15.620 |
| 4-6 | 17.550 |
| 5-2 | 13.930 |
| 测定不确定度:U=3 μm(k=2) | |
(二)LED光谱测试。小鼠活体肠镜LED光谱测试结果见表3。

小鼠活体肠镜LED光谱测试
小鼠活体肠镜LED光谱测试
| 测试项目 | 测试结果 |
|---|---|
| 光谱范围 | 340~980 nm |
| 最小光谱带宽 | 15 nm |
| 测定不确定度:U=0.5 nm(k=2) | |
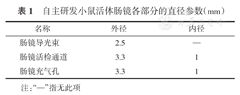
自主研发小鼠活体肠镜能清晰地观察肛管、直肠、降结肠、结肠脾曲肠腔及肠壁血管。(图1B)

使用奥林巴斯URF-P5输尿管镜能清晰地观察肛管、直肠、降结肠、结肠脾曲肠腔及肠壁血管。(图1A)
如图2所示,镜下可见亚甲蓝在肠黏膜下显影,提示注射层次为肠黏膜下,为本研究后续注射结肠癌细胞确定注射层次。


行肠黏膜下注射后,腹腔镜探查未见亚甲蓝渗入腹腔;再剖腹探查,腹腔未见亚甲蓝渗出。结果进一步证实肠黏膜下注射未导致肠穿孔。
将小鼠置于37 ℃恒温板复苏,约1 h后完全复苏,恢复自主活动。
行肠黏膜下注射时,肠管充气后腹壁可见肠型,如注射导致肠穿孔,肠腔内气体进入腹腔,导致腹部明显膨隆,肠型消失。
肠镜直视下行肠黏膜下注射HT-29细胞,镜下见注射部位肠黏膜局部隆起。(图3A)
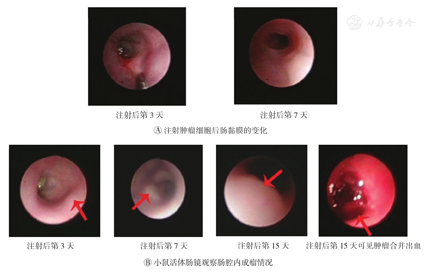

术后第3天,复查小鼠活体肠镜,镜下见近结肠脾曲肠腔有1个肿块形成(图3B1),凸向肠腔,第7、15天镜下见结肠肿块不断增大(图3B2、图3B3),第15天肠镜下见肿块合并出血(图3B4)。
共12只小鼠行肠黏膜下注射HT-29细胞,注射前行肠镜检查,见肠腔形态正常,未见肿瘤及炎症。实验中注射20次,穿孔3次,其中有3只小鼠出现肠穿孔(1只麻醉未复苏,直接死亡;2只术后第1天死亡),1只麻醉过深,直接死亡,注射穿孔率15%,小鼠死亡率33.3%。
正常存活8只小鼠,其中1只术后第8天死亡,剖腹探查,见降结肠肠腔内有一米粒大小肿块,质硬,与周围组织分界不清;腹腔内未见其他肿块,肿块送病检,镜下见癌细胞。其中1只术后第15天复查肠镜,近结肠脾曲处见一肿块合并出血,剖腹探查见降结肠内有一肿块,自肠腔内生长,侵犯肠壁全层,质硬,与周围组织分界不清,肿块切面呈鱼肉状,病检证实为结肠癌。
其中3只小鼠分别于术后第22、23、30天可见肿块经右下腹膨出,触诊肿块位于腹腔内,边界不清,质硬,与肠壁相连,未与腹壁粘连,后经开腹确认这些肿块均来源于肠道。术后第32天行CT检查,见腹腔多发肿块,肠管胀气,增强期肿块强化。其中1只于术后第32天见左下腹壁有一肿块,大小约1 cm×0.4 cm,形状不规则,与腹壁粘连,与周围组织分界不清,质硬,活动度差。当小鼠体质量明显下降,出现恶病质时,处死小鼠,探查腹腔。其中2只小鼠在降结肠及腹腔内见肿块形成,切除送检,病检均证实为结肠癌。其中1只小鼠腹腔内见血性腹水,降结肠、腹壁、空肠、肝脏、膈肌上均有肿块形成,肿块大小不等,与周围组织边界不清,切面呈鱼肉状,切取送病检,镜下可见癌细胞。
剩余3只小鼠于术后第40天复查肠镜,未见肿块形成,剖腹探查,肠腔内及腹腔均未见肿块形成。本实验的成瘤率为62.5%,腹腔转移率为60%,肝转移率为25%,腹壁转移率为25%。
目前,小鼠活体肠镜多借助小儿输尿管镜或膀胱镜成像,耗费高且可重复性低[12, 14],不易推广。笔者研发的小鼠活体肠镜其导光束外径为2.5 mm,活检通道内径为1 mm,活检通道比文献报道的1.2 mm更细[14]。通过与奥林巴斯URF-P5输尿管镜采集的图片进行对比,证实其能清晰观察肠腔结构。证明笔者研发的小鼠活体肠镜成本低廉,便于推广。
此外,笔者改进了用移液管或注射器导入肛门的灌肠方式[14,16],将1 ml注射器的针筒连接于静脉输液器的管道,进行灌肠,更接近临床工作,较传统灌肠方式便捷。每次灌肠的液体应控制在1~2 ml,否则可能会引起肠腔过度充盈,腹腔压力过高,膈肌上抬,影响呼吸。同时,过多进入结肠的液体可能形成大量气泡,影响观察及操作(图1B6)。
为实现肠黏膜下注射,构建结直肠癌原位模型,笔者对不锈钢管进行改造,自制注射针(成本低廉,工艺简单、耗时短)以适应自主研发肠镜的活检通道。经腹腔镜和开腹证实黏膜下注射亚甲蓝及HT-29细胞获得成功,与国外报道的效果相同[15]。同时本实验证明小鼠双镜(小鼠活体肠镜、腹腔镜)联合使用是可行的,可为小鼠肠道疾病的研究提供新的思路及平台。
在2014年工作的基础上,本实验采用小动物呼吸机,通过调节三通接头间断控制肠管充气,较文献报道的充气方式操作更简单,充气速度更均匀。实验中肠管无需持续充气,只需肠管适当充盈便于观察。持续充气会引起腹内高压,膈肌上抬,影响呼吸,导致小鼠死亡;过度充气可能使空气逆行入胃,导致胃食管返流,引起误吸,导致小鼠死亡。
在自主研发的小鼠活体肠镜直视下构建的结直肠癌原位模型中,笔者在注射后第3、7、15天复查肠镜,可见肿块形成,肿块逐渐增大,注射后第15天肠镜下见肿块合并出血,病检证实肿块为结肠癌,与Bettenworth等[17]报道的基本一致。实验中当小鼠体质量明显下降、出现恶病质时行剖腹探查,见降结肠、腹壁、肝脏、空肠、膈肌均有肿块,这些肿块经病检可见癌细胞。判定这些肿块均为结直肠癌,证实笔者已构建结直肠癌原位模型,并发生结直肠癌肝转移、腹腔多发转移。本研究构建的模型其结直肠癌肝转移率为25%,与Bettenworth等报道的28.6%基本相符。实验中观察到结直肠癌腹壁转移及血性腹水,之前未见文献报道[15, 17],此研究结果证明本研究构建的模型更贴近临床,能更精确地模拟人结直肠癌的发生、发展。
综上所述,本研究借助自主研发的小鼠活体肠镜平台,将HT-29细胞注射至黏膜下,成功地模拟结直肠腺癌起源于肠黏膜层向肠腔内生长,逐步侵犯肠壁各层,向肠外生长,体现了肿瘤微环境在肿瘤发展中的作用,成功地模拟了人结直肠癌的发生发展规律,并出现了腹腔转移、肝转移及腹壁转移。肿瘤微环境对肿瘤生长及治疗至关重要[21],原位模型能更准确地模拟肿瘤微环境[22]。因此本研究构建的模型比皮下移植瘤模型更适用于结直肠癌的研究。相比传统的开腹手术构建原位模型[23,24],本研究借助小鼠肠镜平台,结合黏膜下注射技术,在微创条件下构建原位模型,创伤小,术后未出现感染,降低了小鼠应激及感染风险。此外,相比结直肠癌化学诱发模型,本研究构建的模型成瘤迅速,注射肿瘤细胞1~2周后便可见肿瘤形成,较诱发模型省时且产生的肿瘤为人源性。并且较转基因动物模型[25,26,27],本研究构建的模型在小鼠活体肠镜直视下可精确控制肿瘤的部位及数量。但本研究构建的模型属于异种移植模型,为避免移植排斥反应,宿主选用了免疫功能缺陷的裸鼠,因此不能完全体现免疫系统在肿瘤发生发展过程中的作用。而免疫系统在肿瘤发生、发展中起着不可忽视的作用(如肿瘤的免疫逃逸),因此该模型今后尚需进一步研究改进。
感谢广州瑞派医疗器械有限责任公司给予技术支持
无



























