
骨膜是附着在骨质上的一层特殊结缔组织,不仅包含了骨质修复所需的间充质细胞,即骨膜源干细胞(PDSCs),而且提供了PDSCs所需的微环境以及必要的生物力学支撑。骨膜在骨组织修复中起着至关重要的作用,临床上骨膜移植已广泛应用于骨质修复,是再生医学的重要研究领域。对骨膜的结构以及PDSCs的生物学特征进行了综述,概述两者在骨修复中的研究进展,探讨了PDSCs参与骨修复所涉及的相关信号通路。骨膜和PDSCs除了在骨修复中起着决定性作用外,还是影响骨质再生的重要因素之一。对比了PDSCs在人/小鼠断肢愈伤、蝾螈割处再生以及鹿茸完全再生过程中增殖及分化潜能的差异,发现PDSCs增殖潜能以及丰富的血液供给可能是决定骨质再生的关键因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来,再生医学的快速发展为创伤修复及组织、器官再生提供了一种新的研究与医疗手段。再生医学是指利用蛋白与细胞,改善或治疗因衰老、创伤等多种原因引起的组织和器官衰竭及损伤[1]。再生医学可以为多种疾病提供新的医疗手段,其中基于干细胞的再生医学研究及临床应用是该领域的重点和热点,其治疗方式可以是单独注入干细胞或干细胞分泌因子,也可以是将干细胞接种至天然的或人工合成的材料再一并移植至损伤部位[2,3]。而其核心因素包括优质的种子细胞、良好的三维结构、丰富的生长因子,以及合适的机械/生理信号[4]。
长久以来,骨/软骨修复一直是临床医学的难点之一,其中最大的难题是一旦出现超过临界值尺寸的缺损,机体无法自身修复[5]。此外,手术治疗的时间、费用及病人身体负担也较高[6]。而基于干细胞的再生医学为这一问题提供了新的视角与解决手段。有研究结果表明,骨膜组织中含有的成骨前体细胞即骨膜源干细胞(periosteum dirved stem cells, PDSCs)可以用于骨和软骨组织的修复及再生。对骨膜及PDSCs的特性及其在骨质修复中的研究进展进行综述。
骨膜是覆盖在骨质表面的一层结缔组织。解剖学发现,骨膜通过夏皮式纤维(Sharp’s fiber)牢牢锚定在骨质上,充当外部肌肉组织和内部骨质的连接桥梁[7],这种结构有助于维持骨膜的完整性。骨膜中富含血管,为皮质骨提供了至少1/3的血液供给[8]。骨膜由2部分组成,外层疏松的纤维层以及内层致密的细胞层。纤维层中含有稀疏的成纤维细胞、胶原纤维、弹力纤维以及微管[9]。细胞层中含有致密的多角形细胞,多为PDSCs,这种干细胞与骨髓源间充质干细胞(bone marrow stromal cells,BMSCs)类似,具有多向分化的潜能[10]。在正常的生理状况下,骨膜组织发挥着维持骨质更新及重塑的作用,其中的干细胞既可以通过膜内成骨方式分化为成骨细胞,也可通过软骨内成骨方式分化为软骨细胞[11]。因此,骨质修复、重塑和更新与骨膜中的PDSCs密切相关。
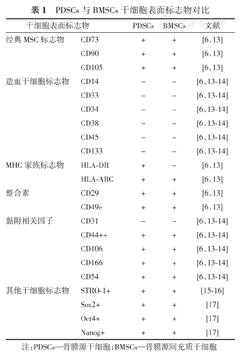
发育生物学研究结果发现,长骨骨膜、骨内膜以及骨髓腔内骨小梁表面的成骨细胞均来源于胚胎软骨膜[12]。因此,PDSCs与BMSCs类似,都具有间充质干细胞特性,拥有相同的干细胞表面标志物。长久以来,获得纯系PDSCs的方法存在争论,且尚未找到特异性的表面标志物来鉴定和分离PDSCs,一般使用经典的BMSCs细胞标志物来鉴定PDSCs[6,10,13,14,15,16,17](表1)。PDSCs的原代培养方式有2种,一种是酶消化法,另一种是组织块贴壁培养法,这两种方法获得的细胞均具有多向分化潜能和表达相似的干细胞表面标志物[18]。通常,PDSCs采用含血清培养体系进行培养,其中基础培养基对干细胞的分化潜能影响较大。研究结果发现,DMEM培养基(低糖型)比1640培养基更能促进PDSCs增殖及向软骨细胞分化[19]。此外,DMEM/F12培养基也能很好地维持PDSCs的干性[20]。需要注意的是,PDSCs的培养过程中容易混入成纤维细胞(fibroblast cells,FBCs)污染,FBCs与PDSCs类似,具有塑料培养面的贴附性;离体培养5~10代后,干细胞中混杂的FBCs可能存活下来并自动永生化,从而影响后续的治疗效果[21]。研究结果发现,PDSCs高表达CD166而低表达CD9,这一情况与FBCs正好相反[22]。此外,当PDSCs出现FBCs表型时(CD166低表达与CD9高表达),细胞的成骨分化潜力也会大大降低。而且,CD106、CD146、整合素α11、胰岛素样生长因子2在PDSCs中高表达,而基质金属蛋白酶1和2等在FBCs中高表达,表达量可达PDSCs的20倍以上[22]。这些基因或者干细胞表面标志物可以作为PDSCs和FBCs的标志。另外,PDSCs不会因为个体的衰老而降低干细胞特性,来源于年老和年轻个体的PDSCs具有类似的表型,可能的原因是PDSCs中端粒酶活性相对稳定[23,24]。研究发现,体外培养24代后,PDSCs端粒的长度及端粒酶的活性与原代细胞无显著差异[23,24]。因此,相比于传统的组织工程种子细胞BMSCs,PDSCs可能有更大的分裂潜力,更适合应用于骨软骨修复。
PDSCs与BMSCs干细胞表面标志物对比
PDSCs与BMSCs干细胞表面标志物对比
| 干细胞表面标志物 | PDSCs | BMSCs | 文献 | |
|---|---|---|---|---|
| 经典MSC标志物 | CD73 | + | + | [6,13] |
| CD90 | + | + | [6,13] | |
| CD105 | + | + | [6,13] | |
| 造血干细胞标志物 | CD14 | - | - | [6,13,14] |
| CD33 | - | - | [6,13,14] | |
| CD34 | - | - | [6,13,14] | |
| CD38 | - | - | [6,13,14] | |
| CD45 | - | - | [6,13,14] | |
| CD133 | - | - | [6,13,14] | |
| MHC家族标志物 | HLA‐DR | + | - | [6,13] |
| HLA‐ABC | + | + | [6,13] | |
| 整合素 | CD29 | + | + | [6,13] |
| CD49e | + | + | [6,13] | |
| 黏附相关因子 | CD31 | - | - | [6,13,14] |
| CD44++ | + | + | [6,13,14] | |
| CD106 | + | + | [6,13,14] | |
| CD166 | + | + | [6,13,14] | |
| CD54 | + | + | [6,13,14] | |
| 其他干细胞标志物 | STRO‐1+ | + | + | [15,16] |
| Sox2+ | + | + | [17] | |
| Oct4+ | + | + | [17] | |
| Nanog+ | + | + | [17] | |
注:PDSCs—骨膜源干细胞;BMSCs—骨膜源间充质干细胞
骨膜在软骨修复中起着至关重要的作用。Zarnet等[25,26]设计了2个兔关节软骨缺损修复模型,以验证软骨缺损修复中新生软骨细胞的来源。首先,用H3腺苷标记骨膜组织并自体移植到缺损部位,放射自显影发现H3标记的细胞遍布于整个新生软骨组织中,说明移植的骨膜可以分化为软骨细胞[25];其次,将雄性的骨膜异体移植到雌性的缺损软骨区域[26],发现新生的软骨细胞中Y染色体细胞为33%,X染色体细胞为67%。上述研究表明,在活体软骨修复过程中,骨膜是新生软骨的重要组织来源之一。此外,离体研究结果同样证实PDSCs具有很好成软骨潜能[27,28]。PDSCs在适当的条件下可以分化为软骨细胞并形成软骨样组织,如对PDSCs联合聚己内酯尼龙薄膜进行搅拌式悬浮培养,可促进干细胞的增殖并向软骨细胞分化形成工程软骨[27];灌注式循环培养系统中进行PDSCs培养时,细胞可以分泌大量的细胞外基质形成软骨样组织[28]。
骨膜在正常的生理情况下维持着骨质的更新及重塑,而在病理情况下参与骨质的重建和修复。研究结果发现,成体中除最初炎症反应外,骨质修复的其他各个阶段与胚胎骨形成的过程类似。在炎症期,损伤处骨膜及骨内膜中血管破裂、软组织损伤,形成血肿,骨折端骨细胞死亡,导致无菌性炎症反应,各种炎症因子、生长因子及机械信号刺激骨再生相关干细胞,包括骨髓来源的细胞、骨膜细胞、骨周边软组织及血管系统[11,29,30,31,32]。但这些分子、细胞及机械信号对干细胞的影响方式尚未完全阐明。然而,PDSCs在此过程中发挥着重要作用,受伤后24~48 h内,PDSCs迅速做出应答,分泌一系列基质蛋白如2型胶原和骨钙素[33];在长骨断裂且断面没有固定的情况下,PDSCs快速增殖并通过软骨内成骨进行骨修复,生成软骨与编织骨,并最后形成板层骨[33,34];当骨折断面被牢牢固定,PDSCs则通过膜内成骨的方式进行骨修复[34]。
一系列信号分子和信号通路参与了PDSCs的激活并引导PDSCs进行骨质修复。研究结果发现,PDSCs的迁移效率与某些趋化因子间存在一定的量效关系[35]。PDSCs表达趋化因子受体4(chemokine receptor 4,CXCR4)和受体5(chemokine receptor 5,CXCR5)分别对应间质细胞分泌因子1(stromal cell-derived factor 1,SDF1)和B细胞活化趋化因子1(B cell-attractive chemokine 1,BCA1)的刺激。骨伤及骨关节炎患者骨重塑区的成骨细胞特异性表达SDF1和BCA1,这些趋化因子可能起着信号分子的作用,引导着PDSCs参与骨质修复。此外,骨损伤处骨膜细胞SDF1表达上调,作为信号分子激活其他区域的CXCR4阳性干细胞[36],促进其进一步增殖。另一方面,SDF1和CXCR4受到抑制后,骨形态发生蛋白2(bone morphogenic protein 2,BMP2)诱导的成骨分化也随之被抑制[35]。临床治疗中,骨膜移植的成功与否依赖于移植物和移植区域内各种细胞因子的有效应答。因此,如何有效地激活PDSCs,促其进一步增殖及分化,对于骨质修复至关重要。
对骨膜参与骨质修复的相关信号通路进行深入研究有助于进一步了解骨质修复机制,也有助于组织工程的发展,其中最引人注目的是转化生长因子(transforming growth factor,TGF)和BMP信号通路[37]。BMP2是TGF-beta超家族中一类骨形态蛋白,其在骨折修复及骨再生的过程中起着广泛的作用,如促进PDSCs增殖与分化。通过研究PrX-1-Cre转基因小鼠模型发现[38],在长骨的骨髓中特异性敲除BMP2并不影响长骨的发育。但是,BMP2的缺失却导致长骨的骨结构变为海绵样;进一步的全身性敲除发现,该模型动物骨折后不能形成骨痂[38]。该结果说明BMP2在骨折愈合的起始阶段起着重要作用。该结论在另一动物模型中得到了有效验证,即它莫西芬诱导的CreER转基因小鼠在骨折愈合的前期阶段BMP2的表达被特异性抑制后,其骨折区域的软骨内成骨和膜内成骨均被抑制[39,40]。在离体情况下,PDSCs中BMP2敲除后,细胞的分化受到抑制,同时细胞的增殖及存活也相应地受到影响,而将这种突变细胞移植于活体内发现,在骨折区域仅有少量突变型细胞可以分化为软骨细胞及成骨细胞[41]。在活体情况下,BMP2的上调则使得PDSCs保持静息状态,愈伤不会发生[41]。因此,BMP2是PDSCs活化,以及向骨软骨细胞系分化的重要信号。
骨膜在骨质修复中的作用已经得到了广泛的研究与验证,然而完全的骨质再生(肢体再生)却是少数低等动物所特有的生物学现象。蝾螈和美西螈的肢体缺失后能够实现完全再生,这种在断端形成的完全再生被称作割处再生。高等哺乳动物,如小鼠和人(胚胎期及幼儿期)仅仅能够实现指端的部分骨质再生。Elizabeth等[42]对此进行了详细的综述,发现高等动物在发育期经历远端指根截肢后,可以形成类似胚芽的结构并保留部分再生能力,但是该能力在成年后丧失(表2)。

脊椎动物断肢再生能力比较
脊椎动物断肢再生能力比较
| 物种 | 肢体再生能力 | 截肢后反应 | 截肢后再生临界位置 | 胚芽 |
|---|---|---|---|---|
| 美西螈 | 完全再生 | 割处再生 | 近端肢体 | 完整的胚芽 |
| 蝾螈 | 完全再生 | 割处再生 | 近端肢体 | 完整的胚芽 |
| 小鼠 | 部分再生(指端) | 形成伤疤 | 远端指根 | 胚芽样结构 |
| 人 | 部分再生(指端) | 形成伤疤 | 远端指根 | 未见报道 |
鹿茸是唯一的特例,其是哺乳动物雄鹿头部的骨质附属器官,可以周期性脱落并完全再生[43]。研究结果发现,鹿茸再生不同于蝾螈的断肢再生,其在再生早期没有形成胚芽样结构,不是胚芽依赖性再生而是干细胞依赖性再生[44]。这种干细胞存在于鹿茸基部的角柄骨膜中,也就是说鹿茸完全再生的组织基础是角柄骨膜。组织学研究结果表明,鹿角(完全骨化的鹿茸)脱落后,新一轮的鹿茸的再生随即在角柄的脱落面发生,角柄远端的皮肤和骨膜开始增生形成环状结构,并立即向脱落面的中心区域迁移覆盖伤口[45]。鹿角脱落1~2 d后,新形成的皮肤从四周进一步向中央区域迁移(图1)。此时,中央区域覆盖着一层结痂,结痂下面是颗粒样组织,颗粒组织之下是新生的骨小梁。角柄前部和后部新生的皮肤下出现增厚的间质层,间质层下覆盖着不连续的软骨柱。这些结构都来源于角柄远端骨膜细胞的不断增殖和分化。增厚的间充质层由2部分组成,外部的纤维层及内部的细胞层。细胞层中含有大量的间充质干细胞,其不断增殖、分化形成骨/软骨组织,由此形成了鹿茸的生长中心。对比鹿茸再生早期及小鼠截肢后骨质愈伤的组织学过程,发现小鼠截肢后断端骨质上附着的骨膜存在一个明显的增生及成软骨分化的过程[2,45,46]。但是,小鼠长骨骨膜的增生和分化潜能有限,当骨内膜形成的编织骨将骨髓腔封闭后,骨膜来源的软骨内成骨过程也随即停止,肢体的骨质伤口的愈合也相应地终止[46]。这一过程与鹿茸再生早期的表现类似,均是由骨质上附着的骨膜增生以及成软骨分化所驱动。唯一的不同是,鹿角柄骨膜的增生程度和成软骨分化潜能明显优于小鼠的长骨骨膜。最新研究结果发现,电刺激能够延缓大鼠骨髓腔的封闭时间并促进长骨骨膜进一步增殖和成软骨分化,且与对照组相比,电刺激组新生软骨四周的血管生成明显增多[2]。这一现象又与鹿茸再生时丰富的血液供给相吻合,鹿茸拥有独一无二的血管化软骨,新生的血管贯穿了整个鹿茸组织,包括间充质层、前成软骨层、过渡层和软骨层[47]。因此,骨膜的再生潜能和有效的血液供给很可能在骨膜驱动的骨质再生中起至关重要的作用。(图1)


骨膜及PDSCs在骨质修复中起着至关重要的作用,在基础研究和临床应用方面都取得了大量研究进展,是再生医学研究领域的重要方向之一。随着研究工作的深入和实验技术的不断发展,PDSCs的进一步鉴定、纯化及离体大规模培养技术不断发展,可以为骨组织工程提供更多的优质的种子细胞。对骨膜组织在促进骨修复机制的进一步探索,有利于自体及组织工程骨膜移植前后的有效处理,提高骨膜的成活效率。骨膜在长骨的再生中起着决定性的作用,探索刺激骨膜组织中干细胞有效增殖及分化潜能的途径,可以进一步促进相关临床研究及应用。鹿茸为我们提供了绝佳的机会来研究骨膜与哺乳动物骨质完全再生之间的关系,以鹿茸为模型研究角柄骨膜在鹿茸骨质再生中的作用,可以为人的肢体再生研究提供有益的借鉴。
无



























