
化学交换饱和转移(CEST)是近年发展起来的一种核磁共振技术。其利用选择性的射频脉冲饱和可交换的氢质子,通过化学交换将饱和质子转移至自由水,导致自由水池的信号降低,从而推断溶质池信息和溶质周围的环境信息。近年来,CEST技术发展极其迅速,已研发出多种CEST对比剂,具有各自的特性和应用。将重点介绍CEST的原理、信号测定、对比剂分类,以及几种常用对比剂包括酰胺质子转移成像(APT)-CEST、谷氨酸化学交换饱和转移(gluCEST)和葡萄糖化学交换饱和转移(glucoCEST)对比剂在人脑成像研究中的应用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
化学交换饱和转移(chemical exchange saturation transfer, CEST)是近年来发展起来的磁共振技术。严格地说,CEST是一种磁共振增强(扫描)技术,即施加脉冲于可交换的质子,质子被饱和标记,交换进入自由水池,导致自由水池信号改变。CEST最早由美国国立卫生研究院的Ward等[1]于2000年提出,随后CEST技术发展极其迅速,已在生物医学研究领域中得到广泛应用。与纵向弛豫时间(T1)和横向弛豫时间(T2)成像技术相比,CEST能特异性检测携带可交换质子的靶分子,且其灵敏性比磁共振波谱(magnetic resonance spectroscopy, MRS)更高,因而成为一种特异的分子影像学技术[2]。CEST的优点包括:①可以在显示对比剂空间分布的同时检测其含量。②灵敏度高,能对微摩尔级的对比剂进行浓度测定,故可检测脑内的神经递质,如谷氨酸、γ-氨基丁酸等。③可针对内源性对比剂任意"开"和"关"成像,方便快捷,安全无毒。基于上述优点,CEST已用于肿瘤检测和分级,分析缺血性病变,监控药物的输送和释放、细胞治疗的疗效、骨关节炎的进程甚至基因表达[2]。本文将重点介绍CEST的原理、信号测定、对比剂分类,以及几种常用对比剂在人脑成像研究中的应用。
顾名思义,CEST包括两个过程:化学交换(chemical exchange)和饱和转移(saturation transfer)。化学交换是指溶质分子结构上活泼的氢质子获得能量后与自由水中的氢质子发生位置交换。化学交换导致自由水中饱和质子富集,磁共振信号降低,即对溶质池的饱和干预最终传递/转移给自由水池,称为饱和转移。下文将对化学交换和饱和转移分别进行介绍,然后描述一个已被大家接受的理论模型——双池交换模型。
化学交换在物质液相、气相以及固相中均存在,在各类原子之间如氮、碳、氢间的化学交换很普遍。本文仅限于讨论液相(如自由水)的氢质子之间的化学交换。
自由水包含两个可以交换的氢质子,是很理想的氢交换溶剂体系。在自由水中发生的酸碱平衡反应以及水解反应是最基本的化学交换反应。在理论上,自由水中羟基(—OH)的质子和溶质体系中如亚胺基(—NH)上的氢质子发生位置交换需打开各自的化学键,消耗巨大的能量,尤其是在高频交换的情况下。实际上由于溶液中活泼质子的存在,令交换变得比较容易,活泼的氢质子与主核的化学位移较大,能垒较低,易与水中—OH基团的氧原子形成氢键,完成位置上的变更。多种含有氢质子的基团如—NH和—OH等含有活泼的氢质子,可与自由水中的氢质子发生化学交换。在含有可交换氢质子的化合物中,研究主要集中在与氮键合的化合物,包括无机铵盐、有机胺类、酰胺(包括多肽、蛋白质)以及吡啶和嘌呤类化合物[1]。
氢交换体并非是一步到位,实际上氢质子的传递是经过多次过渡逐步完成,形成一个氢交换的动力系统。
使用磁共振技术对与氮键结合的活泼氢质子交换首先在无机物体系中展开研究。Eigen[3]发现水作为溶质是一个由氢键搭桥构建的网络,其化学交换过程是在酸碱催化、酶水解条件下氢键复合物的形成和分解过程。在解析酸催化促进化学交换的机制时,Perrin和Gipe[4]扫描铵根离子溶质体系,发现15N标记的铵根自旋晶格弛豫和进动频率增加,从不同的铵根纵向弛豫时间推断水溶液体系中存在不同结构的铵水合物,称为亚铵结构。他们认为亚铵结构的形成促使整个溶剂-溶质系统形成一个氢键网络,通过反复的氢键断裂与形成促进氢质子交换的进行。
氢交换是一种常见的生物化学现象。蛋白质含有大量酰胺键,酰基上氢质子受邻位羰基氧原子的影响,与氮原子之间的共价性变弱,性质活泼。与无机铵类似,酰胺键可在酸催化条件下形成亚胺中间过渡结构,完成氢质子的交换传递。质子的交换速率反映了溶液中蛋白质分子内部的氢键数量以及局部结构的稳定性[5]。通过磁共振研究氢交换来描述蛋白质含量及其构象是常用的生物化学分析手段。
根据量子物理学,自旋的质子从射频脉冲中吸收能量,自低能态向高能态跃迁,使得低能态的核数越来越少,一定时间后,当低能态的氢质子数目等于高能态的氢质子数目而不再吸收射频脉冲能量时,称为"饱和"。在磁场中观察的是自旋质子群的状态,通常用磁化矢量来描述。纵向磁化矢量被90°射频脉冲偏转到x-y平面,此时再施加第2个90°射频脉冲将不会有任何信号产生,这是质子群"饱和"的外显信号特征。对于存在交换的系统而言,溶质池的氢质子被反复饱和标记,交换至自由水池,改变自由水池的磁化矢量,导致自由水池的信号强度产生衰减,故自由水池的信号改变可反应双池的交换特点以及溶质池的理化特征[6]。
为定量分析影响CEST信号的因素,也为了设计和优化实验方案,人们提出了不同的理论模型。对于一个无标量耦合的自旋系统,其化学交换过程一般用改良的布洛赫方程式进行描述[7],但在实际工作中很难得出这些方程式的精确分析解。因此,人们利用一些合理的假设来简化方程式,推导出其分析解,同时也致力于方程的稳态解或数字解。最简化的模型是Zhou等[8]提出的双池交换理论模型(图1)。按照该模型,产生化学交换的核自旋人为划分为两个池,一为自由水池(A池),另一个为溶质池(B池)。自由水池的氢质子彼此间的距离较远,在磁场中质子与质子之间的相互作用较弱,失相位的发生较慢,导致横向弛豫时间较长,在谱图上有信号显示。大分子溶质如组织蛋白质,多为结合水,这些结合的水分子失去了其部分运动自由。或者说,大分子内部以共价键结合的氢质子,彼此间距离较近,质子之间的磁场效应强,很快发生失相位,导致横向弛豫时间较短[9],信号不易被捕捉。双池之间的化学交换令溶质池中饱和标记的质子交换替代自由水池的氢质子,导致自由水池的信号衰减,因此可通过自由水池信号的改变间接探测溶质池信息[10]。
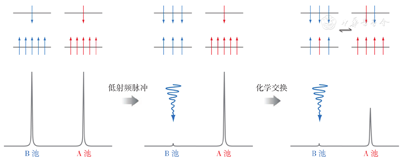

A池—自由水池;B—溶质池。低能级α-自旋排列与场强方向一致,高能级β-自旋排列与场强方向相反(图上部)。当B池被射频波饱和,自旋赋能,经化学交换进入A池,导致A池信号降低
化学交换率(k)大小适宜才能实现CEST成像。通常化学交换率需满足两个条件:①Δω>>ksw,Δω=ωw-ωs。Δω为自由水池氢质子的化学位移(ωw)与溶质池氢质子化学位移(ωs)之差,ksw为氢质子从溶质池交换至自由水池的交换率,Δω越大,CEST分辨率越高。由于化学交换最终会达到系统稳态,在既定的场强条件下,CEST效应的最大值取决于达成稳态的条件。场强越高,化学位移差越大[11]。多数内源性对比剂活泼基团的氢质子距离自由水质子化学位移0~10 ppm,Δω很小因而导致CEST效应灵敏性较差。高场强增大了Δω,也使内源性CEST对比剂成像成为现实。②ksw≥1/T1w,即化学交换率要大于自由水纵向弛豫率,以保证有效饱和[8]。
Z谱是磁化转移或CEST实验中用于表征饱和转移效应的水信号函数。在磁化转移和CEST实验中,一系列预饱和射频脉冲间隔施加于一定的频率范围上,在每一个频点采集信号,以相对于自由水的偏置频率呈现(水的位置视作0 ppm)的信号图谱称为Z谱。针对目标探针的偏置频率给予低频饱和标记,该位点附近出现氢质子的交换信息,即出现一个小的交换峰(图2A)[12]。经过相对于水的偏置频率的对称减,可得到交换峰的信息,即磁化转移以及CEST效应(图2B)[13]。公式如下
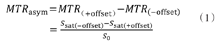

式中:MTRasym为非对称性磁化转移率,相当于CEST双池的质子转移率(proton transference exchange,PTR),MTR(+offset)为饱和标记质子的参考点磁化转移率,MTR(-offset)为饱和标记质子所在的化学位移磁化转移率,Ssat为施加饱和脉冲后不同偏置频率采集的信号强度,S0为未施加饱和脉冲的信号强度。
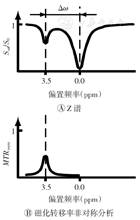

Δω—自由水池氢质子与溶质池氢质子化学位移之差;Ssat—施加饱和脉冲后不同偏置频率采集的信号强度;S0—未施加饱和脉冲的信号强度;MTRasym—非对称性磁化转移率
当弱射频脉冲作用于溶质池,假设存在两个理想化状态条件:①弱射频仅饱和溶质池,对自由水池无任何影响。②溶质池被完全饱和。则此时溶质池氢质子的横向磁化率为零,PTR可通过Block-McConnell方程演算
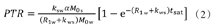
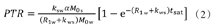
式中:ksw和kws分别为溶质池向自由水池交换的氢质子交换率以及反向交换率,R1w为自由水池纵向弛豫率,α为质子饱和率,tsat为饱和时间,M0s和M0w分别为溶质池和自由水池的初始磁化强度。
在弱饱和脉冲下,溶质池被饱和标记,其饱和率计算如下
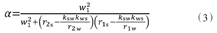
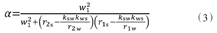
式中:r1s=1/T1s+kws,r2s=1/T2s+ksw,r1w=1/T1w+kws,r2w=1/T2w+ksw。w1为弱射频脉冲强度,ksw和kws分别为溶质池向自由水池交换的氢质子交换率以及反向交换率,T1s和T2s分别为溶质池氢质子纵向以及横向弛豫时间,T1w和T2w分别为自由水池氢质子纵向以及横向弛豫时间。由公式(2)和(3)可知,增加ksw、Δω以及溶质池用于交换的氢质子浓度,可增加CEST效应。
传统的磁共振对比剂成像是以弛豫时间为基础的,CEST对比剂成像则依赖偏置频率。CEST对比剂分类较复杂,根据是否来源于机体本身,可分为内源性和外源性CEST对比剂;根据对比剂在外加磁场作用下被磁化的方向,可分为逆磁性CEST(diaCEST)和顺磁性CEST(paraCEST)对比剂[14]。内源性CEST对比剂具有逆磁特点,而多数的顺磁性对比剂来自体外。
根据在磁场中不同的物理特性,外源性CEST对比剂分为4类:顺磁性CEST对比剂、纳米载体颗粒对比剂、超极化CEST对比剂和逆磁性CEST对比剂。
顺磁性CEST对比剂主要包括镧系金属,如镧(La)、钆(Gd)等。其成像原理在于镧系金属存在的未成对电子与水共价结合,结合在镧系金属中心部位的水被称为结合水,后者与自由水之间的氢质子化学位移之差达50 ppm,两者通过化学交换进行CEST成像[15,16]。纳米载体包括脂质体、囊泡、胶束等,载体与上述镧系金属形成络合物,可束缚更多的结合水,或改变结合水的保留时间,产生分辨率更高的CEST效应,灵敏度可达微摩尔级[17,18,19]。
在氙(Xe)家族中,129Xe化学性质稳定,天然丰度达26.4%,核自旋为1/2,核外的电子数目多,电子云体积大呈球形。129Xe对周围环境极为敏感,化学位移为7 500 ppm,比1H(20 ppm)及13C(300 ppm)大几十至几百倍[20]。129Xe在常温下是惰性气体,因其极性强,脂溶性好,能溶于血液和组织,其与组织中的分子相互作用不会带来结构和化学上的损伤,故可通过呼吸系统吸入,用于做肺部和脑的对比剂成像分析[21,22]。但129Xe与组织间的作用缺乏特异性,且易受化学环境的干扰,影响其信号的可信度。为解决该问题,一些学者将一级高靶向探针先结合在特定蛋白上,然后以129Xe作为二级探针与一级探针连结。一级探针结构的特别之处是拥有一个"穴潘笼",可通过范德瓦尔斯力束缚129Xe,并改变笼内129Xe的化学位移,笼内被束缚的129Xe和笼外自由的129Xe存在化学交换,两者间的Δω达100 ppm。如此,将可探测灵敏度从毫摩尔级提高至微摩尔级[23,24]。
另一个值得重视的外源性CEST对比剂为右旋葡萄糖。Walker-Samuel等[25]利用CEST技术成功检测到肿瘤组织(结肠-直肠癌)能摄取更多外源性的非标记右旋葡萄糖,并命名此技术为葡萄糖化学交换饱和转移(glucose chemical exchange saturation transfer, glucoCEST),其灵敏性和特异性被氟标记的右旋葡萄糖放射自显影技术所验证。同时,另一研究团队也利用此技术发现人类乳腺癌细胞系在移植入裸鼠后,肿瘤组织显示较高的glucoCEST信号,且不同表型(高恶性和低侵犯性)的肿瘤组织显示不同的glucoCEST信号,其他技术(如正电子发射断层成像、对比增强磁共振成像)则无此区分功能[26]。因此,glucoCEST技术提供了一种新的无损检测方法,对肿瘤的诊断、疗效监测与预后判断具有重要的应用价值。
外源性逆磁对比剂(除右旋葡萄糖)多为合成物,其相对分子质量小,多为临床药物制剂。最早Balaban团队[1]使用巴比妥钠进行CEST成像。其后研究人员发现碘帕醇(一种用于临床的CT成像试剂)在4.2及5.5 ppm处可产生较强烈的CEST对比[27]。水杨酸是阿司匹林在体内的代谢产物,使用水杨酸及其同源物(含—OH、—NH及—SH等活泼基团),其Δω可达10 ppm左右,在高场中可得到较理想的成像[28]。利用CEST技术研究上述药物的体内代谢动力效应以及药物在靶组织的成像,具有广阔的应用前景。
人体富含多种内源性CEST对比剂,多有逆磁效应,包括小分子物质如葡萄糖、糖原、糖胺聚糖、肌醇、乳酸、肌酐、氨基酸(谷氨酸)和核苷酸等;大分子物质如蛋白和多肽等。此外还有最早用于CEST在体研究的无机物小分子尿素。这些物质含有活泼的羟基、酰胺基团等,与自由水之间存在化学交换[29],和自由水之间的Δω多在0~6 ppm,化学位移差虽不太理想,但尚在CEST成像允许范围内[14]。
上述多种内源性物质中,不需借助外源性载体、可完全通过组织内含量实现CEST成像者主要包括糖原、糖胺聚糖、肌醇、肌酐、谷氨酸、蛋白、多肽和尿素。与外源性探针相比,内源性探针无需注射、口服以及吸入等侵入操作,从而避免了对比剂自身的毒性,是实际意义上的非侵入手段。内源性CEST对比剂来源于机体自身的组织,无需考虑外源性对比剂的代谢周期问题,可任意饱和"开""关"成像,这些优势使内源性探针的应用越来越广泛。实际上,已有越来越多的内源性CEST对比剂用于检测机体的内环境和不同代谢物的变化。例如,用于检测体内糖原代谢的糖原化学交换饱和转移(glycoCEST)[30]、检测黏多糖的黏多糖化学交换饱和转移(gagCEST)[31]、检测谷氨酸的谷氨酸化学交换饱和转移(glutamate chemical exchange saturation transfer,gluCEST)[32],以及用于检测组织pH值和肿瘤成像的酰胺质子转移成像(amide proton transfer,APT)-CEST[33,34]等。
APT-CEST由Zhou等[33,34]于2003年提出,用于检测组织内蛋白质和多肽内的可交换质子。在应用APT-CEST对大鼠脑胶质瘤模型进行成像后[33],他们对人脑胶质瘤组织进行APT-CEST扫描,区分出肿瘤核心及外周水肿带的信号强度[35],从而能清晰地描绘脑胶质瘤与正常脑组织的边界[36]。近年来研究者不断改进APT-CEST扫描技术,已能用于区分放疗导致的组织坏死与肿瘤复发[37]、高度恶性(Ⅲ级和Ⅳ级)与低度恶性(Ⅰ级和Ⅱ级)的脑胶质瘤[38,39,40]。肿瘤组织内含有较高浓度的非固定的蛋白质和多肽,故其饱和转移增加,导致APT信号升高,此解释与光谱学的研究结果相符[41]。
APT-CEST也被成功用于确定脑梗死患者脑组织的缺血区[42,43]。与胶质瘤相反,梗死区脑组织的APT信号较正常脑组织低。这是由于脑血流降低导致三磷酸腺苷水解增加,碳酸氢盐缓冲系减少,从而使细胞内pH值降低,继而引起酰胺质子的交换率减少(因蛋白内酰胺的化学交换是碱催化的)[44]。此种缺血脑组织的APT信号降低甚至在极低的饱和功率(0.5 μT)条件下仍可被检测到[45],且通过比较APT信号可区分缺血的核心区及其周围的低灌流区[44,45]。
APT-CEST用于诊断脑退行性疾病的可行性已在近期的一项研究中得以验证。Li等[46]发现,帕金森患者中脑黑质的CEST信号强度明显低于正常对照,但患者苍白球、豆状核和尾状核的不对称磁化转移率显著升高,可能与神经细胞内蛋白和多肽的聚集有关。该研究结果提示,APT-CEST信号可用于帕金森的诊断以及用作预测其疾病进展的(影像学)生物标志。
谷氨酸在脑内拥有双重角色,一方面可作为突触间隙的神经递质参与神经兴奋的传导,另一方面可作为代谢物参与脑内的能量代谢,两者互相协同参与认知和学习记忆等脑高级功能活动。谷氨酸在脑组织中的浓度较其他脑代谢物高,且其胺基的化学交换表现为一个明显的CEST峰(3.0 ppm处),因此gluCEST MRI已被成功用于检测人脑组织的谷氨酸浓度及其变化[32,47,48]。
Cai等[32]首次对脑谷氨酸进行CEST成像。他们先用体外实验演示gluCEST信号依赖于谷氨酸的浓度及溶液的pH值,接着利用动物模型验证应用gluCEST技术检测脑组织中谷氨酸浓度的可行性,最后绘制了健康人脑的gluCEST信号图谱。随后,该小组使用gluCEST技术绘制了生理状况下人大脑皮质下脑区的谷氨酸分布图谱。结果显示,灰质的谷氨酸浓度比白质高40%,gluCEST对比度在杏仁核最高,该脑区在认知和神经精神疾病的发病中起重要作用[47]。该结果意味着高分辨率的gluCEST脑成像有望成为精神疾病的有力诊断工具之一。
Haris等[49]利用gluCEST脑成像技术研究莫达芬尼对脑内谷氨酸代谢的影响,发现服用该药24 h后gluCEST信号发生显著改变,但MRS信号无明显变化。莫达芬尼在临床上用于治疗嗜睡症和物质成瘾,药理学研究结果提示其可提高脑内的谷氨酸水平。因此,上述结果表明,gluCEST为脑内谷氨酸的变化提供了更为灵敏的测试方法,为日后监控精神科药物在脑内的代谢变化提供了可靠和灵敏的生物学标志。最近的一项研究结果发现,精神分裂症患者和高危人群在皮质和皮质下脑区呈弥散性的gluCEST对比异常,提示gluCEST脑成像可用作早期诊断精神分裂症的生物学标志[50]。此外,gluCEST还能正确诊断出癫痫患者的脑颞叶发病灶[48]。
如前所述,glucoCEST技术已用于肿瘤的诊断和疗效监测。此外,其还可用于研究脑组织的代谢活动。例如,Nasrallah等[51]利用glucoCEST技术检测大鼠脑组织对2-脱氧-D-葡萄糖(2-deoxy-D-glucose, 2DG)和2-脱氧葡萄糖-6-磷酸(2-deoxyglucose-6-phosphate, 2DG6P)的摄取和代谢,发现glucoCEST信号随着代谢降低而降低,但与脑血流变化无关,此结果与31P-MRS的检测结果相同;且细胞外液的葡萄糖浓度并不影响glucoCEST信号,提示所检测的glucoCEST信号反映了2DG的代谢和摄取,而非脑脊液或血液中的葡萄糖浓度。由于2DG在神经细胞内代谢成2DG6P后既不能向前也不能向后完成代谢过程,因而其在脑组织内可存留数小时之久。因此,glucoCEST提供了一种新的研究活体脑代谢和功能的无辐射技术,具有潜在的应用前景,但目前尚无该技术应用于人体的报道。因2DG6P在神经细胞内可存留数小时之久,其对脑细胞功能的影响尚待进一步明确。
总之,CEST是一项极具发展前景的影像学技术,可用于临床前研究以及临床疾病的诊断和预后,特别是人脑功能和疾病的研究。但也存在一些制约因素限制了其应用,如采集信号时间过长,所需硬件要求高。在应用glucoCEST技术时,2DG6P在神经细胞内存留数小时之久,其对脑细胞功能可能存在一定的影响,因此目前尚无该技术应用于人体的报道。此外,一些内源性对比剂的饱和频率太近,容易引起交叉饱和,从而影响CEST成像的灵敏性和针对性。随着技术的进步(包括硬件、软件、对比剂和成像方案),CEST的一些制约因素将会被逐步克服,其在临床研究和疾病诊治中的应用也会越来越广。
无



























