
探讨在三阴性乳腺癌组织中KIF5A的表达及其临床意义。
回顾性分析82例接受乳腺癌切除手术治疗的三阴性乳腺癌患者的临床病理资料。采用免疫组化的方法检测癌组织和对应的癌旁组织中KIF5A的表达,分析其与临床病理特征的关系。
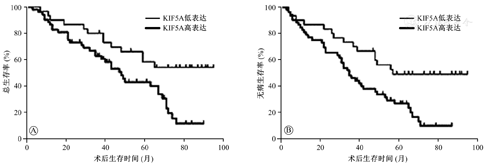
KIF5A在三阴性乳腺癌组织中的阳性高表达率为63.4%,而在癌旁组织中为低或无表达。KIF5A的异常高表达与乳腺癌高分期和淋巴结转移相关(均P<0.05),而与患者的年龄、肿瘤分级、大小和脉管瘤栓无关(均P>0.05)。生存分析提示,在三阴性乳腺癌中KIF5A高表达的患者生存时间明显短于低表达的患者(P<0.05)。
三阴性乳腺癌组织中存在KIF5A的异常高表达,并与乳腺癌的高分期和淋巴结有转移有关,且KIF5A的高表达提示三阴性乳腺癌患者可能产生不良预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
乳腺癌是世界范围内女性发病率较高的恶性肿瘤之一,可在包括小叶在内的乳腺多个部位发生,若肿瘤进一步侵袭,则会扩散转移到身体其他部位[1,2,3]。三阴性乳腺癌是乳腺癌的一种亚型,由于其细胞异质性、肿瘤易转移和分子机制的复杂性,会导致预后不良[4,5,6]。目前,针对三阴性乳腺癌的生物标志物和治疗靶点的研究不断增多[7,8]。
驱动蛋白超家族蛋白(kinesin super family proteins,KIFs)是一类基于微管的,参与细胞内细胞器运输的运动蛋白,其家族成员超过15个[9,10]。KIFs在多种细胞迁移和运输过程中发挥多重作用[11,12]。在KIFs家族成员中,一些驱动蛋白被认为参与细胞内囊泡运动,如KIF5A,其在中枢神经系统中高度表达,具有神经元特异性,能调节抑制性神经传递[13,14]。有研究结果表明,KIF5A突变可导致遗传性痉挛性截瘫,而海马组织的RNA测序也表明KIF5A在癫痫疾病中发挥一定作用[15]。外显子和RNA测序等结果表明,KIF5A在前列腺癌中有显著突变[15]。而功能实验结果证实,过表达KIFs能特异性促进肿瘤细胞对多西他赛化疗耐药性的产生[16,17]。当KIF5A或几种KIF在乳腺癌细胞系MDA-MB-231和MDA-MB-468中过表达时,细胞对多西他赛的耐药性更强[16,18]。也有研究结果表明,KIF5A可以作为检测肺癌高风险石棉沉积症患者的特异性标志物[19,20]。尽管,KIF5A可能对肿瘤的发展有影响,但其是否参与了低度恶性肿瘤(如三阴性乳腺癌)的发展过程尚不清楚,而相关的分子机制也不明确。
本研究中,回顾性分析了唐县人民医院2008年3月至2017年11月接受手术切除治疗的82例三阴性乳腺癌患者的临床病理资料,应用免疫组织化学的方法检测其乳腺癌组织中KIF5A的表达,探讨KIF5A在三阴性乳腺癌组织中的表达及临床意义,进而为三阴性乳腺癌患者的靶向治疗提供一定的临床证据和理论依据。
选取2008年3月~2017年11月河北省保定市唐县人民医院收治的三阴性乳腺癌患者的手术切除组织标本82例,年龄43~67岁,平均年龄(55.6±5.75)岁。所有患者均行根治性手术切除治疗,全部病例均病理证实,术前未经化疗或放疗,具有完整的病例资料。收集患者的一般临床资料,包括年龄、肿瘤大小、分期和分级、淋巴结转移和脉管瘤栓等。通过临床病理资料,82例患者中,肿瘤大小<2 cm者52例,≥2 cm者30例;肿瘤pTNM(pathology-tumor-node-metastasis)分期Ⅰ~Ⅱ者60例,Ⅲ~Ⅳ期者22例;病理分级低级别者50例,高级别者32例;淋巴结转移者40例;脉管内瘤栓者36例。
肿瘤分期根据2010年第7版国际抗癌联盟和美国癌症联合委员会乳腺癌分期进行中PTNM分期。以电话和查阅病历的方式随访,随访起始时间为手术时间,随访截止时间为2018年7月或患者死亡时间。
KIF5A抗体(兔抗人多克隆抗体,稀释体积百分比浓度1∶200)(英国Abcam公司),免疫组化二步法检测试剂盒(北京中衫金桥生物技术有限公司)(PV-6001,通用型二抗)。RM2235石蜡切片机(德国Leica公司),BH2-BHS光学显微镜(日本Olympus公司)。
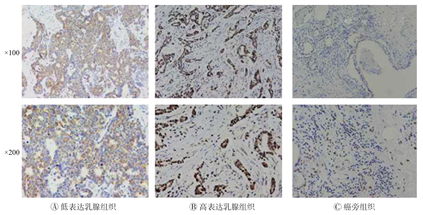
乳腺癌组织进行福尔马林固定,石蜡包埋,标本进行4 μm切片,行KIF5A免疫组化染色。免疫组织化学采用SP二步法,DAB显色,苏木染色细胞核。染色切片于显微镜下(100、200倍)观察并拍照,根据肿瘤细胞阳性染色百分率和染色强度综合评价免疫组化结果。
KIF5A蛋白表达主要定位于肿瘤细胞的胞浆,呈棕黄色颗粒状。对于阳性肿瘤细胞数:阳性肿瘤细胞数<25%记0分,肿瘤细胞阳性百分比为25%~50%记1分,肿瘤细胞阳性百分比为50%~75%记2分,肿瘤细胞阳性百分比>75%记3分。对于阳性着色的肿瘤细胞的浆染色强度:阴性记0分,弱阳性记1分,中度阳性记2分。实际结果根据阳性细胞百分率分值和染色强度分值之乘积判断,计分范围为0~6分,其中3~6分为高表达,0~2分为低表达。
应用SPSS22.0软件进行统计学分析,两组计数资料采用χ2检验,生存率计算采用Kaplan-meier法,生存曲线比较采用Log-rank检验,以P<0.05为差异具有统计学意义。
KIF5A在乳腺癌组织中存在阳性表达,其阳性高表达率为63.4%(52例/82例),而在距离肿瘤组织3~5 mm处的乳腺正常组织(癌旁组织)中未见KIF5A的阳性表达(82例)。(图1)

如表1所示,KIF5A的异常表达与三阴性乳腺癌的pTNM分期和淋巴结转移相关(均P<0.05),而与患者的年龄、肿瘤分级、肿瘤大小和脉管瘤栓无关(均P>0.05)。KIF5A高表达的三阴性乳腺癌患者术后中位生存期明显短于KIF5A低表达者(P<0.05)(图2)。

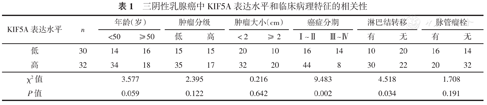
三阴性乳腺癌中KIF5A表达水平和临床病理特征的相关性
三阴性乳腺癌中KIF5A表达水平和临床病理特征的相关性
| KIF5A表达水平 | n | 年龄(岁) | 肿瘤分级 | 肿瘤大小(cm) | 癌症分期 | 淋巴结转移 | 脉管瘤栓 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| <50 | ≥50 | 低 | 高 | < 2 | ≥ 2 | Ⅰ~Ⅱ | Ⅲ~Ⅳ | 有 | 无 | 有 | 无 | ||
| 低 | 30 | 14 | 16 | 15 | 15 | 20 | 10 | 16 | 14 | 10 | 20 | 16 | 14 |
| 高 | 32 | 34 | 18 | 35 | 17 | 32 | 20 | 44 | 8 | 30 | 22 | 20 | 32 |
| χ2值 | 3.577 | 2.395 | 0.216 | 9.483 | 4.518 | 1.708 | |||||||
| P值 | 0.059 | 0.122 | 0.642 | 0.002 | 0.034 | 0.191 | |||||||
虽然研究结果表明,KIFs蛋白在多种人类恶性肿瘤中异常高表达,但对其确切的机制却不明确[11,12]。研究人员预测,KIF5A可能通过囊泡运输参与恶性肿瘤进展[21,22]。KIF5A的减少能阻碍Col-1阳性囊泡在细胞核附近的定位,导致囊泡转运缺陷[21]。有研究结果表明,KIF5B是囊泡运输的必需品,KIF5B的敲降能促进核周区囊泡的积聚[23,24]。囊泡运输与恶性肿瘤发展密切相关,但目前还需更详细的机制层面研究,以确定KIF5A是否能通过囊泡运输影响恶性肿瘤包括乳腺癌的发生发展。
近来有研究结果表明,几种KIF蛋白参与了恶性肿瘤的发生。目前,普遍认为KIF参与多种细胞过程,包括有丝分裂调节、微管稳定和纤毛组装[25]。在此基础上,KIF3B主要参与细胞迁移,KIF4A对细胞增殖至关重要,以上均对恶性肿瘤的发展产生影响[11,26]。在包括乳腺癌内的几种人类恶性肿瘤中,存在影响有丝分裂的KIF过度表达(如KIF1C)[27]。本研究结果和上述研究结果一致,即KIF5A在三阴性乳腺癌中异常高表达。最近的一项研究结果表明,升高的KIF4A和几种KIF水平与ER阳性乳腺癌患者的预后不良有关,且这些基因或蛋白的敲低能抑制乳腺癌细胞的增殖、诱导其凋亡[18]。通过检测ER阳性乳腺癌细胞中KIFs的表达,发现雌激素能促进几种KIFs驱动蛋白的表达,如KIF5A[28,29]。但目前尚无关于KIF5A和三阴性乳腺癌关系的报道。在本研究中,结合三阴性乳腺癌的临床病理特征进行分析,发现在三阴性乳腺癌中KIF5A的高表达和pTNM高分期、淋巴结有转移呈现正相关,且这种高表达提示着不良的预后。因此,可以推测KIF5A可能通过微管依赖性的运动蛋白作用于多种细胞过程,如:有丝分裂和细胞迁移,从而影响细胞增殖和迁移侵袭,进而导致乳腺癌的术后生存期短和不良预后。当然,这种推测需要进一步的体内外机制研究加以证实。
和KIF5A作为一种促癌因子的功能作用不同,近来有研究结果表明,乳腺癌中也存在KIF1A和KIF1C等KIFs成员的表达受抑制的情况,从而表现出一种类似抑癌因子的特征[18]。影响乳腺癌淋巴结转移的因素有很多,其中肿瘤分期较晚、体积较大和P53阳性表达等都能促进乳腺癌的淋巴结转移[1,2,3,4,5,6,7]。这和本研究结果相符,即本研究中发现KIF5A高表达对应了乳腺癌的较晚分期,进而促进乳腺癌的淋巴结转移,但本研究中未对组织标本中的P53表达进行检测。另外,本研究为单中心小样本研究,需要扩大样本量以及需要多中心的研究结果来进一步证实KIF5A和三阴性乳腺癌的确切关系,以及进一步探究KIF5A的具体功能和详细机制。
综上所述,KIF5A在三阴性乳腺癌中呈现异常表达,其异常高表达与三阴性乳腺癌患者的pTNM高分期、淋巴结有转移呈正相关,导致了不良预后,表明KIF5A有望成为三阴性乳腺癌治疗的新靶点。
无



























