
检测胰岛素样生长因子(IGF-1)和瘦素(LP)在结直肠癌患者血清中的表达水平,并分析其临床意义。
选取73例结直肠癌患者,37例结直肠癌良性病变患者及40例健康受试者,检测其血清IGF-1及LP水平。对结直肠患者进行为期2年的随访观察,观察其是否发生淋巴结转移。采用Logistic回归,分析影响结直肠癌患者淋巴结转移的因素。采用受试者工作特征曲线(ROC)下面积(AUC)分析IGF-1及LP用于结直肠癌及复发的诊断价值。
结直肠癌血清IGF-1浓度明显低于对照组(P<0.05),但与良性病变患者的差异无统计学意义(P>0.05)。结直肠癌血清LP水平明显高于良性病变组及对照组(均P<0.05)。IGF-1与LP均对结直肠癌有一定的诊断价值,二者联合检测诊断效能高于分别单独检测(P<0.05)。结直肠癌患者2年复发率为16.43%,复发患者年龄(≥40岁)、TNM分级(Ⅲ~Ⅳ级)、肿瘤直径(≥4 cm)、存在血管浸润及深肌层浸润的分布比例明显高于未复发患者(均P<0.05);癌转移患者血清IGF-1水平明显低于未转移者(P<0.05),LP水平明显高于未转移者(P<0.05)。血管浸润、深肌层浸润、低IGF-1水平和高LP水平为结直肠癌患者复发的独立影响因素,其联合预测结直肠癌患者复发的AUC=0.956(95%CI:0.988 1~0.990)。
在结直肠癌患者体内IGF-1呈低水平,LP呈高水平,两者与癌复发关系密切。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌的发病率位居恶性肿瘤第三位,且在我国近年来其发病率呈上升趋势[1,2]。作为一种实体恶性肿瘤,大多数结直肠癌初诊患者为中晚期,严重影响治疗与预后。目前,结直肠癌的发病机制尚不明确,可能的原因主要是各种因素导致体内众多因子出现紊乱,造成癌基因或抑癌基因相关因子信号通路异常或失活[3]。因此,研究结直肠癌相关的关键细胞因子有助于早期诊断与有效的治疗。胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)是一类多功能细胞增殖调控因子,在细胞的分化、增殖及个体的生长发育中具有重要的促进作用[4]。瘦素(leptin,LP)是由脂肪细胞分泌的蛋白质类激素,主要由白色脂肪组织产生,其前体由167个氨基酸残基组成,N末端有21个氨基酸残基信号肽;该前体的信号肽在血液中被切掉而成为146氨基酸,相对分子质量为16 ku[5]。研究结果表明,IGF-1和LP的异常表达参与肿瘤的发生和发展[6],但其机制尚未阐明,且各项研究结果不尽一致。本研究通过检测结直肠癌患者血清中的IGF-1与LP水平,分析IGF-1和LP与结直肠癌发生和发展的关系,影响淋巴结转移的因素,以及其在结直肠癌发生与复发的诊断价值。
选择2014年1月至2016年1月天津医科大学第二医院收治的73例结直肠癌患者作为结直肠癌组,37例结直肠癌良性病变患者为良性病变组,40例健康体检者为对照组。结直肠癌组中,男性44例,女性29例,年龄(43.7±5.1)岁;良性病变组中,男性20例,女性17例,年龄(41.9±5.6)岁;对照组中,男性24例,女性16例,年龄(42.8±5.1)岁。结直肠癌诊断标准符合《结直肠癌诊疗规范(2015年版)》[7]。结直肠癌组入组标准:初诊为结直肠癌,经病理学确诊,未接受过放化疗,病灶为原发病灶;排除标准:伴有其他恶性肿瘤患者,不能配合完成本研究者,镜检未发现病灶患者。本研究获得天津医科大学第二医院医学伦理委员会批准,且所有受试者检测前均签署知情同意书。
血清IGF-1水平试剂盒(德国西门子公司),酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(英国Abcam公司)。Immulite 2000全自动化学发光免疫分析仪(德国西门子公司)。
于清晨采集患者及健康对照空腹静脉血4 ml,离心分离上层血清,采用免疫分析仪检测血清IGF-1水平,采用ELISA法检测血清LP水平。
以约登指数(Youden index)评价IGF-1及LP的结直肠癌诊断效能,即假设假阴性(漏诊率)和假阳性(误诊率)的危害性有同等意义。
约登指数=灵敏度+特异度-1
根据患者随访情况评价结直肠癌的复发率,即对结直肠癌患者进行为期2年的电话随访,记录结直肠癌复发情况,复发标准包括:结节性复发、吻合口复发、腹腔内复发、局部复发合并及肝、肺等组织癌转移。应用单因素及多因素分析,基于患者临床资料分析影响结直肠癌的复发主要因素,包括患者年龄、病理类型、TNM(tumor-node-metastasis)分级、肿瘤直径、血管与深肌层浸润情况。
应用SPSS 19.0软件处理数据,符合正态分布的计量资料采用均值±标准差(Mean±SD)表示,组间比较采用单因素方差分析,组内两两比较采用q检验;计数资料用n(%)表示,采用卡方检验;利用Logistic回归分析影响结直肠癌患者复发的因素;利用受试者工作特征曲线(receiver operating characteristic curve,ROC)分析IGF-1及LP诊断结直肠癌及其复发的效能,以ROC曲线下面积(area under curve,AUC)表示。以P<0.05为差异具有统计学意义。
组间受试者性别(χ2=0.432,P=0.806)与年龄(t=1.400,P=0.251)的差异均无统计学意义,表明组间受试者间具有可比性。
结果显示,结直肠癌组和良性病变组患者血清IGF-1水平低于对照组,且差异均具有统计学意义(均P<0.05);结直肠癌组患者与良性病变组患者的血清IGF-1水平差异无统计学意义(P>0.05)。直肠癌组患者血清LP水平高于良性病变组和对照组患者,差异均具有统计学意义(均P<0.05)。(表1)
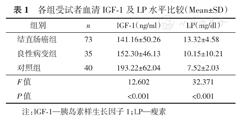
各组受试者血清IGF-1及LP水平比较(Mean±SD)
各组受试者血清IGF-1及LP水平比较(Mean±SD)
| 组别 | n | IGF-1(ng/ml) | LP(mg/dl) |
|---|---|---|---|
| 结直肠癌组 | 73 | 141.16±50.26 | 13.32±4.58 |
| 良性病变组 | 35 | 152.30±46.13 | 10.15±10.21 |
| 对照组 | 40 | 193.22±62.04 | 7.52±2.03 |
| F值 | 12.602 | 32.371 | |
| P值 | <0.001 | <0.001 |
注:IGF-1—胰岛素样生长因子1;LP—瘦素
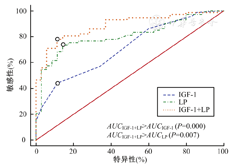
结果表明,IGF-1诊断结直肠癌的最大约登指数为0.396,对应的最佳截断点为145.37 ng/ml;LP诊断结直肠癌的最大约登指数为0.597,对应的最佳截断点为12.35 mg/dl;IGF-1+LP联合检测诊断结直肠癌的最大约登指数为0.667。诊断效能排序为:AUCIGF-1+LP>AUCLP>AUCIGF-1。(图1、表2)
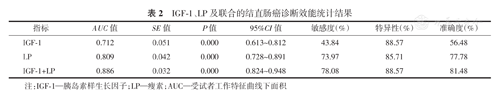
IGF-1、LP及联合的结直肠癌诊断效能统计结果
IGF-1、LP及联合的结直肠癌诊断效能统计结果
| 指标 | AUC值 | SE值 | P值 | 95%CI值 | 敏感度(%) | 特异性(%) | 准确度(%) |
|---|---|---|---|---|---|---|---|
| IGF-1 | 0.712 | 0.051 | 0.000 | 0.613~0.812 | 43.84 | 88.57 | 56.48 |
| LP | 0.809 | 0.042 | 0.000 | 0.728~0.891 | 73.97 | 85.71 | 77.78 |
| IGF-1+LP | 0.886 | 0.032 | 0.000 | 0.824~0.948 | 78.08 | 88.57 | 81.48 |
注:IGF-1—胰岛素样生长因子;LP—瘦素;AUC—受试者工作特征曲线下面积

IGF-1—胰岛素样生长因子;LP—瘦素;AUC—受试者工作特征曲线下面积
对患者2年的随访结果显示,73例结直肠癌患者中复发12例(16.43%),未复发61例(83.56%)。单因素分析结果显示,复发患者中,年龄≥40岁、TNM III~IV级、肿瘤直径≥4 cm、存在血管浸润及深肌层浸润的分布比例明显高于未复发者,且差异均具有统计学意义(均P<0.05);复发与未复发患者的病理类型差异无统计学意义(P>0.05);癌转移患者血清IGF-1水平低于未转移者,LP水平高于未转移者,差异均具有统计学意义(均P<0.05)。(表3)
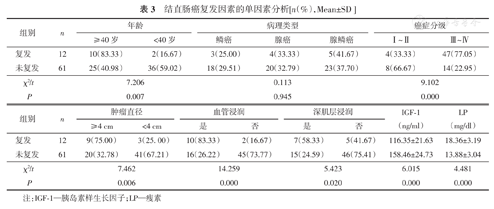
结直肠癌复发因素的单因素分析[n(%),Mean±SD]
结直肠癌复发因素的单因素分析[n(%),Mean±SD]
| 组别 | n | 年龄 | 病理类型 | 癌症分级 | ||||
|---|---|---|---|---|---|---|---|---|
| ≥40岁 | <40岁 | 鳞癌 | 腺癌 | 腺鳞癌 | Ⅰ~Ⅱ | Ⅲ~Ⅳ | ||
| 复发 | 12 | 10(83.33) | 2(16.67) | 3(25.00) | 4(33.33) | 5(41.67) | 4(33.33) | 47(77.05) |
| 未复发 | 61 | 25(40.98) | 36(59.02) | 18(29.51) | 20(32.79) | 23(37.70) | 8(66.67) | 14(22.95) |
| χ2/t | 7.206 | 0.113 | 9.102 | |||||
| P | 0.007 | 0.945 | 0.000 | |||||
| 组别 | n | 肿瘤直径 | 血管浸润 | 深肌层浸润 | IGF-1(ng/ml) | LP(mg/dl) | |||
|---|---|---|---|---|---|---|---|---|---|
| ≥4 cm | <4 cm | 是 | 否 | 是 | 否 | ||||
| 复发 | 12 | 9(75.00) | 3(25. 00) | 10(83.33) | 2(16.67) | 7(58.33) | 5(41.67) | 116.35±21.63 | 18.36±3.19 |
| 未复发 | 61 | 20(32.78) | 41(67.21) | 16(26.22) | 45(73.77) | 15(24.59) | 46(75.41) | 158.46±24.73 | 13.88±3.04 |
| χ2/t | 7.462 | 14.259 | 5.423 | 6.015 | 4.481 | ||||
| P | 0.006 | 0.000 | 0.020 | 0.000 | 0.000 | ||||
注:IGF-1—胰岛素样生长因子;LP—瘦素
将单因素分析结果中有统计学意义的因素纳入多因素回归分析,以是否发生淋巴结转移为因变量(转移=1、未转移=0),对各因素进行赋值,其中:年龄(≥40岁=1、<40岁=0)、TNM分级(Ⅰ~Ⅱ级=0、Ⅲ~Ⅳ级=1)、肿瘤直径(≥4 cm=1、<4 cm=0)、血管浸润(是=1、否=0)、深肌层浸润(是=1、否=0)、IGF-1(低=1、高=0)和LP水平(高=1、低=0)。回归分析结果显示,血管浸润、深肌层浸润及低水平IGF-1、低水平LP为结直肠癌患者复发的独立影响因素。(表4)
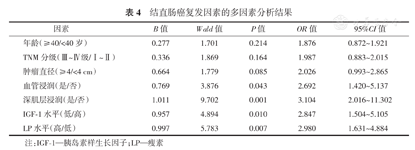
结直肠癌复发因素的多因素分析结果
结直肠癌复发因素的多因素分析结果
| 因素 | B值 | Wald值 | P值 | OR值 | 95%CI值 |
|---|---|---|---|---|---|
| 年龄(≥40/<40岁) | 0.277 | 1.701 | 0.214 | 1.876 | 0.872~1.921 |
| TNM分级(Ⅲ~Ⅳ级/Ⅰ~Ⅱ) | 0.336 | 1.869 | 0.164 | 1.987 | 0.883~2.015 |
| 肿瘤直径(≥4/<4 cm) | 0.664 | 1.779 | 0.085 | 2.026 | 0.993~2.865 |
| 血管浸润(是/否) | 0.769 | 3.876 | 0.043 | 2.692 | 1.420~5.137 |
| 深肌层浸润(是/否) | 1.011 | 9.702 | 0.001 | 3.104 | 2.016~11.302 |
| IGF-1水平(低/高) | 0.957 | 4.894 | 0.010 | 2.847 | 1.504~5.105 |
| LP水平(高/低) | 0.997 | 5.783 | 0.007 | 2.980 | 1.631~4.884 |
注:IGF-1—胰岛素样生长因子;LP—瘦素
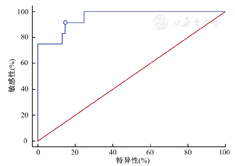
选取结直肠癌患者复发的独立影响因素:血管浸润、深肌层浸润、低IGF-1水平和高LP水平,进行结直肠癌患者复发的多因素联合预测分析。结果表明,以上4项指标联合预测结直肠癌患者复发的AUC为0.956(95%CI:0.988 1~0.990),其预测复发的最大约登指数为0.769、敏感度为91.67%、特异性为85.25%、准确率为86.30%。(图2)

LGF-1和LP与细胞增殖、分化、凋亡以及肿瘤发生和发展密切相关。IGF-1是多功能细胞增殖调控因子,能促进脂肪组织的糖代谢和糖转运,促进脂肪和糖元合成,还能促进蛋白质、DNA和RNA的合成,最终导致多种细胞增殖。有研究结果显示,IGF-1在肿瘤组织中的表达明显低于正常组织[8]。本研究中直肠癌组和良性病变组患者的血清IGF-1水平相近,但均低于对照组,该结果与既往报道相一致[9],提示IGF-1因子的调控途径与结直肠癌的病理进程具有相关性。LP是一种由脂肪组织分泌的激素,此前普遍认为LP进入血液循环后会参与糖、脂肪及能量代谢的调节,促使机体减少摄食,增加能量释放,抑制脂肪细胞的合成,而LP水平的下调能直接引起胰岛素敏感性的下降。有研究结果证实,LP在肿瘤细胞中呈高水平,而在良性病变组织及正常的细胞组织中呈低水平[10]。本研究结果显示,直肠癌组患者血清LP水平高于良性病变组及对照组患者,提示在结直肠癌的发生和发展中,LP可能发挥着重要作用。同时,本研究中对IGF-1和LP诊断结直肠癌的效能进行了比较,结果表明,IGF-1和LP联合检测结直肠癌的准确性优于单独IGF-1或LP。此外,对2年后的结直肠癌的复发情况进行了分析;结果表明,结直肠癌患者的2年复发率为16.43%,其中复发患者IGF-1血清水平低于未复发者,而LP血清水平高于未复发者,表明IGF-1和LP与结直肠癌患者的复发可能存在一定关系。
通过单因素和多因素分析,对结直肠癌复发的影响因素进行了分析。单因素研究结果显示,复发患者中年龄(≥40岁)、TNM分级(Ⅲ~Ⅳ级)、肿瘤直径(≥4 cm)、存在血管及深肌层浸润的比例明显高于未复发者,且复发组患者血清IGF-1水平低于未复发组,LP水平高于未复发组。多因素回归结果显示,血管浸润、深肌层浸润、低水平IGF-1及高水平LP为结直肠癌患者复发的独立影响因素。以往报道显示,结直肠系膜组织含有丰富的血管和淋巴管,癌细胞离开原发灶或转移灶进入血液循环系统形成循环肿瘤细胞,并存活形成转移灶,血管浸润可能导致肿瘤早期复发[11]。有研究结果表明,侵肌深度小于1/2的结直肠膜癌复发率较低,侵肌深度大于1/2的膜癌复发率较高[12]。本研究中深肌层侵润与结直肠癌的复发相关并且为其复发的独立影响因素,与以往报道一致[13]。除可促进细胞增殖和分化,IGF-1还可增强血管内皮生长因子(vascular endothelial growth factor,VEGF)等相关因子的表达水平,提高细胞的丝裂原作用。VEGF在肿瘤的生长和转移中发挥作用,而在IGF-1的增殖促进下,细胞的增殖将更加旺盛,从而为癌细胞的转移与浸润提供条件。本研究结果证实,IGF-1可作为结直肠癌患者复发的指标。LP是一种蛋白质激素,近年来临床和基础研究证实其与肿瘤的发生密切相关[14],可促进多种细胞增殖与分化。Moazzezy等[15]发现LP在正常结肠黏膜腺管上皮有微弱表达,而在人结肠癌手术切除标本的癌组织、转移到肝的癌组织、癌旁组织、腺瘤、多发性息肉等均可检测到其mRNA的明显表达,表明在肿瘤中LP表达增加。因此,LP也可作为结直肠癌患者复发的指标。
综上所述,IGF-1和LP均与结直肠癌的发生和发展有关,结直肠癌患者血清中IGF-1呈低水平,LP呈高水平,且两者与结直肠癌复发关系密切。IGF-1和LP有望作为直肠癌患者复发的评估指标。本研究中采用的是单中心分析,其结果在一定程度上存在误差,今后研究中将加大样本量并开展多中心研究进一步证实以上观点。
所有作者均声明不存在利益冲突



























