
探究MDM2-p53信号通路在结直肠癌发生和发展中的作用机制,以及p53表达与临床病理参数间的关系,进一步分析其对长期预后的影响。
收集86例患者的结直肠癌组织及癌旁正常组织。分别通过免疫组化、蛋白印迹、实时荧光定量法测定结直肠癌及癌旁正常组织中p53和鼠双微基因2(MDM2)的表达。采用Kaplan-Meier生存曲线对患者进行预后分析。
在结直肠癌组织中p53和MDM2的蛋白表达与mRNA表达水平均明显高于癌旁组织(均P<0.01),且二者表达呈现正相关(r=0.785)。结直肠癌组织中p53的表达与肿瘤分化程度、TNM分期、淋巴结转移、浸润深度临床病理特征有关(均P<0.05)。p53高表达组平均总生存时间为(53.92±1.56)个月,明显低于p53低表达组的平均总生存时间(69.16±3.72)个月,差异有统计学意义(χ2=14.78,P<0.01)。
结直肠癌的发病风险及预后与MDM2-p53信号通路密切相关,p53可作为结直肠癌预后和治疗效果的潜在靶点。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌是消化系统最常见的恶性肿瘤之一,全球发病率和死亡率呈逐年上升趋势,每年新增病例超过100万[1,2]。结直肠癌的发生与多种因素有关,如MAPK等信号通路[3]、O6-甲基鸟嘌呤-DNA甲基转移酶MGMT[4]、基因多态性[5]等。此外,身体及心理上困扰、高脂饮食都能可诱导和促进结直肠癌的发生[6,7]。
作为迄今被发现的与人类肿瘤相关性最高的基因,p53分为野生型和突变型,前者为肿瘤抑制蛋白,后者则失去了肿瘤抑制功能,反而起到促进肿瘤进展(促进细胞增殖、抑制细胞凋亡)的作用[8]。此外,p53的抗体依赖于突变型p53蛋白,检测的是突变型p53蛋白的表达水平[8]。目前,虽然对突变型p53已经进行了大量研究,但对突变型p53促进结直肠癌发生的分子机制仍不明确。鼠双微基因2(mouse double minute 2,MDM2)是调控p53的主要蛋白之一,可结合p53并抑制p53转录活性[9]。研究结果表明,肿瘤化疗药物抗性机制与MDM2及p53密切相关[10]。目前,尽管已有多项研究报道了p53表达与结直肠癌患者年龄、性别、分化程度等临床病理参数间的关系,但突变型p53促进结直肠癌发生的分子机制仍有待阐明。另外,MDM2-p53信号通路在结直肠癌发展过程中的潜在作用,及不同p53表达对结直肠癌患者长期预后的影响也鲜有报道。
本研究中,分析p53蛋白在结直肠癌的表达及其与临床病理参数间的关系,探究MDM2-p53信号通路在结直肠癌发展过程中的潜在作用机制,为结直肠癌的临床诊治提供分子生物学依据。
选择2005年6月~2007月6月间在天津医科大学第二医院行结直肠癌根治术的患者86例,其中男性54例,女性32例,年龄(63.4±6.7)岁。收集所有患者的结直肠癌组织,同时收集其距癌组织边缘>10 cm的正常组织作为对照。所有患者的病理资料均经2名病理医师进行组织病理学检查,且明确诊断为结直肠癌,术前均未行放、化疗等辅助治疗。病理诊断标准为国际抗癌联盟制定的第七版TNM(tumor-node-metastasis)分期系统[11]。
鼠抗人p53、MDM2蛋白单克隆抗体一抗、通用型羊抗鼠抗体二抗、免疫组织化学试剂盒(北京中杉金桥生物技术有限公司),二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒、二氨基联苯胺(Diaminobenzidine, DAB)显色试剂盒(武汉博士德生物工程有限公司),逆转录试剂盒(日本TaKaRa公司)。RM2235型石蜡切片机(德国莱卡公司),BMJ-III型组织包埋机(常州中威电子仪器厂),BX51型显微镜(日本Olympus公司)。
采集到的结直肠癌组织与癌旁组织离体后置于10%福尔马林固定并进行石蜡包埋[12]。行常规石蜡切片(5 μm),恒温箱60 ℃环境烤片4 h,4 ℃冰箱留存,行免疫组织化学染色。H2O2-甲醇液处理15 min,磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗2 min×3次,加封闭液孵育10 min。倒掉液体并加蛋白单克隆抗体(1∶100),4 ℃过夜。PBS洗2 min×3次,加抗小鼠生物素化二抗孵育10 min,PBS洗2 min×3次。加辣根过氧化物酶(horseradish peroxidase,HRP)标记链亲和素孵育10 min,PBS洗2 min×3次。DAB显色、水洗、复染、脱水、透明、封片。每张切片于显微镜下选取5个视野,由2位有经验的病理学专家进行双盲鉴定。每个视野计数100个瘤细胞,计算阳性细胞数占整个细胞数的染色阳性率。染色阳性率≤50%为低表达组,>50%为高表达组。
采集到的结直肠癌组织与癌旁组织离体后浸入液氮并转移至-80 ℃冰箱保存。通过Western Blot测定结直肠癌组织和癌旁组织中的p53蛋白表达。按常规方法提取蛋白质并用BCA法进行蛋白定量,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,转膜、封闭,加一抗(β-actin 1∶1 000,p53一抗1∶2 000;MDM2一抗1∶500),4 ℃孵育过夜。洗膜,分别加入二抗HRP标记羊抗鼠IgG稀释液(1∶2 000;1∶200),室温下孵育2 h,用免疫荧光成像系统显色,图像分析软件扫描条带灰度值,计算各组蛋白表达相对定量,每个实验重复3次。
采集到的结直肠癌组织与癌旁组织离体后浸入液氮并转移至-80 ℃冰箱保存。利用TRizol法提取组织总RNA,定量后参照逆转录试剂盒说明合成cDNA,进行实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,RT-PCR)测定,以β-actin为内参。上游引物p53-F:5'-GGAAATCTCACCCCATCCCA-3,下游引物p53-R:5'-AAGGCCTTCTGTGAGTCCTC-3';上游引物MDM2-F:5'-AATCATCGGACTCAGGTACA-3',下游引物MDM2-R:5'-GTCAGCTAAGGAAATTTCAGG-3';上游引物β-actin-F:5'-CTCCATCCTGGCCTCGCTGT-3',下游引物β-actin-R:5'-GCTGTCACCTTCACCGTTCC-3'。反应条件为95 ℃预变性3 min、95 ℃ 10 s、55℃ 30 s、39个循环,反应体系为20 μl。
采用SPSS 17.0统计学软件进行数据处理。所有定量资料以均值±标准差(Mean±SD)表示,两组间比较采用t检验;定性资料采用频数和百分数表示,组间差异均采用χ2检验或Fisher检验;Pearson相关分析结直肠癌组织p53表达与MDM2表达的关系;Kaplan-Meier生存曲线采用Log-rank检验,分析p53蛋白与结直肠癌患者的临床预后。以P<0.05为差异有统计学意义。
结直肠癌组织和癌旁正常组织中p53蛋白阳性表达呈棕黄色颗粒,主要定位于细胞核(图1)。p53在结直肠癌和癌旁组织中的mRNA相对表达与p53蛋白表达趋势一致。结直肠癌组织中p53的mRNA相对表达(2.86±1.14)明显高于癌旁组织(1.52±0.56),差异有统计学意义(t=1.08,P<0.01)。p53蛋白在结直肠癌组织阳性表达率(n=63,73.26%)明显高于癌旁组织(n=41,47.67%),差异有统计学意义(χ2=11.771,P<0.01)。
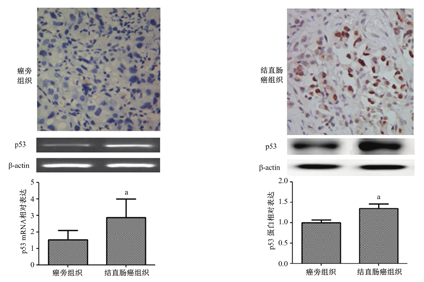

与癌旁组织比较,aP<0.01
如图2所示,MDM2阳性主要分布于细胞核。MDM2的mRNA相对表达与蛋白表达趋势一致。结直肠癌组织中MDM2的mRNA表达高于癌旁组织(1.32±0.37 vs 0.67±0.19),差异有统计学意义(t=1.72,P<0.01)。结直肠癌组织中MDM2的蛋白表达也高于癌旁组织(3.35±1.14vs 1.83±0.94),差异有统计学意义(t=1.51、P<0.01)。
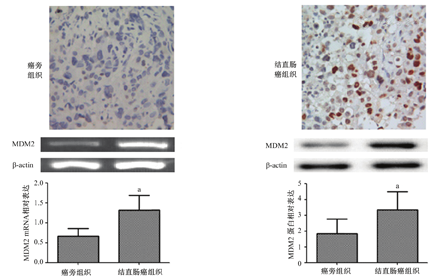

MDM2—鼠双微基因2;与癌旁组织比较,aP<0.01
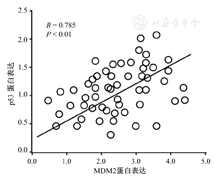
Pearson相关分析表明,在结直肠癌组织中,p53表达与MDM2的表达呈显著正相关(r=0.785、P<0.01)。(图3)

为了探究p53表达与结直肠患者临床病理特征的相关性,按照性别、年龄、肿瘤部位、肿瘤大小、分化程度、TNM分期、淋巴结转移、浸润深度对86例结直肠患者的p53表达情况进行了分析。结果表明,p53低表达和高表达情况与患者性别、年龄、肿瘤部位、肿瘤大小临床病理特征均无显著相关性(均P>0.05),但与肿瘤分化程度、TNM分期、淋巴结转移、浸润深度临床病理特征有显著相关性(χ2=4.872,P=0.027;χ2=13.936,P<0.001;χ2=11.820,P=0.001;χ2=6.475,P=0.011)。
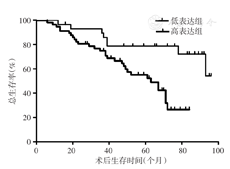
将所收集的结直肠癌病例分成p53高表达组与低表达组,统计分析p53蛋白表达与结直肠癌患者预后的关系。结果表明,p53高表达组平均总生存时间为(46.10±21.24)个月,p53低表达组平均总生存时间为(65.60±25.73)个月。经Log-rank检验,Kaplan-Meier生存曲线显示,p53低表达组患者总生存期明显高于p53高表达组,差异有统计学意义(χ2=10.41,P<0.05)。(图4)

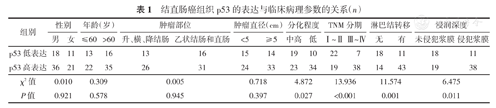
结直肠癌组织p53的表达与临床病理参数的关系(n)
结直肠癌组织p53的表达与临床病理参数的关系(n)
| 组别 | 性别 | 年龄(岁) | 肿瘤部位 | 肿瘤直径(cm) | 分化程度 | TNM分期 | 淋巴结转移 | 浸润深度 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 男 | 女 | ≤60 | >60 | 升、横、降结肠 | 乙状结肠和直肠 | <5 | ≥5 | 中高 | 低 | Ⅰ~Ⅱ | Ⅲ~Ⅳ | 无 | 有 | 未侵犯浆膜 | 侵犯浆膜 | |
| p53低表达 | 18 | 11 | 13 | 16 | 13 | 16 | 15 | 14 | 19 | 10 | 22 | 7 | 18 | 11 | 18 | 11 |
| p53高表达 | 36 | 21 | 22 | 35 | 26 | 31 | 24 | 33 | 23 | 34 | 19 | 38 | 14 | 43 | 19 | 38 |
| χ2值 | 0.010 | 0.309 | 0.005 | 0.718 | 4.872 | 13.936 | 11.574 | 6.475 | ||||||||
| P值 | 0.921 | 0.578 | 0.945 | 0.397 | 0.027 | <0.001 | 0.001 | 0.011 | ||||||||
结直肠癌发病率位于全球恶性肿瘤的第3位,5年存活率低于10%[13]。结直肠癌的发生是一个多因素、多阶段逐渐累积的过程,与癌基因激活和抑癌基因失活有关。p53基因位于人类17P13.1区域,10个内含子和11个外显子,其编码393个氨基酸蛋白,分为野生型和突变型。大量研究结果表明,p53可以通过调控其他基因参与信号通路影响肿瘤的发生和发展[14]。p53等基因突变可导致表皮生长因子受体(EGFR)介导的PI3K-PTEN-AKT信号通路持续激活,参与结直肠癌的发生和发展[15]。p53突变在宫颈癌和乳腺癌等细胞增殖、凋亡和DNA损伤修复等生物学过程中也发挥重要作用[16,17]。MDM2作为泛素蛋白连接酶的重要成员之一,是RING型E3连接酶,在结肠癌细胞增殖与凋亡中发挥重要作用[8]。本研究分析了p53在结直肠癌及癌旁组织的表达差异及其与临床病理参数间的关系,探究了MDM2-p53信号通路在结直肠癌发展过程中的潜在作用机制,为分析患者预后与临床诊断提供了支持。
本研究中,病理分析结果表明,p53主要位于腺体的细胞核,部分胞浆也有表达,在结直肠癌组织中的阳性表达率(73.26%)明显高于癌旁组织(12.79%),该结果与前人结果一致[18]。有研究结果表明,结直肠癌组织p53蛋白主要表达在细胞中,其阳性表达率(55.56%)明显高于正常组织(12%)[19]。Western Blot及RT-PCR结果与免疫组化结果相一致,即结直肠癌组织中p53和MDM2的蛋白水平与mRNA水平均显著高于癌旁组织(均P<0.01)。相关性分析结果表明,p53表达与MDM2表达呈现正相关关系(r=0.785,P<0.01)。有研究报道,MDM2-p53信号通路在细胞凋亡过程中发挥重要作用[20]。以上结果表明,MDM2-p53信号通路可能在结直肠癌发病过程发挥着重要作用,p53可能与MDM2相互结合参与细胞增殖与凋亡。
p53在结直肠癌的发生和发展中起重要作用。然而国内外研究结果显示,p53表达与临床病理特征的关系一直存在较大争议。马海龙等[12]的研究结果表明,p53表达与结直肠癌患者性别、年龄、部位、分化程度、Dukes分期、淋巴结转移无明显相关性。闫世贤等[18]得出,p53蛋白的表达与T分期、淋巴结转移数量和脉管浸润有关,而与肿瘤分化程度等病理特征无关。有研究结果表明,p53参与分化但不参与分化相关的成肌细胞凋亡[19]。郑勇等[21]的研究结果表明,结直肠癌组织中p53表达仅与肿瘤分化程度有关,而与其他临床特征均无相关性。本研究结果表明,结直肠癌组织中p53的表达与肿瘤分化程度、TNM分期、淋巴结转移、浸润深度均有关(均P<0.05)。分析上述现象,其原因可能与研究纳入的样本数或患者纳入排除标准不同所致,也可能由地区差异所导致。
此外,通过对结直肠癌患者进行长期随访,并进行Kaplan-Meier生存曲线分析,结果显示p53表达高低与结直肠癌患者生存期显著相关,p53低表达患者总生存期明显长于高表达患者。相关研究结果表明,p53阳性表达患者生存率和生存期明显低于阴性患者[22,23],有力地支持了本研究的结论。因此,p53表达可作为评估结直肠癌患者预后重要的参考指标。
综上,p53基因在结直肠癌组织中呈高表达,其高表达患者的平均总生存时间明显低于低表达者。结直肠癌的发生和发展与MDM2-p53信号通路密切相关,p53可作为结直肠癌预后和治疗效果的潜在靶点。结直肠癌中p53表达与临床病理特征的关系需要更多的研究加以证实。
所有作者均声明不存在利益冲突



























