
系统评估淋巴血管侵犯(LVI)与伴有鳞状分化的T1期膀胱尿路上皮癌的病理特征及预后的相关性。
回顾性分析105例确诊为T1期尿路上皮癌伴鳞状分化且接受经尿道膀胱肿瘤电切手术(TURBT)的患者临床与病理资料。采用苏木精-伊红染色和免疫组化染色确定肿瘤组织中LVI的存在。将所有患者按LVI,分为阴性组和阳性组,分析LVI与临床病理特征及5年肿瘤特异性生存率(CSS)的关系。将复发患者按复发后治疗方式,分为TURBT组和根治性膀胱切除术(RC)组,比较手术方式对CSS的影响。
在105例患者中,有57例(27.6%)出现LVI。在LVI阴性的患者中,其5年CSS为84.9%;而LVI阳性患者为58.4%,差异有统计学意义(P<0.05)。单因素分析结果表明,肿瘤多发情况、肿瘤大小、复发及LVI与CSS具有显著相关性(均P<0.05)。多因素分析结果表明,肿瘤大小和LVI对CSS的影响显著(均P<0.05)。在LVI阳性的复发患者中,行RC较TURBT有更高的CSS(P=0.042);而对于LVI阴性患者,两种方法的差异无统计学意义(P=0.692)。
伴鳞状分化的T1期膀胱尿路上皮癌中LVI是一种重要的预后因子,LVI和肿瘤≥3 cm的患者具有更高的死亡风险。T1期膀胱癌伴鳞状分化尤其是合并LVI的患者应尽早行RC治疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
恶性肿瘤的分化程度与其预后密切相关。在非肌层浸润膀胱癌中,鳞状化生是最常见的分化方式。肿瘤细胞的侵犯深度对患者预后有重要影响,其中,膀胱癌细胞的淋巴血管侵犯(lymphovascular invasion, LVI)是肿瘤细胞传播的关键步骤[1,2,3,4,5]。目前,针对LVI在膀胱癌中的作用已有大量研究[6,7,8,9,10],但LVI在伴有鳞状分化的T1期膀胱尿路上皮癌中的作用尚不明确。因此,本研究对T1期鳞状分化的尿路上皮癌患者的临床病理资料进行回顾性分析,系统评估LVI与其病理特征及预后的相关性。
选择2006年1月至2016年12月间在天津市咸水沽医院就诊的T1期伴鳞状分化的尿路上皮癌患者105例,其中男性86例,女性19例,年龄(67.0±8.1)岁,所有患者均在初次治疗时选择经尿道膀胱肿瘤电切手术(transurethral resection of bladder tumor, TURBT)治疗。所有患者均在术后病理证实为T1期伴鳞状分化的膀胱尿路上皮癌,诊断标准为尿路上皮癌中出现细胞间桥或角化。排除标准:既往有尿路上皮癌或伴有上尿路肿瘤病史;在随访期内发生另一种或者更多原发恶性肿瘤。
收集患者的一般临床资料,包括年龄、性别、肿瘤分级、肿瘤大小、复发与治疗方法和LVI。所有的手术样本均重新进行病理评估,以充分评估肿瘤分级、分期和LVI。肿瘤分期依据2009年国际抗癌联盟(Union for International Cancer Control, UICC)的分期标准进行TNM(tumor-node-metastasis)分期。肿瘤分级基于2004年世界卫生组织(World Health Organization, WHO)的分级系统,以消除膀胱肿瘤分级复杂的影响因素。术后每3个月进行复查和随访,随访中常规进行膀胱镜或泌尿系统彩超检查。肿瘤的特异性生存率(cancer specific survival, CSS)以手术当天开始计算。
在所有进行TURBT的肿瘤组织标本中,采用苏木精-伊红染色和免疫组化染色确定LVI的存在。LVI的确定标准为癌细胞侵入血管系统、淋巴系统或两者的内皮以内。
采用SPSS22.0统计学软件处理数据,符合正态分布数据用均值±标准差(Mean±SD)表示,分别使用卡方检验和t检验对分类和连续变量间的关系进行评价,采用Kaplan-Meier法计算生存趋势,使用对数轶统计对差异水平进行评估,采用单因素和多因素Cox回归模型分析手术后的总体生存率,以P<0.05为差异有统计学意义。
结果表明,105例患者中有29例(27.6%)具有LVI。通过危险因素分析发现,LVI阳性与患者性别、年龄、肿瘤单多发情况和肿瘤大小的相关性无统计学意义(均P>0.05)。而在LVI阳性患者中,高级别肿瘤的比例高于LVI阴性患者,差异有统计学意义(P<0.05)。在LVI阳性患者中,鳞状分化的尿路上皮癌的复发率为48.3%(14/31);而在LVI阴性患者中,复发率为26.3%(20/76),其差异有统计学意义(P<0.05)。(表1)

LVI与临床病理特征的关系
LVI与临床病理特征的关系
| 组别 | 年龄(岁) | 性别 | 肿瘤分级 | 单多发情况 | 肿瘤直径 | 肿瘤复发 | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 男 | 女 | 低 | 高 | 单发 | 多发 | <3 mm | ≥3 mm | 无 | 有 | ||
| LVI阴性 | 67.1±7.9 | 62 | 14 | 53 | 23 | 46 | 30 | 55 | 21 | 56 | 20 |
| LVI阳性 | 69.8±5.3 | 24 | 5 | 8 | 21 | 14 | 15 | 19 | 10 | 15 | 14 |
| P值 | 0.774 | 0.888 | <0.001 | 0.257 | 0.491 | 0.032 | |||||
注:LVI—淋巴血管侵犯
对患者的平均随访时间为(61.7±10.9)个月。结果表明,LVI阳性和阴性患者的无进展生存时间分别为(26.5±3.7)个月和(57.6±6.4)个月,差异有统计学意义(χ2= 9.991,P=0.006)。LVI阳性和阴性患者的肿瘤特异性生存时间分别为(62.3±6.7)个月和(85.2±8.4)个月,差异有统计学意义(χ2= 6.867,P=0.012)。
Kaplan-Meier生存曲线显示,LVI阳性和阴性患者的5年CSS分别为58.4%和84.9%,差异有统计学意义(P=0.001,图1)。如图2所示,对于肿瘤低级别组,LVI阳性和阴性患者的5年CSS分别为31.3%和82.7%,差异有统计学意义(P<0.05);而对于肿瘤高级别组,LVI阳性和阴性患者的5年CSS分别为53.6%和81.8%,差异有统计学意义(P<0.05)。


LVI—淋巴血管侵犯


LVI—淋巴血管侵犯
当使用单因素Cox回归分析肿瘤的影响因素时,得到肿瘤多发情况、肿瘤大小、肿瘤复发、LVI是患者预后CSS相关的影响因素,其风险比(hazard ratio,HR)分别为1.548、1.763、1.887和3.121;而患者年龄、性别和肿瘤分级不是预后CSS相关的影响因素。多因素Cox回归分析结果显示,只有肿瘤大小和LVI对患者5年CSS的影响有统计学意义。(表2)

单因素和多因素Cox回归分析预测肿瘤特异性生存率
单因素和多因素Cox回归分析预测肿瘤特异性生存率
| 因素 | 单因素分析 | 多因素分析 | ||||
|---|---|---|---|---|---|---|
| 风险比 | 95%CI | P值 | 风险比 | 95%CI | P值 | |
| 年龄 | 1.006 | 0.975~1.023 | 0.655 | — | — | — |
| 性别 | 0.413 | 0.145~1.122 | 0.104 | — | — | — |
| 肿瘤分级 | 1.246 | 0.757~1.470 | 0.209 | — | — | — |
| 多发情况 | 1.548 | 1.100~2.355 | 0.044 | 1.327 | 0.855~2.326 | 0.245 |
| 肿瘤大小 | 1.763 | 1.305~3.084 | 0.026 | 2.305 | 1.433~4.631 | 0.001 |
| 肿瘤复发 | 1.887 | 1.209~3.161 | 0.019 | 1.123 | 0.691~2.124 | 0.308 |
| LVI | 3.121 | 1.969~5.422 | <0.001 | 3.744 | 2.302~7.931 | <0.001 |
注:LVI—淋巴血管侵犯;"—"表示无此项
如表3所示,共有34例患者发生复发,其中有15例继续接受TURBT治疗,19例接受了根治性膀胱切除术(radical cystectomy,RC)治疗。继续分析LVI阳性和阴性复发患者接受TURBT和RC治疗对其预后CSS的影响,发现在LVI阴性组中,2种治疗方法的差异无统计学意义(P>0.05);而在LVI阳性组中,接受RC患者的CSS显著高于接受TURBT患者,差异有统计学意义(P<0.05)。(图3)
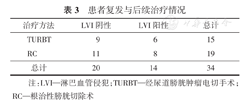
患者复发与后续治疗情况
患者复发与后续治疗情况
| 治疗方法 | LVI阴性 | LVI阳性 | 总计 |
|---|---|---|---|
| TURBT | 9 | 6 | 15 |
| RC | 11 | 8 | 19 |
| 总计 | 20 | 14 | 34 |
注:LVI—淋巴血管侵犯;TURBT—经尿道膀胱肿瘤电切手术;RC—根治性膀胱切除术


LVI—淋巴血管侵犯;RC—根治性膀胱切除术;TURBT—经尿道膀胱肿瘤电切术
LVI对膀胱尿路上皮癌患者预后有重要意义。有研究结果表明,LVI是膀胱癌特异性生存期的1个独立且重要的预后因子[6,11,12,13,14,15]。Cho等[16]对118例膀胱癌患者临床资料进行回顾性分析,发现LVI是T1期膀胱癌中发生、发展和转移的独立预后因子,且与复发显著相关。然而,LVI在T1期膀胱癌伴鳞状分化癌患者中的意义尚不明确。本研究结果表明,LVI在伴有鳞状分化的T1期尿路上皮癌患者中发挥重要作用,是判断其预后的重要指标,也是与CSS相关的独立预后因素。
Spradling等[10]对1 280例行RC的膀胱癌患者进行回顾性分析,结果表明LVI阳性患者预后差,且LVI是独立预后因素。Ukai等[17]对86例行TURBT的高级别pT1期膀胱癌患者进行回顾性分析,结果表明LVI是预后不良的独立因素。此前,对于伴有鳞状分化的T1期尿路上皮癌复发患者,LVI对其治疗方法选择(TURBT或RC)的指导意义缺乏相关生存分析研究的支持。本研究结果表明,在LVI阳性的复发患者中行RC较TURBT有更高的CSS(P<0.05);而对于LVI阴性患者,两种方法的差异无统计学意义(P>0.05)。因此,对于伴有鳞状分化T1期膀胱癌复发的患者,尤其是伴有LVI的患者应尽早行RC。对于pT1期膀胱癌伴有变异的复发患者,欧洲泌尿外科协会最新的指南也推荐尽早行RC[18],与本研究结果一致。
尽管膀胱癌的诊断和手术技术在不断进步,但其长期生存仍未能令人满意。因此,需要更好地识别浅表性膀胱癌中易发生进展的高风险患者,且需要更好的预测指标以指导临床选择恰当的手术方式,从而改善预后,提高患者生存率。近年来,肿瘤的病理分级和TNM分期对预后的意义得到广泛的认可,但其预测预后的作用并不完善。本研究中,单变量分析和多变量分析结果均显示LVI是CSS相关的独立预后因素(HR=3.121, 95%CI=1.969~5.422, P<0.001)。因此,临床上对LVI的早期识别,对评估肿瘤进展甚至转移风险有重要意义,并有助于选择更积极的RC以改善肿瘤的预后。此外,单因素Cox分析结果显示,除LVI外,与CSS相关的预后因素还包括肿瘤多发情况、肿瘤大小和复发;而在多因素Cox分析中,只有肿瘤大小对CSS有显著影响。
LVI是伴有鳞状分化的膀胱尿路上皮癌的重要预后因素。LVI阳性和肿瘤≥3 cm这两种因素会增加患者的死亡风险。在复发的T1期尿路上皮癌伴有鳞状分化的患者中,LVI阳性的患者应尽早行RC手术治疗。
所有作者均声明不存在利益冲突



























