
癫痫是由多种病理因素引起的慢性脑部病变,具有反复性、刻板性、发作性等特点,是儿童常见的神经系统性疾病之一。癫痫发作可引起儿童睡眠结构改变,甚至引起睡眠障碍,而睡眠障碍可诱发发作间期痫样放电及癫痫发作。癫痫患儿睡眠结构异常主要表现为总睡眠时间减少、睡眠潜伏期延长、快速眼动(REM)期潜伏期延长且所占比例减少、睡眠片段断裂及睡眠周期时间缩短等特征。癫痫与睡眠两者关系密切,错综复杂,控制癫痫发作有助于改善患儿的睡眠质量,癫痫患儿的睡眠结构正常化则有助于控制癫痫发作,从而全面改善患儿的生活质量和长远预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
亚里士多德曾说,睡眠与癫痫相似,而且在某种程度上,睡眠就是癫痫。这一言论与现代医学观念有很大不同,但从某种层面上说明了癫痫与睡眠密切相关。诸多研究结果表明,睡眠是癫痫临床发作和异常放电的重要激活因素,癫痫和癫痫综合征以及抗癫痫的治疗手段均可影响睡眠,睡眠又可导致发作间期痫样放电增加,引起癫痫发作。根据睡眠过程中脑电图、眼球运动情况和骨骼肌肌张力的变化,可将睡眠分为非快速眼动(non-rapid eye movement,NREM)期和快速眼动(rapid eye movement,REM)期。NREM期又以脑电图变化为依据进一步划分为N1、N2和N3期,从N1到N3期睡眠是逐渐加深的过程[1]。同时癫痫患者还可合并各种睡眠障碍性疾病。公元2世纪Galen提出应关注癫痫患者的睡眠问题[2],公元4世纪Aristole[3]也提出了睡眠与癫痫的关系。由于儿童的脑部功能随年龄增长而不断完善,脑电活动也不断成熟,且儿童睡眠的病生理状态有别于成人,故充分认识癫痫与睡眠的密切联系有利于优化癫痫患儿的治疗方案,便于长程管理,以期最佳长期预后。本文将从癫痫对睡眠的影响、睡眠对癫痫的影响以及癫痫治疗对睡眠的影响这几方面进行综述。
睡眠是体能复原的重要生理过程,儿童每天约有1/2时间处于睡眠状态,这对儿童生长发育具有重要作用。NREM期是儿童生长激素分泌及记忆巩固的重要时期,而REM期与儿童神经系统发育密切相关。影响癫痫患儿睡眠的因素包括癫痫的发作类型、持续时间、频率以及发作间期的异常放电和抗癫痫治疗手段等。上述因素会调控下丘脑、间脑、脑干及大脑皮质等电活动,刺激这些神经系统结构中的递质分泌及改变激素水平,从而影响癫痫患儿的睡眠。其中松果体分泌褪黑素具有昼夜高低变化规律,因此松果体是控制昼夜规律的生物钟。白天光照刺激通过视网膜传至下丘脑视交叉上核而发出白昼信号后,松果体使合成褪黑素的酶含量减少或活性降低,则褪黑素的合成受到抑制,分泌水平降低;当黑夜降临,其作用正好相反,光线刺激减弱,松果体合成的褪黑素增加,同时酶类活性也增强,促进睡眠发生,尤其对N2期睡眠有较强促进作用。丘脑背内侧核团参与睡眠-觉醒周期的调节,多巴胺、5-羟色胺、谷氨酸和γ氨基丁酸受体均参与清醒及睡眠的调节。另外,某些细胞免疫因子如干扰素α2参与睡眠周期的调节,肿瘤坏死因子2α和白细胞介素26均为促睡眠因子。癫痫发作可导致下丘脑的神经元受损,而下丘脑前端的视前区与睡眠密切相关,视前区损伤可使睡眠明显减少,损害程度越重,损害范围越广,则对睡眠影响越大,甚至可能完全失眠。Bastlund等[4]采用电刺激诱发癫痫发作来考察下丘脑与癫痫的关系,发现随着下丘脑神经元细胞损伤,癫痫大鼠的睡眠结构发生改变,且夜间癫痫发作频率也明显升高,故可认为癫痫发作及睡眠障碍可能均与下丘脑发生病理学改变有关。癫痫发作与睡眠障碍密切关联,相互作用,可导致患儿体格和智能发育障碍,也可引起社会、心理和行为障碍。觉醒期癫痫发作,通常会引起睡眠潜伏期延长,深睡眠及REM期睡眠减少;而睡眠期癫痫发作易导致总睡眠时间缩短,睡眠时相转换次数增多,睡眠期觉醒次数和时间均增多,睡眠效率下降[5]。除了癫痫发作会破坏患儿睡眠结构,发作间期的临床下异常放电同样影响睡眠结构。Del Felice等[6]发现癫痫患儿睡眠结构变化主要表现为睡眠潜伏期延长、REM期比例减少、觉醒时间及次数增多、睡眠时相转换次数增多、总体睡眠效率降低。Unterberger等[7]研究癫痫患儿的睡眠结构也发现了类似异常:局灶性癫痫患儿的总体睡眠时间和N2期睡眠明显缩短,全面性癫痫患儿N3期睡眠显著减少,其总觉醒时间和N1期睡眠较局灶性癫痫患儿增加。目前也有关于癫痫患儿睡眠结构基本正常的报道。
癫痫发作同样影响睡眠结构。Kaleyias等[8]通过对癫痫患儿多导睡眠监测指出,癫痫发作控制越好,睡眠效率越高,觉醒次数和时间越少。Zanzmera等[9]对成人癫痫患者进行多导睡眠监测,结果发现与癫痫发作控制的患者相比,药物难治性癫痫患者的嗜睡比例增加,总睡眠时间减少,睡眠潜伏期和REM期潜伏期均有所延长,且觉醒次数和睡眠时相转换次数增多,睡眠效率降低。侯玉莹和宋毅军[10]研究结果发现,额叶癫痫患者的睡眠结构发生了改变,其特征表现为总卧床时间及入睡后觉醒时间延长,总睡眠期转换次数及N1、N2、清醒期转换次数增加,且总睡眠期转换次数与N1、N2、清醒期转换次数均呈正相关。在De Paolis等[11]的研究中,颞叶癫痫患者睡眠障碍表现为NREM期不能稳定持续,循环交替模式转换率较健康对照组增加了26%,提示睡眠微结构异常,睡眠稳定性下降。
睡眠中癫痫性电持续状态(electrical status epilepticus during sleep,ESES)是一种特殊脑电现象,而不是一个独立的癫痫综合征,约占癫痫患儿的0.5%[12]。感染、外伤、脑发育畸形等均可引发ESES,也可见于多种癫痫综合征。目前公认ESES显性多见于儿童良性癫痫伴中央颞区棘波(benign childhood epilepsy centrotemporal spikes,BECT)变异型、Landau-Kleffner综合征、癫痫伴慢波睡眠期持续棘慢波等。ESES不仅影响睡眠结构,患儿认知行为全面损害也会随着ESES的持续存在而不断加重。ESES患儿的神经心理损伤主要包括言语障碍、认知行为障碍、记忆力差和注意缺陷多动障碍(attention deficit hyperactivity disorder,ADHD)等,其心理损伤的病理生理改变尚无定论,多数学者仍主要把发作间期大量异常放电作为研究切入点,ESES现象的高峰年龄在5~10岁,正值儿童期大脑快速发育,所有神经元具有超强的可塑性,也正是各种神经网络形成的关键期,更易受到异常放电的干扰。放电部位不同则损伤表现也不同,一般认为左侧半球异常放电会造成言语、认知损伤,右侧半球异常放电会造成视感知、时空感知的损伤。持续性癫痫样放电会干扰健康神经元之间的信息正常传递,从而改变健康的突触连接和神经网络。持续大量异常样放电会全面损坏睡眠结构,使其碎片化,导致发育期全面广泛的认知功能障碍,造成不可逆的神经心理功能损伤。另有学者发现,脑电图中高频振荡成分可直接影响ESES患儿的远期预后。ESES患儿的神经心理损伤与ESES持续时间呈正相关,若超过一年半,将成为不可逆性地永久损伤[13]。Bölsterli等[14]研究结果发现,ESES患儿NREM期δ活动由枕区到额区呈现一种由少到多的斜坡样改变,即δ活动频率波幅梯度变化曲线较正常儿童明显降低。该研究结果从一定程度上支持了ESES患儿睡眠中突触递质释放失衡引起患儿神经心理损伤的假说。
癫痫患儿可能共患发育障碍性疾病,如最常见的ADHD患儿也会出现睡眠问题,导致睡眠质量下降。冯宗怀等[15]对62例ADHD患儿的睡眠结构分析发现,ADHD组较健康对照组睡眠潜伏期延长,浅睡期延长,深睡期缩短,觉醒次数增加。冯军坛等[16]研究了58例ADHD患儿的睡眠结构,也得出类似上述睡眠结构改变、睡眠效率降低的结果,同时发现ADHD患儿睡眠期周期性腿动(periodic leg movement during sleep,PLMS)发生率显著升高,而PLMS也可导致ADHD患儿睡眠结构紊乱。长期使用抗癫痫药物(antiepileptic drugs,AEDs)如丙戊酸盐等可能导致体质量增加,从而增加阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)的患病率,同时也可加重已有的睡眠呼吸障碍性疾病。中重度OSA时,对症治疗可使NREM期的异常放电量明显减少,癫痫发作减少50%以上。此外,癫痫相关并发症如焦虑、抑郁、头痛、肥胖等诸多问题,均可能会影响睡眠健康[17]。
睡眠周期对癫痫发作有双向作用,NREM期脑神经元趋于同步化,有助于癫痫样异常放电的广泛传播,而REM期脑神经元去同步化,不利于癫痫样放电传播,且肌张力处于最低状态,鲜有癫痫发作[18]。部分癫痫易发生在即将入睡和初醒状态,其中BECT和婴儿痉挛最具代表性,说明睡眠与觉醒的过渡期是癫痫发作的高峰时段,故改变睡眠-觉醒过渡期的因素会影响癫痫发生。Neiman等[19]证实REM期可干扰和阻断ESES。Ng和Pavlova等[20]于2013年对40余项既往研究进行meta分析,结果表明NREM期局灶性癫痫发作次数是REM期的7.8倍,全面性癫痫发作次数是REM期的3.3倍;N1、N2和N3期癫痫发作的次数分别是REM期发作次数的87、68和51倍,提示REM期减少会增加癫痫发作。
癫痫患者的7类睡眠障碍发病率均高于正常人群,从而影响癫痫疗效及远期预后,故治疗睡眠障碍可使癫痫患者长远获益。癫痫患儿合并睡眠障碍较成人癫痫患者略少。Jain等[21]对上百例大样本癫痫患儿行多导睡眠监测发现,失眠发生率约10%,既有入睡困难,也有反复觉醒致睡眠维持困难,还有两者合并存在的现象。Kanner[22]则发现,46.2%的癫痫患儿存在嗜睡症状,且与睡眠中呼吸障碍及异态睡眠的相关性远大于癫痫的发作类型、频率和抗癫痫治疗方法。
睡眠剥夺使机体长时间处于觉醒状态,常出现的不良反应包括食欲亢进、疲倦、学习记忆能力下降、烦躁、易怒、脑干网状结构上行性激活系统功能下降、脑神经细胞应激性提高、癫痫电活动容易出现并迅速传播[23,24,25]。儿童所需睡眠时间与年龄成反比,年龄越小的癫痫患儿,睡眠剥夺对其神经的影响越大,越容易引起脑电活动暴发和癫痫发作。而对青少年肌阵挛癫痫患者进行睡眠剥夺后,超2/3的患者被观察到发作间期异常放电量显著增多,觉醒的次数和时间增加,易导致癫痫发作。Ferlisi和Shorvon[26]的研究结果显示,全面性癫痫较局灶性癫痫更易被睡眠或睡眠剥夺诱导发作。
癫痫猝死是指突然的、意料之外的、尸检证明非中毒、溺水、外伤所致,伴或不伴目击者、无论是否发生癫痫发作,但必须排除癫痫持续状态导致的死亡。研究结果发现,33%以上的癫痫猝死发生在床上,且与睡眠密切相关。目前癫痫猝死发生的具体机制尚不明确,其中心律紊乱、自主神经功能失调的假说被得到广泛认可,癫痫发作相关的呼吸衰竭以及发作后的大脑皮层广泛电抑制状态可直接导致死亡。另有学者认为癫痫患者在浅睡眠期、微觉醒期以及各个睡眠时相转换期,其自主神经功能变化也可导致呼吸循环衰竭、脑干功能异常即中枢性呼吸异常,从而直接导致癫痫猝死[27]。目前尚未见BECT患者睡眠相关不良呼吸事件的报道。但因癫痫猝死病因未明,难以防范,一旦发生会对癫痫患儿造成致死性打击,故除临床医生应高度重视外,还应积极宣教。
一直以来有关AEDs对癫痫患儿睡眠影响的研究很多,充分证明AEDs可减少癫痫发作,同时也会对癫痫患儿的睡眠造成一定影响,且不同类型的AEDs对睡眠结构的影响亦不同。Kothare和Kaleyias[28]研究结果发现,传统AEDs中的苯二氮卓类及卡马西平可使REM期减少,苯妥英钠可使N1期增加、睡眠效率下降。王松江等[29]指出丙戊酸钠可改善癫痫患儿的睡眠结构,但浅睡眠期时间明显长于正常对照,治疗后体质量增加显著,有可能导致睡眠呼吸障碍。氯硝西泮可改善睡眠状态,但可能诱发或加重呼吸暂停症状。高效、广谱的新型AEDs较传统AEDs不良反应少且轻微,其药理机制广泛作用于γ-氨基丁酸受体、谷氨酸盐受体等配体门控离子通道以及电压门控离子通道,使癫痫患儿的觉醒时间减少,睡眠效率提高,REM期睡眠增多,改善睡眠结构[30]。多数报道证实拉莫三嗪能增加N2期睡眠,REM期睡眠也有增加趋势,觉醒及睡眠时相转换次数减少。在Landau等[31]开展的研究中,健康成人志愿者连续3 d口服剂量为450 mg/d的普瑞巴林,睡眠监测脑电图显示总睡眠时间增多,觉醒次数及睡眠时相转换次数减少,NREM期中深睡眠增多,REM期睡眠比例减少,但其潜伏期并无明显改变。左乙拉西坦可使癫痫患者和健康对照的N2期睡眠增加,同时睡眠效率提高,睡眠质量得以改善,但REM期睡眠减少。Kataria和Vaughn[32]总结了AEDs对癫痫患者睡眠结构的影响,见表1。
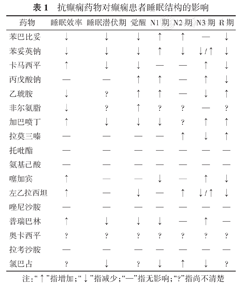
抗癫痫药物对癫痫患者睡眠结构的影响
抗癫痫药物对癫痫患者睡眠结构的影响
| 药物 | 睡眠效率 | 睡眠潜伏期 | 觉醒 | N1期 | N2期 | N3期 | R期 |
|---|---|---|---|---|---|---|---|
| 苯巴比妥 | ↓ | ↓ | ↓ | ↑ | ↑ | — | ↓ |
| 苯妥英钠 | ↓ | ↓ | ↓ | ↑ | ↓ | ↓/↑ | ↓ |
| 卡马西平 | ↑ | ↓ | ↓ | — | — | ↑ | ↓ |
| 丙戊酸钠 | — | — | ↑ | ↑ | — | ↑ | ↓ |
| 乙琥胺 | ↓ | ? | ↑ | ↑ | — | ↓ | ↑ |
| 非尔氨脂 | ↓ | ? | ↑ | ? | ? | — | ? |
| 加巴喷丁 | ↑ | ↓ | ↓ | ↓ | ? | ↑ | ↑ |
| 拉莫三嗪 | — | — | — | — | ↑ | ↓ | ↑ |
| 托吡酯 | — | — | — | — | — | — | — |
| 氨基己酸 | — | — | — | — | — | — | — |
| 噻加宾 | ↑ | — | — | ↓ | — | ↑ | ↓ |
| 左乙拉西坦 | ↑ | — | ↓ | — | ↑ | ↓/↑ | ↓ |
| 唑尼沙胺 | — | — | — | — | — | — | — |
| 普瑞巴林 | ↑ | ↓ | ↓ | ↓ | — | ↑ | — |
| 奥卡西平 | ? | ? | ? | ? | ? | ? | ? |
| 拉考沙胺 | — | — | — | — | — | — | — |
| 氯巴占 | ? | ↓ | ? | ↓ | ↑ | ↓ | ? |
注:"↑"指增加;"↓"指减少;"—"指无影响;"?"指尚不清楚
迷走神经刺激(vagus nerve stimulation,VNS)作为一种癫痫外科治疗手段,主要针对未明确责任病灶的局灶性癫痫,其机制至今未明。主流学说支持迷走神经传入纤维主要的直接终止点位于延髓的孤束核,其联系纤维涉及网状结构、蓝斑核、中缝核等多个脑干神经核团。迷走神经与这些脑干核团的相互调控、复杂连接即为VNS抑制癫痫发作的神经电生理基础[33]。近年来,随着免疫学因素成为癫痫的重要病因,有关迷走神经的免疫调节作用研究在国内外广泛开展,内源性外源性因素刺激免疫活化,可引起下丘脑-垂体-肾上腺轴和肾上腺皮质激素的释放等神经、体液免疫反应,即迷走神经可通过其传入通路起到抗炎作用。Valdés-Cruz等[34]的研究结果表明,低频VNS可增加REM期睡眠。另有研究结果发现,健康志愿者经过6个月的VNS,平均睡眠潜伏期轻度增加,低强度的刺激可提高日间的警觉度。但有研究结果显示,电流小于1.5 mA的VNS会影响睡眠相关的呼吸,增加OSA的次数。目前,VNS对睡眠结构的影响尚无定论,还需进一步研究。
癫痫发作时会出现线粒体能量代谢紊乱并产生大量的氧自由基,有研究认为生酮饮食是通过干扰上述过程来控制癫痫发作;摄入含脂量高的生酮饮食后,体内多不饱和脂肪酸即会升高,而多不饱和脂肪酸具有神经保护功能,故有假设认为不饱和脂肪酸是生酮饮食控制癫痫的有效成分。文献报道,生酮饮食通过影响某些与能量代谢有关的基因的表达来控制癫痫发作[35]。此外,生酮饮食可使睡眠时间减少,但其可提高难治性癫痫患儿的睡眠质量。
癫痫外科手术在难治性癫痫的治疗中起重要作用,这类患者可为研究致痫灶对睡眠调节的影响提供一个理想模型,但目前对癫痫外科手术引起的睡眠结构变化研究甚少。
综上所述,癫痫患儿的临床发作、发作间期放电和AEDs会不同程度造成睡眠结构的改变;ESES这种特殊脑电现象不仅影响睡眠结构,还会造成患儿言语、认知、行为、心理等全面不可逆的损害;另外癫痫共患病中ADHD、OSA、PLMS以及焦虑、抑郁、肥胖等均可能加重对睡眠的影响。同时,睡眠周期对癫痫发作本身具有双向作用,各种睡眠障碍可加重癫痫发作和临床下放电,癫痫猝死中有1/3发生在睡眠状态也从某种意义上提示睡眠因素在癫痫患者致死性病因中的特殊地位。癫痫与睡眠两者关系密切,错综复杂,控制癫痫发作有助于提高患儿的睡眠质量,保证其身心健康发育;改善癫痫患儿的睡眠障碍则可提高癫痫发作的控制率,从而全面提高患儿的生活质量。研究睡眠可为进一步探讨和揭示癫痫相关问题提供线索和依据。
所有作者均声明不存在利益冲突



























