
舒缓型光动力疗法(mPDT)是近年来备受关注的一种新型光动力疗法(PDT),其与传统PDT有着相近的治疗机理,即光敏药物在特定波长光的照射下,与组织氧发生光化学反应,生成具有细胞毒性的活性氧(ROS)物质,从而选择性杀伤快速增殖的肿瘤细胞。与传统PDT不同,mPDT中的光敏药物和光是以长时间、低速率连续传输的方式,通过细胞凋亡来提高肿瘤治疗的特异性。对现有的mPDT体内外效应和机制的研究,以及用于体内研究的光敏药物和光源的研究现状进行详细的综述,以期对现有mPDT技术有一定程度的理解并为其后续研究提供参考,为推进mPDT的临床研究和应用建立基本依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
目前,光动力疗法(photodynamic therapy,PDT)主要以急性光动力疗法(actue PDT,aPDT)和分馏光动力疗法(fractioned PDT,fPDT)为主。aPDT中,光和光敏药物均以大剂量率、短时间连续递送;fPDT中,采取间歇性照光模式,而光和光敏药物的剂量率及总的治疗时间保持不变[1]。近年来,随着PDT研究的深入及临床治疗需求的发展,舒缓型光动力疗法(metronomic PDT,mPDT)应运而生。其中,"metronomic"用以描述连续低剂量化疗,其副作用较小[2]。mPDT方法由Bisland等[2]于2004年首次提出,mPDT与传统PDT有着相近的治疗机理,即利用用特定波长的光激活光敏药物,产生具有细胞毒性的活性氧(reactive oxygen species,ROS)物质,从而选择性地杀伤快速增殖的细胞[3]。与传统PDT治疗不同的是,mPDT中光敏药物和光均以长时间、低速率连续递送,并主要通过细胞凋亡提高对肿瘤的特异性[4]。同时,mPDT避免了对正常组织的伤害,尤其是在恶性脑肿瘤方面,其可选择性杀伤肿瘤组织而对邻近正常组织无伤害,从而避免了脑白质受损[5]。因可选择性杀死肿瘤细胞,而对正常脑组织伤害较小,脑恶性肿瘤的mPDT治疗已成为临床前研究的焦点[2](表1)。

mPDT与aPDT的相关比较研究及部分参数
mPDT与aPDT的相关比较研究及部分参数
| 细胞(模型) | 光敏药物 | mPDT | aPDT | 文献 |
|---|---|---|---|---|
| U87和CNS-1 | ALA 0.25 mmol/L、4 h | 0.21 mW/cm2 (5 J,2、4、6 h) | 21 mW/cm2(5 J,1、2、4 min) | [4] |
| 9L | ALA 1 mmol/L、4 h | 0.116 mW/cm2(10 J,24 h) | 21 mW/cm2(10 J,8 min) | [2] |
| 9L(大鼠) | ALA 100 mg/kg | 0.115 mW/cm2 (10 J/d,1、5 d);0.023 mW(2 J/d,1、5 d) | 3.3 mW/cm2(10 J,50 min);3.3 mW/cm2(2 J/d,10 min/d,5 d) | [2] |
| VX2(兔) | ALA 100 mg/kg | 6 mW(15 J/d,40 min/d,7 d) | — | [2] |
| S1R1(裸小鼠) | ALA 300 mg/kg | 3 mW/cm2(40 J/cm2,3.7 h) | — | [6] |
注:aPDT—急性光动力疗法;mPDT—舒缓型光动力疗法;ALA—氨基酮戊酸。"—"表示无此项
在PDT作用后,细胞的死亡主要通过凋亡和坏死2种途径,而凋亡和坏死所占比例会因PDT的作用方式的不同产生差异。体外研究结果表明,与氨基酮戊酸(aminolevulinic acid,ALA)介导的急性PDT(ALA-aPDT)相比,ALA-mPDT能诱发更高的细胞凋亡率。Bisland等[2]将mPDT用于鼠神经胶质瘤细胞(9L)的研究,其TUNEL染色结果表明,mPDT(0.116 mW/cm2,6 h)诱导的细胞凋亡率为51.3%,而aPDT(21 mW/cm2,8 min)诱导的细胞凋亡率仅为26.8%;同时aPDT诱导后,细胞的坏死率达36.8%,而mPDT诱导的细胞坏死率仅为2.7%。可见,mPDT的细胞杀伤机制以细胞凋亡为主,而aPDT以细胞坏死为主。目前,临床上脑神经胶质瘤的标准治疗是手术后放射治疗或化学治疗,但手术难以切除所有微小瘤巢,导致术后复发率高。而mPDT的肿瘤特异性凋亡相比正常脑组织高出87倍,因此可将mPDT作为肿瘤手术切除后的辅助治疗手段[2,5,7]。多项研究结果显示,ROS能氧化细胞中的生物大分子,如蛋白质、脂肪酸及蛋白质间的桥连结构,破坏生物分子间的结构和功能,改变生物膜渗透性和流动性,激活或抑制膜上的酶蛋白和受体,最终引起细胞的凋亡与坏死。光敏药物和光的剂量对PDT过程非常重要,当ROS量较少时,细胞的损伤较轻,以凋亡为主;当ROS产生量较大时,细胞以坏死为主[8,9]。mPDT治疗过程中,光敏药物和光的剂量率均较低,治疗后细胞死亡的机制主要为凋亡,而非坏死。
PDT诱导的细胞凋亡途径主要包括死亡受体介导的外部通路和线粒体介导的内部通路。在死亡受体途径中,参与的典型基因有凋亡相关因子(factor related apoptosis,Fas)和配体(FAS ligand,Fasl)、Fas相关死亡域蛋白(FAS-associating protein with a novel death domain,Fadd)、caspase-8、肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、TNF-R1和caspase-2等。来自TNF基因家族的细胞表面死亡受体被激活,通过修饰和折叠活化caspase家族中的caspase-8前体开启凋亡程序,如在以酞菁染料(Pc4)为光敏药物的人源表皮状癌A431细胞的PDT实验中,PDT激活Fas,结合配体Fasl并于含有死亡结构域的Fas关联蛋白Fadd形成复合物,该复合物联结caspase-8前体修饰折叠活化caspase-8,进而引起促凋亡蛋白Bid、Bax和Bak活化及细胞色素C释放等一系列反应,开启凋亡程序。线粒体途径中,PDT作用后引起线粒体功能的损坏(被看作是PDT介导的凋亡中的早期症状),导致凋亡因子(如细胞色素C的释放),细胞色素C在胞质中结合凋亡蛋白酶活化因子-1(apoptotic protease activating factor-1,Apaf-1),募集并活化凋亡启动者caspase-8,激活下游的凋亡通路[10]。
Singh等[4]用U87(人)和CNS-1(鼠)脑胶质瘤细胞系研究了与ALA-PDT治疗后引起凋亡相关的分子机制,分别采用高能量激光短时间[aPDT,21 mW/(cm2·s)分别照射1、2、4 min]和低能量激光长时间[mPDT,0.21 mW/(cm2·s)分别照射2、4、6 h]对细胞进行照射,并对ALA-mPDT治疗后的恶性胶质瘤细胞的RNA进行了基因表达的微阵列分析;其结果表明,mPDT处理后18 h,细胞的Bax、caspase-2、TNFRSF12A、TNFRSF6B等基因表达均上调,同时蛋白免疫印迹法检测结果表明ALA-mPDT的凋亡是通过淋巴毒素β受体LTβR的抑制和转录因子NF-κB进行的,这种抑制与ALA浓度相关,即具有光敏药物浓度依赖性。上述结果显示,基于ALA的mPDT是通过TNF受体超家族成员和B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)相关蛋白的表达来诱导细胞凋亡。其中,Bcl-2蛋白家族成员是细胞凋亡通路的主要调节者。Bcl-2蛋白家族是一个特别的家族,目前已发现25种Bcl-2家族同源蛋白,其成员中有些促进凋亡(如Bad、Bid和Bax),而有些阻止细胞凋亡(如Bcl-2、Bcl-x、Bcl-w)。Bcl-2会抑制线粒体释放细胞色素C,从而抑制凋亡;而Bax和Bid则能使线粒体释放细胞色素C,从而促进凋亡[10,11,12]。PDT通过Bcl-2家族成员表达介导的凋亡已经在多种光敏药物条件下及在不同细胞系中得到了证实[13,14,15]。通过对相关基因在细胞凋亡过程中的作用研究,可确定mPDT诱导的细胞凋亡有死亡受体途径的参与[16,17,18,19]。
近年来的研究结果表明,自噬(autophagy或autophagocytosis)作为另一种途径也参与了PDT治疗后的信号通路。细胞自噬又称为Ⅱ型细胞死亡,是细胞在自噬相关基因(autophagyrelated gene,Atg)的调控下利用溶酶体降解自身受损的细胞器和大分子物质的过程。PDT作用后,随着ROS对细胞的杀伤,伴随着凋亡或自噬的发生[20]。目前,已有研究结果表明,aPDT后的细胞自噬主要由自噬相关基因Atg7、Beclin 1和LC3等调控[20,21,22]。此外,自噬和凋亡存在某种程度的相互影响,在小剂量PDT条件下,自噬起到保护细胞的作用,抑制凋亡;当PDT的剂量足够大,引起的凋亡远超过自噬作用时,伴随胞内细胞器的进一步损伤,促凋亡因子的大量释放以及死亡信号级联反应的放大,细胞的破坏程度超过了自噬的保护能力,自噬性程序性细胞死亡被启动,并与凋亡共同促进细胞走向死亡[20,23]。但目前,鲜见mPDT后自噬的相关报道。因此,对于mPDT治疗中有无自噬的出现,自噬又扮演着怎样的角色,其与凋亡之间的相互关系如何,上述问题均是今后需要关注的研究方向。
综上,mPDT诱导细胞凋亡的机制是相对复杂的,对其机制进一步的深入研究十分必要。
体外研究的成果为进一步探索mPDT的治疗机理、效果及临床应用奠定了基础。目前,国内外已针对mPDT治疗脑恶性肿瘤的有效性开展相关临床前动物实验,包括人VX2鳞状细胞癌(兔)[2]、人9L神经胶质瘤(鼠)[7]、鼠CNS1星形细胞瘤(鼠)[24]、人S1R1多形性成胶质细胞瘤(鼠)[6]、鼠LM3乳腺癌(鼠)[25]等模型。但是,相关研究面临着2个重要的技术挑战,包括:①光敏药物的选择和长时间(天~周,取决于肿瘤倍增时间)连续作用的实现,以确保具有肿瘤选择性,避免全身毒性的同时使肿瘤内部有相对较高的光敏药物水平。②如何实现微创条件下长时间、连续地将光传输到整个肿瘤组织。
光敏药物自身具有的物理和化学性质直接决定了其光毒性,是PDT对疾病是否有疗效的关键影响因素。PDT中使用的光敏药物应具备以下3个特点:①对生物体无毒副作用。②容易被患病部位的肿瘤细胞选择性吸收,而又能被正常组织迅速排泄。③光敏化作用力强,三线态的寿命长且产量多[14]。
目前,广泛使用的光敏药物分为第1代光敏药物和第2代光敏药物。其中,第1代光敏药物的代表为血卟啉制剂(haematoporphyrin derivative, HPD),第2代光敏药物主要包括血卟啉单甲醚(hematoporphyrin monomethyl ether,HMME)、苯并卟啉衍生物单酸环A、单天门冬酰基二氢卟酚e6(monoaspartyl chlorin e6,MACE)、间-四羟基氯苯酚(m-tetrahydroxyphenylchlorin,mTHPC)、初红紫素锡络合物(tin ethyl etiopurpurin,SnET2)、金属酞菁类(铝酞菁和锌酞菁)、光卟啉(Photofrin)等。其中,Photofrin®及Photofrin II®光敏药物产品(加拿大Axcan Pharma公司)已通过美国食品药品监督管理局认证。虽然,上述光敏药物在肿瘤的临床诊断和治疗方面都取得了肯定的疗效,但仍有很多不足。
血卟啉衍生物介导的恶性脑肿瘤PDT二期临床试验结果表明,如在多形性胶质母细胞瘤(glioblastoma multiforme,GBM)彻底切除术后行腔内光动力治疗,可有效提高患者生存率,相关的三期临床试验正在进行中[26,27,28]。然而,已有临床证据表明血卟啉衍生物对正常脑组织有损害[26]。在对兔和鼠原位脑肿瘤的临床前研究中发现,光卟啉介导的PDT可通过出血性坏死摧毁大量颅内肿瘤[29],但即使光敏药物摄取剂量非常低,正常脑组织也会对光卟啉介导的PDT异常敏感[5,26]。这可能是由于血管内皮受损,血脑屏障的完整性遭到破坏导致的,而SnET2和mTHPC等光敏药物也有类似情况。
5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)是近年来开发的第2代光敏药物,其是动物血红素和植物叶绿素生物合成的前体物质,属于生物体的内源性物质。正常情况下,机体通过细胞内血红素的含量反馈抑制ALA合成酶,控制ALA的生成量,因此体内没有过量的ALA蓄积,但当外源性ALA进入体内后,能被肿瘤细胞和其他恶性细胞选择性地吸收,使原卟啉IX(Protoporphyrin IX,PpIX)聚集,并在一定波长的光照下产生治疗作用。作为光敏药物,ALA应用范围广泛,可用于痤疮、光化性角化病、各种皮肤病、膀胱癌、尖锐湿疣、上消化道癌、直肠癌、乳腺癌、鲜红斑痣、老年性黄斑病变、类风湿性关节炎等疾病的PDT治疗,其中对基底细胞癌的治愈率达91%,对痤疮的治愈率超过95%,对恶性神经胶质瘤的治疗也取得了令人满意的效果[30]。
5-ALA摄入后,内源性代谢产生的PpIX对正常脑组织的伤害相对于其他光敏药物明显较小,其坏死阈值至少比其他光敏药物高一个数量级[31,32],可选择性摧毁肿瘤组织,而不引起正常组织坏死。但后续研究结果表明,光卟啉或ALA介导的aPDT不仅会诱导颅内肿瘤细胞凋亡,也会引发正常脑组织的凋亡,但此效应具有随机性,并不是简单的阈值效应[32]。即使光敏药物浓度低于损伤阈值,光卟啉介导的PDT也可在肿瘤组织和正常脑组织中促发凋亡[26]。而阈下低剂量率ALA-PDT,即ALA-mPDT可诱导颅内肿瘤细胞的选择性凋亡,对正常组织伤害较小(包括凋亡和坏死)。当通过皮下蠕动泵对小鼠给药7 d(ALA,10 μmol/kg),发现此种给药方式不损害小鼠的正常运动协调,而aPDT则会有显著的卟啉症状[33,34]。与之相似,当对小鼠以200 mg/kg进行ALA口腔给药时,不影响其正常的肝脏和肾功能[35]。但存在一个明显的问题,即临床应用时,患者长期摄入ALA会导致血清中ALA水平的升高[34,36]。因此,药物毒性是mPDT的一个潜在问题。有研究通过原位移植分别建立了兔VX2脑肿瘤和鼠9L神经胶质瘤模型[2,26,31],并使用ALA(10 mg/mL)以腹腔注射或口服给药,以验证药物毒性并确定合适的摄取剂量;其结果表明,单次口服组和持续5 d口服组所消耗的光敏药物分别为(25±12)、(25±14)ml/d,与对照组相比,小鼠体质量和健康状态并没有明显差异。以上结果表明,光敏药物ALA暗毒性较低,且100 mg/(kg·d)对脑胶质瘤(9L)小鼠是一个安全的摄取剂量。此外,通过测定组织中的PpIX浓度,发现ALA在肿瘤组织中选择性地聚集,浓度较正常组织高3.8倍,且口服摄取更有利于肿瘤组织对光敏药物的吸收(口服组的荧光强度为腹腔注射组的1.7倍)。PpIX在肿瘤组织内的聚集水平受肿瘤模型、移植技术和量化分析等因素的影响[35]。同时,有研究结果表明,ALA的小剂量长时间吸收对患者来说是安全的,不会引起任何卟啉症状[34],这使得ALA-mPDT可能作为肿瘤切除后的辅助治疗方法,以便对具有高复发率的肉眼可见或微肿瘤进行进一步杀伤。
研究结果表明,将mPDT用于兔VX2脑肿瘤手术切除后的辅助治疗,其与单纯手术相比,手术合并mPDT虽未明显改善存活时间[(17.0 d±1.4 d)vs (17.7 d±2.2 d)],但病理结果表明,手术合并mPDT能明显抑制手术切除后的肿瘤复发,同时提高了肿瘤细胞的选择性凋亡[7]。进一步说明,mPDT介导的肿瘤治疗主要是通过细胞凋亡而达到肿瘤治疗的目的。
综上,虽然5-ALA已成为近年来备受青睐的光敏药物,但其同时也面临着一些难题。ALA是PpIX的前体物质,在细胞血红素的合成过程中转换为PpIX,而PpIX本身属于内源性光敏药物,优先在肿瘤细胞内聚集[37,38,39]。在皮肤病学的研究中,ALA是亲水性分子,被动扩散通过角质层,在细胞内代谢成PpIX[40]。但是,该扩散过程降低了肿瘤组织中的ALA水平,从而影响了PDT对较大和深部肿瘤(如结节性基地细胞癌)的治疗效果[41,42]。为了提高ALA-PDT治疗较大或深部肿瘤的有效性,De Souza等[1]使用金属螯合剂、乙二胺四乙酸铁铵(ethylenediaminetetraacetic acid desferrioxamine,DFO)和1,2-二乙基-3-羟基吡啶-4-氢氯化物(1,2-diethyl-3-hydroxypyridin-4-one hydrochloride,CP94)作为亚铁螯合酶活性抑制剂,防止PpIX转换成血红素,以此增加PpIX在肿瘤内的含量。在其实验中,分别用0.05、0.10和0.20 mmol/L的ALA在有无DFO的条件下于SCC9、SCC15、SCC25、A431和FaDu细胞中孵育;结果表明,在SCC9、SCC15、SCC25和A431细胞中加入DFO能明显提高细胞内PpIX的水平。此外,应用CP94也有类似结果。该研究结果表明,通过加入亚铁螯合酶活性抑制剂提高细胞内PpIX水平的方法是可行的。
为进一步改善ALA的摄取方式和治疗效应,Casas等[43]研究了ALA的共轭合成物18m-ALA,并使用全身给药的小鼠肿瘤模型以增强体内外卟啉的合成。其结果表明,在体外、低浓度条件下,18m-ALA比ALA更有利于卟啉的合成,且具有浓度依赖性;在体内多种组织中,ALA在摄入早期3~4 h出现尖峰,而在24 h内均会持续产生卟啉,并在摄入48 h后到达基底值。由此可见,ALA的共轭复合物有望成为ALA-PDT中因光敏药物损失而导致治疗效果不佳的解决方案。
在体内mPDT中,光敏药物和光均以低剂量率、长时间连续传输,因此对光源提出了特殊需求,即能长时间稳定出光,且体积足够小,以便小动物耐受[2,25]。目前,用于体内mPDT的光源大致可分2类:即基于传统激光的低功率光源和基于发光二极管(light emitting diode,LED)的新型光源。
Bisland等[2]使用9L神经胶质瘤大鼠模型,研究ALA-mPDT对脑肿瘤的作用,其采用的低功率激光光源由激光器(10 mW、635 nm±5 nm)、耦合光纤、旋转装置和大鼠背包组成(调节光源输出的电池和电位器安装在背包内)。激光通过光纤耦合到大鼠颅内实施照射。该装置虽在一定程度上实现了长时间连续照光的需求,但仍存在一些技术挑战。首先,虽然使用凯夫拉纤维涂层外管对光纤进行了保护,但大鼠仍可咬到并损坏光纤;其次,尽管旋转装置允许电源线和光纤实现360°无扭曲旋转,但在接触皮肤的入口处,光纤的移动仍无法完全避免,增加了机械损伤的可能性。对于长时间治疗,这些问题均为普遍存在。
Davies和Wilson[25]使用LED用于肿瘤大鼠模型的mPDT,其LED光源主要由LED、光纤、电池、电位器和电路接口构成。Bisland等[2]将LED(635 nm,发散角8°)通过一个连接器耦合到直径为200 μm的光纤实现照射(图1)。Kim[44]将LED和接口电路固定在大鼠颅骨皮下,用于mPDT照射,该装置可实现大于24 h的稳定输出,装置质量约为小鼠体质量的10%;如使用质量轻、高能量的电池供电,该装置可实现>10 d的稳定输出,且动物耐受性高,无并发症发生。相比于耦合光纤,该方法很大程度上降低了大鼠机械损伤的可能性。综上,在脑肿瘤切除后采用直接植入光源的方式进行mPDT辅助治疗难度较大(切除部位尺寸小),而采用植入LED微阵列的方法是可行的。因此,为了实现最佳的mPDT效应,如50 J/d的mPDT可诱发肿瘤和周边区域大量的细胞凋亡,最有效的方法就是将LED光源固定于颅骨并使光经硬脑膜传输至病灶[2,6,7,24]。虽然这种方法提高了动物对光源的耐受性,但其只适合浅表肿瘤mPDT的需求,并未考虑到腔隙肿瘤中光的传输。


为解决上述问题,Davies和Wilson[25]在结合腔隙光纤传输和集成光源的基础上对已有的激光光源重新设计,研发了用于荷瘤兔模型实验的激光二极管单元,如图2所示。该装置使用低功率激光二极管(4 mW,635 nm±5 nm)为光源,辐射阈值电压为3.3 V,初始电流为21 mA,可实现不低于5 d的稳定(±1 mA)输出;激光二极管安装到铝合金中空圆柱中(直径1.2 cm,长3.5 cm);激光二极管耦合到多模态折射率玻璃光纤(内径100 μm,外径140 μm),并通过在其近端形成一个完整的光纤透镜,以最大程度的捕获光源。相比于传统激光的低功率光源,该装置耦合效率增加,散热效果更好,且质量更轻。


此外,Davies和Wilson[25]在原有基于LED光源的基础上,进一步改进与优化,分别研发出具有高发光效率的单模态和多模态LED阵列光源,与二极管激光器不同,该装置不需要复杂的驱动电路,从而进一步减轻了质量,且允许的输入电压范围更宽,使LED的输出功率变化更小(图3)。为了更好地满足小动物实验的需求,Guo等[6]研发了用于mPDT的微型有机LED(organic light emitting diode,OLED)光源,该光源的OLED的面板尺寸为15 mm×15 mm,发光区域直径为7 mm,整个光源设备的质量<5 g(图4)。与LED相比,OLED具有可变形、质量轻、功效高、结构紧凑等优点[44,45],这使得其更适合用于小动物mPDT治疗的光源。


OLED—有机光电二极管
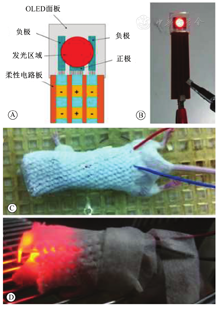

目前,用于mPDT的体内光源仍在进一步的研究和优化中,体积更小、质量更轻、更稳定、动物耐受性更高的光源将成为mPDT光源研究的主要方向。
目前,对mPDT的研究主要集中在体内实验中,包括光敏药物和光源的选择,以及照射剂量的优化,而对于mPDT作用后细胞凋亡和坏死效应及相关机制的研究较为缺乏。由此可见,在今后的研究中开展大量体外或体内实验,探究mPDT在肿瘤消融中的效应机制是mPDT发展的必要,以便进一步推进其临床应用。同时,已有大量的研究结果表明,PDT可诱导自噬发生,但不同细胞类型及照射剂量使自噬在PDT中起的作用截然不同[46]。作为一种连续、低剂量率的新型PDT疗法,mPDT过程中是否有自噬的参与,自噬、凋亡和坏死间存在怎样的关系,均为今后研究中亟待解决的问题。
综上所述,虽然mPDT还没有在临床上得到应用和推广,但基于相关体内外研究的基础(表1),尤其是mPDT在治疗恶性脑神经胶质瘤中的明显优势,以及光敏药物和照射光源的不断发展,mPDT面临的技术问题将不断加以解决,从而推动mPDT进一步发展与临床应用。
所有作者均声明不存在利益冲突



























