
比较拜欧金、骨立方和Bio-Oss 3种骨移植材料联合引导组织再生术(GTR)治疗牙周骨下袋缺损的临床效果。
选取18例具有骨下袋缺损的慢性牙周炎患者,随机分为拜欧金组、骨立方组和Bio-Oss组。所有患者在牙周基础治疗后行牙周植骨术联合GTR手术。于术前、拆线(术后2周)、术后6个月时采集患者临床和影像学资料,包括牙周探诊深度(PD)、临床附着丧失(CAL)、牙龈退缩(GR)和剩余牙槽骨高度(RBH)。
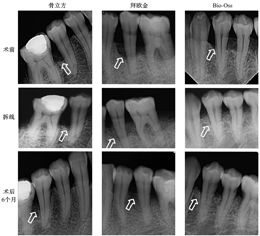
所有患者在拆线时,伤口均愈合良好,达到I期愈合,无感染及伤口裂开现象,术后不适感均可接受。牙周植骨联合GTR术后6个月,3组的PD和CAL指标较术前均有显著改善(均P<0.05),且3组间PD和CAL的差异无统计学意义(均P>0.05)。影像学检查结果表明,术后6个月,3组均可见原骨缺损区有新骨形成,骨密度与周围骨组织近似,RBH%均较术前显著增加(均P<0.05),且3组间RBH%的差异无统计学意义(均P>0.05)。
拜欧金、骨立方和Bio-Oss均为可靠的牙周炎所致牙槽骨缺损治疗骨移植材料,均能显著改善成骨效果。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
牙周炎是一种十分常见的口腔疾病,是成年人失牙的主要原因,严重影响人类的口腔健康及生活质量[1]。牙周炎是一种由菌斑引起的牙周支持组织的慢性感染性疾病,其会对牙周组织造成难以逆转的损伤,还会导致牙槽骨丧失,从而致使牙齿松动甚至脱落。以保存天然牙为目标,使破坏的牙周组织再生,一直是牙周领域内的研究热点。骨移植联合引导组织再生术(guided tissue regeneration,GTR)被证实是牙周骨下缺损治疗的最佳方案,而临床上常用的骨移植材料主要有同种异体骨、异种骨及人工合成骨移植材料。
Bio-Oss®是牛异种移植骨材料,其临床应用最为广泛。Bio-Oss的羟基磷灰石含量与人骨相似,可使移植骨快速血管化并被新的人骨取代[2]。有研究结果表明,异种移植物用于牙周骨下缺损治疗时,能获得新的牙周附着和牙骨质形成[3]。且在术后6个月~3年内,植骨区仍有20%~40%骨粉残留,这种缓慢的替代速率有利于长期维持修复[4]。目前,国内外在GTR联合植骨术中所采用的骨粉和骨膜以Bio-Oss和Bio-Gide为主,能获得可靠的临床效果。当通过屏障膜结合Bio-Oss治疗人牙周骨下袋缺损时,能获得1.0~5.5 mm的临床附着水平[5]。也有研究者通过Meta分析,比较在牙周骨缺损中使用Bio-Oss与自体骨的效果;其结果表明Bio-Oss能获得更多的骨增量[6]。
拜欧金®(Bio-Gene)是一种脱细胞异体骨修复材料,保持了天然骨组织孔隙结构,具有良好的骨传导性,并可释放骨形成蛋白(bone morphogenetic proteins,BMPs)诱导成骨。骨立方®(Bone3)利用仿生原理,通过模拟人体自然生理环境,其通过Ⅰ型胶原与羟基磷灰石的自组装形成的仿生骨与天然骨成分近似。目前,仅少量研究结果证实了拜欧金在动物及人体内的骨诱导活性[7,8]。但两种骨填充材料均无用于牙周组织再生的相关研究报道。
拜欧金和骨立方作为国产材料,具有一定的价格优势。因此,如国产骨移植材料能在牙周再生领域成功应用,不仅能使医师及患者在牙周植骨材料方面有更多的选择,也能使更多因为经济因素放弃GTR手术的患者保存更多的天然牙。本研究中,对拜欧金、骨立方和Bio-Oss在牙周骨下袋缺损再生治疗中的临床效果进行比较。
选取天津市口腔医院牙周病科就诊的18例确诊为中度或重度慢性牙周炎患者,年龄范围18~55岁,年龄(39.8±8.7)岁。入组筛选前,患者均经过牙周基础治疗,包括口腔卫生宣教、全口超声龈上洁治、龈下刮治和根面平整。牙周基础治疗6周后,进行牙周评估,评估其是否可以进行牙周手术。
纳入标准:全身系统健康;3个月内未服用过抗生素、皮质激素类、非甾体类抗炎药或双磷酸盐类药物;牙周基础治疗6周后,至少有1颗无症状牙,其探诊深度(probing depth,PD)≥5 mm且临床附着丧失(clinical attachment loss,CAL)≥3 mm;X线片显示其骨吸收深度,垂直≥3 mm且成角为30°~60°;至少存在2壁骨袋;患者余留牙超过20颗;全口菌斑指数(FMPS)和全口出血指数(FMBS)为20%。每例患者选取一颗牙参与试验。
排除标准:存在1种或多种全身性疾病;服用药物的患者;怀孕或哺乳期患者;吸烟者;患牙松动度大于Ⅱ度;有1壁骨袋有Ⅱ~Ⅲ度的根分叉病变;术区存在未控制的急性感染、根尖周病、根折和形态严重不规则的畸形牙根、牙周牙髓联合病变、不良修复体。
将18例入组患者随机分为拜欧金组(n=5)、骨立方组(n=5)和Bio-Oss组(n=8),分别使用拜欧金、骨立方和Bio-Oss进行牙周骨下袋缺损再生性手术,在植骨后覆盖Bio-Gide胶原膜。
采集所有患者术前和术后6个月的临床资料,包括:PD、CAL、牙龈退缩(gingival recession,GR)。由一名对干预措施不知情的研究人员进行术前和术后的临床检查。
于术前和术后6个月,对患者的患牙进行数字化根尖片检查。利用根尖片分析软件测量牙位的剩余牙槽骨高度(residual alveolar bone height,RBH%),即近中(或远中)牙槽嵴顶到根尖点的距离占牙根长度的比值(图1)。
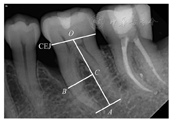

CEJ—釉牙骨质界;B点—骨缺损底;O点—釉牙骨质界中点;A点—根尖或根尖中点;C点—B向线的投影点


式中:R0为牙根长度,是釉牙骨质界连线中点(O)至根尖点(A)的距离AO,C点为牙根表面牙槽骨嵴最低点(B)向线的投影。RBH的测量与计算由一名对干预措施不知情的研究人员进行。
局部麻醉后,术区采用颊舌侧沟内切口,翻开黏骨膜瓣。超声波清除根面残余牙石;采用Gracey手动刮治器刮除骨缺损区域的炎症肉芽组织。高速球钻修整扶壁骨,在缺损区域植入相应的骨移植材料,并覆盖Bio-Gide胶原膜。用3-0不可吸收的强生尼龙缝线间断缝合。术后用西比氯胺含漱,每天2次,持续2周。术后2周后拆线,并观察伤口愈合情况。(图2)

采用SPSS 22.0统计学软件处理数据。符合正态分布的计量资料采用均值±标准差(Mean±SD)表示。各组内不同时间点的临床和影像学指标差异比较采用配对t检验,组间比较采用方差分析,组间差异比较采用成组t检验。以P<0.05为差异有统计学意义。
各组患牙的牙槽骨缺损临床资料比较见表1。术前欧金组、骨立方组和Bio-Oss组的组间PD、CAL和RBH值的差异均无统计学意义(均P>0.05)。所有患者在术后无任何感染和其他不良并发症出现,伤口均达到Ⅰ期愈合,术后不适感可接受。
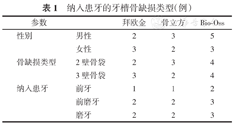
纳入患牙的牙槽骨缺损类型(例)
纳入患牙的牙槽骨缺损类型(例)
| 参数 | 拜欧金 | 骨立方 | Bio-Oss | |
|---|---|---|---|---|
| 性别 | 男性 | 2 | 3 | 5 |
| 女性 | 3 | 2 | 3 | |
| 骨缺损类型 | 2壁骨袋 | 2 | 3 | 4 |
| 3壁骨袋 | 3 | 2 | 4 | |
| 纳入患牙 | 前牙 | 1 | 1 | 2 |
| 前磨牙 | 2 | 2 | 3 | |
| 磨牙 | 2 | 2 | 3 |
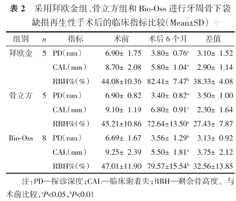
术后6个月,3组的临床和影像学指标较术前均得到明显的改善(均P<0.05)(表2、图2)。在组间比较中,3组的PD降低(ΔPD)、CAL改善(ΔCAL)、RBH改善(ΔRBH)的差异均无统计学意义(均P>0.05),如图3所示。术后6个月,影像学检查结果表明,3个组别中均可见原骨缺损区有新骨形成,且骨密度与周围骨组织近似(图4)。
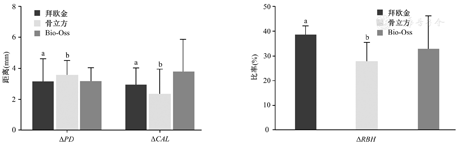

ΔPD—探诊深度改善;ΔCAL—临床附着失改善;ΔRBH—剩余骨高度改善。与骨立方组比较、与Bio-Oss组比较,aP>0.05;与拜欧金组比较、与Bio-Oss组比较,bP>0.05

采用拜欧金组、骨立方组和Bio-Oss进行牙周骨下袋缺损再生性手术后的临床指标比较(Mean±SD)
采用拜欧金组、骨立方组和Bio-Oss进行牙周骨下袋缺损再生性手术后的临床指标比较(Mean±SD)
| 组别 | n | 指标 | 术前 | 术后6个月 | 差值 |
|---|---|---|---|---|---|
| 拜欧金 | 5 | PD(mm) | 6.90± 1.75 | 3.80± 0.76a | 3.10± 1.52 |
| CAL(mm) | 8.70± 2.08 | 5.80± 1.04a | 2.90± 1.14 | ||
| RBH%(%) | 44.08±10.36 | 82.41± 7.47b | 38.33± 4.08 | ||
| 骨立方 | 5 | PD(mm) | 6.90± 0.82 | 3.40± 0.82a | 3.50± 1.00 |
| CAL(mm) | 9.10± 1.19 | 6.80± 0.91a | 2.30± 1.64 | ||
| RBH%(%) | 45.21±10.86 | 72.64±13.50a | 27.43± 7.87 | ||
| Bio-Oss | 8 | PD(mm) | 6.69± 1.67 | 3.56± 1.29b | 3.13± 0.92 |
| CAL(mm) | 9.25± 2.39 | 5.50± 1.81a | 3.75± 2.12 | ||
| RBH%(%) | 47.01±11.90 | 79.57±15.54b | 32.56±13.85 |
注:PD—探诊深度;CAL—临床附着失;RBH—剩余骨高度。与术前比较,aP<0.05,bP<0.01
牙周组织再生的定义是修复或重建因炎症造成的受损牙周组织,以恢复牙周结构和功能。应用牙周再生技术,有利于改善具有深牙周袋和牙槽骨缺损的牙周病患牙的短期和长期临床预后[5]。有研究结果表明,牙周治疗后持续存在的深牙周袋显著增加了患牙后期脱落的风险[9]。深牙周袋多与垂直型牙槽骨吸收相关。有研究结果表明,骨移植联合GTR是治疗这类骨缺损并获得牙周再生的有效治疗方式[10]。
目前,用于牙周组织再生的骨移植材料有多种,其临床选择主要考虑材料的骨生成性、骨诱导性和骨引导性。自体骨移植被认为是骨移植材料的金标准,但其受到取材有限、产生第二伤口等因素制约。目前,临床上应用最为广泛的是异种骨和异体骨移植。其中,Bio-Oss在牙周组织再生及骨再生手术中使用最为广泛,并被证明具有良好的生物相容性和骨诱导性[11]。与既往的研究结果相似,本研究中使用Bio-Oss联合GTR获得了(3.75± 2.12)mm的临床附着增加(ΔCAL)。
骨立方是我国自主研发的含Ⅰ型胶原与羟基磷灰石的人工合成骨,具有良好的生物相容性、安全性及骨再生效果。本研究中,骨立方联合GTR获得(2.3 ± 1.64)mm的临床附着增加(ΔCAL)。虽然,骨立方组术后拆线时根尖片检查显影欠佳,但随着新骨形成,显影问题逐渐得到改善(图4)。
同种异体骨最大的优势是含有骨形成蛋白成分,能促进间充质干细胞迁移、黏附和成骨向分化。与自体骨相比,异体骨因缺少活细胞,而具有较强的骨传导作用,且解决了自体骨取材有限、第二伤口等限制[12],但其骨诱导作用较弱。同种异体骨通过酒精脱脂、盐酸脱矿、冻干辐照等方法制备而成。拜欧金即是以此方法制备的一类脱钙冻干骨。有研究结果表明,Bio-Oss和脱钙冻干骨的新骨形成量接近,但略低于自体骨[13]。本研究中使用拜欧金联合GTR获得了(2.90± 1.14)mm的临床附着增加(ΔCAL),该结果与使用脱钙冻干骨植入牙周骨下袋缺损的研究结果近似[(2.61 ± 0.68)mm][14]。
本研究中,比较了不同来源骨移植材料拜欧金(同种异体骨)、骨立方(羟基磷灰石复合胶原)和Bio-Oss(牛松质骨)在联合GTR治疗牙周骨下袋缺损的临床效果。研究结果表明,作为国产材料,拜欧金和骨立方与Bio-Oss在治疗牙周炎造成的骨下袋缺损时均可获得成骨效果,并改善牙周临床指标。拜欧金、骨立方与Bio-Oss均是可靠的骨移植材料。
所有作者均声明不存在利益冲突



























