
探讨血液样本中胞裂蛋白9(SEPT9)、干扰素调节因子4(IRF4)、支链氨基酸转氨酶1(BCAT1)和Ikaros家族锌指蛋白1(IKZF1)基因甲基化单独检测和联合检测对结直肠癌临床诊断的价值。
选取2015年2月至2018年5月于天津医科大学附属肿瘤医院结直肠肿瘤科接受手术治疗的105例结直肠癌患者作为病例组,同时选取年龄范围和性别比例与病例组相近的105例健康体检者作为对照组。采集各研究对象的血液样本及临床资料,采用甲基化特异性PCR检测血液中SEPT9、IRF4、BCAT1和IKZF1基因的甲基化状态,分析单基因和联合基因甲基化水平与结直肠癌临床病理特征的相关性。
病例组血液中SEPT9、IRF4、BCAT1和IKZF1单基因甲基化阳性率分别为67%(70/105)、44%(46/105)、45%(47/105)和46%(48/105),均高于对照组(均为0),差异均具有统计学意义(均P<0.001)。病例组血液中上述4种基因甲基化联合检测的阳性率为76%,高于单基因甲基化阳性率。血液中SEPT9、IRF4、BCAT1、IKZF1单基因甲基化及4种基因联合甲基化状态均与结直肠癌患者的肿瘤临床分期、肿瘤最大径、无进展生存期(PFS)和总生存期相关(均P<0.05)。
血液中SEPT9、IRF4、BCAT1和IKZF1基因甲基化联合检测较单基因甲基化检测可明显提高结直肠癌检测的阳性率,为结直肠癌的早期诊断提供理论依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌是全球癌症相关发病和死亡的主要原因之一,其发病率在男性和女性常见癌症中分别居第3位和第2位[1,2]。由于结直肠癌早期症状不明显,导致多数患者确诊时已处于晚期。采取有效的早期筛查措施可在早期发现结直肠癌,从而进行早期干预,提高患者的生存率。目前临床上主要采用结肠镜检查和粪便潜血试验进行结直肠癌筛查[3,4],但这两种常规方法在实用性和灵敏度方面仍有缺陷:结肠镜检查可能带来一系列的并发症,如肠活检部位出血、肠穿孔和感染等[5,6];而粪便潜血试验易受饮食、药物和其他因素的影响[3,4]。因此,亟需开发一种简便、灵敏度及特异性高的结直肠癌筛查方法,在提高其筛查率的同时减轻患者痛苦。
遗传和表观遗传的改变可能导致癌症的发生,这些异常改变的积累可通过激活肿瘤癌基因或灭活肿瘤抑癌基因促进癌症的发生和发展[7]。甲基化是基因表观修饰方式之一,在维持正常细胞功能、遗传印记、胚胎发育中发挥着重要作用[8]。研究结果表明,基因异常甲基化与癌症的发生相关,可作为分子标志物进行癌症早期筛查[9]。近年来,基因甲基化检测被广泛应用于癌症的早期诊断中。例如,胞裂蛋白9(sepint 9, SEPT9)基因甲基化已被美国食品药品监督管理局批准为结直肠癌筛查的标志物[10,11]。由于癌症患者外周血中存在较高水平的循环游离DNA(circulating free DNA, cfDNA),因此提取血液中的cfDNA检测基因甲基化水平为结直肠癌的早期筛查提供了新的可能。鉴于SEPT9、干扰素调节因子4(interferon regulatory factor 4, IRF4)、支链氨基酸转氨酶1(branched-chain amino acid transaminase 1, BCAT1)以及Ikaros家族锌指蛋白1(Ikaros family zinc finger 1, IKZF1)与结直肠癌的发生密切相关,故本研究提取结直肠癌患者血液中的cfDNA,检测其中SEPT9、IRF4、BCAT1和IKZF1基因的甲基化水平,并分析其与临床病理指标的相关性,以期揭示基因甲基化检测在结直肠癌早期诊断中的价值。
选取2015年2月至2018年5月于天津医科大学附属肿瘤医院结直肠肿瘤科接受手术治疗的105例结直肠癌患者作为病例组,其中女性51例,男性50例,未记录性别4例,年龄范围20~76岁。同时选取年龄范围和性别比例与病例组相近的105例健康体检者作为对照组,另选取90例结直肠癌患者作为验证组。结直肠癌患者纳入标准:无家族性大肠息肉病史;经影像学及病理检查确诊为结直肠癌。健康体检者纳入标准:肠镜下除痔疮外,无其他异常者。本研究符合2013年修订的《赫尔辛基宣言》的要求,所有研究对象均签署知情同意书。
血清/血浆核酸纯化试剂盒QIAamp Circulating Nucleic Acid Kit(德国Qiagen公司),血液/细胞/组织基因组DNA提取试剂盒TIANamp Genomic DNA Kit [天根生化科技(北京)有限公司],DNA甲基化试剂盒EZ DNA Methylation-Gold Kit(美国Zymo Research公司)。
VS-TP24快速组织细胞破碎仪(无锡沃信仪器制造有限公司),T100 PCR仪(美国Bio-Rad公司),LX-200迷你离心机、QL-901旋涡混合器(海门市其林贝尔仪器制造有限公司),5424R台式低温离心机(德国Eppendorf公司),DYCP-32B电泳仪(北京六一生物科技有限公司)。
使用乙二胺四乙酸二钠抗凝真空采血管收集病例组和对照组受试者的外周血样本,3 000× g离心5 min,得到血浆样本。每份样本取4~5 ml,严格按照QIAamp Circulating Nucleic Acid Kit试剂盒说明书提取cfDNA,存于-80 ℃备用。
收集验证组患者手术切除的癌组织(90例)和癌旁组织(90例),使用快速组织细胞破碎仪将其打碎处理为细胞悬液,1 500 r/min离心3 min(离心半径8.4 cm)后去上清;加入200 μl缓冲液GA,振荡至彻底悬浮;按照TIANamp Genomic DNA Kit试剂盒说明书提取DNA,存于-20 ℃备用。
严格按照EZ DNA Methylation-Gold Kit试剂盒说明书对提取的DNA进行亚硫酸氢盐修饰;分别设计SEPT9、IRF4、BCAT1和IKZF1基因的引物和探针(表1),扩增目的片段。PCR反应体系为:Taq酶0.2 μl,缓冲液5 μl,脱氧核糖核苷三磷酸4 μl,正向引物2.5 μl,反向引物2.5 μl,探针0.5 μl,DNA模板5 μl,加无核酸酶水至总体积50 μl。PCR反应条件为:95 ℃预变性10 min;95 ℃ 15 s,58 ℃ 30 s,共45个循环。将PCR产物进行琼脂糖凝胶电泳检测,判断甲基化状态。

甲基化特异性PCR相关基因的引物序列和探针
甲基化特异性PCR相关基因的引物序列和探针
| 基因名称 | 引物(5′→3′) | 探针 |
|---|---|---|
| SEPT9 | 正向引物:AAATAATCCCATCCAACTA | VIC-TTAACCGCGAAATCCGAC-MGB |
| 反向引物:GATTCGTTGTTTATTAGTTATTATGT | ||
| IRF4 | 正向引物:CGCCTACCCTCCGCG | FAM-TTGTGGCGATTTCGTCGT-MGB |
| 反向引物:TGGGTGTTTTGGACGGTTTC | ||
| BCAT1 | 正向引物:TTTGTTGATGTAATTCGTTAGGTCG | FAM-CGACCCTCTCGCGACGAAAACTCGCG-MGB |
| 反向引物:CAATACCCGAAACGACGACG | ||
| IKZF1 | 正向引物:CGACGTATTTTTTTCGTGTTTCGTT | FAM-CGACCCTCTCGCGACGAAAACTCGCG-MGB |
| 反向引物:CGCACCTCTCGACCGC |
注:SEPT9—胞裂蛋白9;IRF4—干扰素调节因子4;BCAT1—支链氨基酸转氨酶1;IKZF1—Ikaros家族锌指蛋白1;VIC—2-氯-7-苯基-1,4-二氯-6-羧基荧光素;MGB—小沟结合物;FAM—羧基荧光素
采用SPSS21.0统计学软件处理数据,符合正态分布的计量资料以均值±标准差(Mean±SD)表示,组间比较采用t检验;计数资料以例(%)表示,组间比较采用χ2检验。以P<0.05为差异具有统计学意义。
由表2可知,病例组血液中SEPT9、IRF4、BCAT1和IKZF1单基因甲基化阳性率分别为67%(70/105)、44%(46/105)、45%(47/105)和46%(48/105),均高于对照组(均为0),差异均具有统计学意义(均P<0.001)。联合基因甲基化检测以其中任一基因甲基化阳性即判定为阳性,检测结果见表2,病例组血液中SEPT9+IRF4、BCAT1+IKZF1和SEPT9+IRF4+BCAT1+IKZF1联合基因甲基化阳性率分别为68%(71/105)、60%(63/105)和76%(80/105),均高于对照组(均为0),差异均具有统计学意义(均P<0.001)。
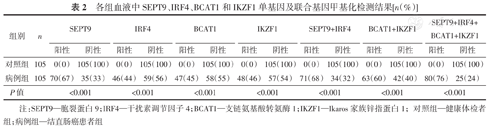
各组血液中SEPT9、IRF4、BCAT1和IKZF1单基因及联合基因甲基化检测结果[n(%)]
各组血液中SEPT9、IRF4、BCAT1和IKZF1单基因及联合基因甲基化检测结果[n(%)]
| 组别 | n | SEPT9 | IRF4 | BCAT1 | IKZF1 | SEPT9+IRF4 | BCAT1+IKZF1 | SEPT9+IRF4+BCAT1+IKZF1 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 阳性 | 阴性 | 阳性 | 阴性 | 阳性 | 阴性 | 阳性 | 阴性 | 阳性 | 阴性 | 阳性 | 阴性 | 阳性 | 阴性 | ||
| 对照组 | 105 | 0(0) | 105(100) | 0(0) | 105(100) | 0(0) | 105(100) | 0(0) | 105(100) | 0(0) | 105(100) | 0(0) | 105(100) | 0(0) | 105(100) |
| 病例组 | 105 | 70(67) | 35(33) | 46(44) | 59(56) | 47(45) | 58(55) | 48(46) | 57(54) | 71(68) | 34(32) | 63(60) | 42(40) | 80(76) | 25(24) |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | ||||||||
注:SEPT9—胞裂蛋白9;IRF4—干扰素调节因子4;BCAT1—支链氨基酸转氨酶1;IKZF1—Ikaros家族锌指蛋白1;对照组—健康体检者组;病例组—结直肠癌患者组
由表3可知,结直肠癌患者血液中SEPT9、IRF4、BCAT1和IKZF1单基因甲基化状态均与结直肠癌患者的肿瘤临床分期、肿瘤最大径、无进展生存期(progression-free survival, PFS)和总生存期相关(均P<0.05);IRF4基因甲基化还与微卫星状态和病理部位相关(均P<0.05);IKZF1基因甲基化亦与微卫星状态相关(P<0.05)。
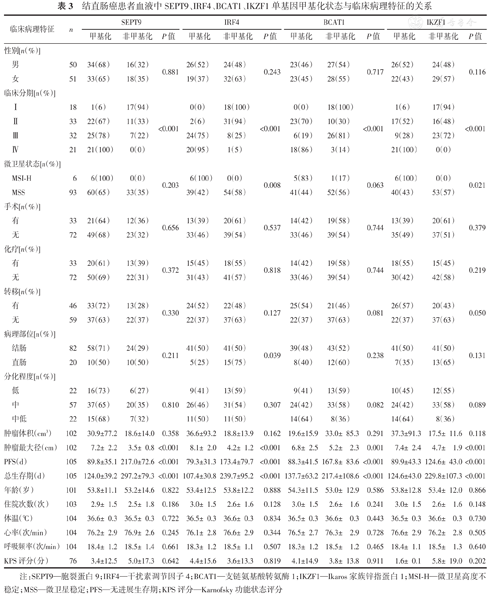
结直肠癌患者血液中SEPT9、IRF4、BCAT1、IKZF1单基因甲基化状态与临床病理特征的关系
结直肠癌患者血液中SEPT9、IRF4、BCAT1、IKZF1单基因甲基化状态与临床病理特征的关系
| 临床病理特征 | n | SEPT9 | IRF4 | BCAT1 | IKZF1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 甲基化 | 非甲基化 | P值 | 甲基化 | 非甲基化 | P值 | 甲基化 | 非甲基化 | P值 | 甲基化 | 非甲基化 | P值 | |||
| 性别[n(%)] | ||||||||||||||
| 男 | 50 | 34(68) | 16(32) | 0.881 | 26(52) | 24(48) | 0.243 | 23(46) | 27(54) | 0.717 | 26(52) | 24(48) | 0.116 | |
| 女 | 51 | 33(65) | 18(35) | 19(37) | 32(63) | 23(45) | 28(55) | 22(43) | 29(57) | |||||
| 临床分期[n(%)] | ||||||||||||||
| Ⅰ | 18 | 1(6) | 17(94) | 0(0) | 18(100) | 0(0) | 18(100) | 1(6) | 17(94) | |||||
| Ⅱ | 33 | 22(67) | 11(33) | <0.001 | 2(6) | 31(94) | <0.001 | 23(70) | 10(30) | <0.001 | 17(52) | 16(48) | <0.001 | |
| Ⅲ | 32 | 25(78) | 7(22) | 24(75) | 8(25) | 6(19) | 26(81) | 9(28) | 23(72) | |||||
| Ⅳ | 21 | 21(100) | 0(0) | 20(95) | 1(5) | 18(86) | 3(14) | 21(100) | 0(0) | |||||
| 微卫星状态[n(%)] | ||||||||||||||
| MSI-H | 6 | 6(100) | 0(0) | 0.203 | 6(100) | 0(0) | 0.008 | 5(83) | 1(17) | 0.063 | 6(100) | 0(0) | 0.021 | |
| MSS | 93 | 60(65) | 33(35) | 39(42) | 54(58) | 41(44) | 52(56) | 40(43) | 53(57) | |||||
| 手术[n(%)] | ||||||||||||||
| 有 | 33 | 21(64) | 12(36) | 0.656 | 13(39) | 20(61) | 0.537 | 14(42) | 19(58) | 0.744 | 13(39) | 20(61) | 0.379 | |
| 无 | 72 | 49(68) | 23(32) | 33(46) | 39(54) | 33(46) | 39(54) | 35(49) | 37(51) | |||||
| 化疗[n(%)] | ||||||||||||||
| 有 | 33 | 20(61) | 13(39) | 0.372 | 15(45) | 18(55) | 0.818 | 14(42) | 19(58) | 0.744 | 18(55) | 15(45) | 0.219 | |
| 无 | 72 | 50(69) | 22(31) | 31(43) | 41(57) | 33(46) | 39(54) | 30(42) | 42(58) | |||||
| 转移[n(%)] | ||||||||||||||
| 有 | 46 | 33(72) | 13(28) | 0.330 | 24(52) | 22(48) | 0.127 | 25(54) | 21(46) | 0.081 | 26(57) | 20(43) | 0.050 | |
| 无 | 59 | 37(63) | 22(37) | 22(37) | 37(63) | 22(37) | 37(63) | 22(37) | 37(63) | |||||
| 病理部位[n(%)] | ||||||||||||||
| 结肠 | 82 | 58(71) | 24(29) | 0.211 | 41(50) | 41(50) | 0.039 | 39(48) | 43(52) | 0.238 | 41(50) | 41(50) | 0.131 | |
| 直肠 | 20 | 10(50) | 10(50) | 5(25) | 15(75) | 8(40) | 12(60) | 7(35) | 13(65) | |||||
| 分化程度[n(%)] | ||||||||||||||
| 低 | 22 | 16(73) | 6(27) | 9(41) | 13(59) | 9(41) | 13(59) | 10(45) | 12(55) | |||||
| 中 | 57 | 37(65) | 20(35) | 0.810 | 26(46) | 31(54) | 0.307 | 24(42) | 33(58) | 0.082 | 24(42) | 33(58) | 0.089 | |
| 中低 | 22 | 15(68) | 7(32) | 11(50) | 11(50) | 14(64) | 8(36) | 14(64) | 8(36) | |||||
| 肿瘤体积(cm3) | 102 | 30.9±77.2 | 18.6±14.0 | 0.358 | 36.6±93.2 | 18.8±13.9 | 0.162 | 19.6±15.9 | 33.0± 85.3 | 0.291 | 37.3±91.3 | 17.5± 11.6 | 0.118 | |
| 肿瘤最大径(cm) | 102 | 7.2± 2.2 | 3.5± 0.8 | <0.001 | 8.1± 2.0 | 4.2± 1.2 | <0.001 | 6.8± 2.5 | 5.2± 2.3 | 0.001 | 7.4± 2.4 | 4.7± 1.9 | <0.001 | |
| PFS(d) | 105 | 89.8±35.1 | 217.0±72.6 | <0.001 | 79.3±31.3 | 173.4±79.7 | <0.001 | 88.3±41.5 | 167.8± 83.6 | <0.001 | 89.9±43.3 | 124.6± 43.0 | <0.001 | |
| 总生存期(d) | 105 | 124.0±39.2 | 297.2±79.3 | <0.001 | 107.4±30.8 | 239.7±95.2 | <0.001 | 137.7±63.2 | 217.4±108.6 | <0.001 | 124.6±43.0 | 229.8±107.3 | <0.001 | |
| 年龄(岁) | 101 | 53.8±11.1 | 53.2±14.6 | 0.822 | 53.4±12.5 | 53.8±12.2 | 0.888 | 54.3±11.5 | 53.0± 12.9 | 0.586 | 53.8±12.8 | 53.4± 12.0 | 0.866 | |
| 住院次数(次) | 103 | 2.9± 1.5 | 2.5± 1.8 | 0.186 | 3.0± 1.5 | 2.6± 1.6 | 0.128 | 3.0± 1.5 | 2.6± 1.6 | 0.241 | 3.0± 1.5 | 2.6± 1.6 | 0.148 | |
| 体温(℃) | 104 | 36.6± 0.3 | 36.5± 0.3 | 0.722 | 36.5± 0.3 | 36.6± 0.3 | 0.834 | 36.5± 0.3 | 36.6± 0.3 | 0.443 | 36.5± 0.3 | 36.6± 0.3 | 0.730 | |
| 心率(次/min) | 104 | 76.2± 2.9 | 76.9± 2.6 | 0.245 | 76.1± 2.8 | 76.6± 2.9 | 0.344 | 76.5± 2.7 | 76.3± 2.9 | 0.728 | 76.6± 2.9 | 76.2± 2.8 | 0.505 | |
| 呼吸频率(次/min) | 104 | 18.4± 1.2 | 18.5± 1.4 | 0.661 | 18.3± 1.2 | 18.5± 1.1 | 0.507 | 18.3± 1.2 | 18.5± 1.2 | 0.465 | 18.4± 1.1 | 18.5± 1.3 | 0.640 | |
| KPS评分(分) | 76 | 3.4±12.5 | 5.0±17.3 | 0.642 | 4.4±15.6 | 3.6±13.3 | 0.819 | 4.1±14.9 | 3.8± 13.8 | 0.911 | 1.6± 0.1 | 5.8± 19.0 | 0.202 | |
注:SEPT9—胞裂蛋白9;IRF4—干扰素调节因子4;BCAT1—支链氨基酸转氨酶1;IKZF1—Ikaros家族锌指蛋白1;MSI-H—微卫星高度不稳定;MSS—微卫星稳定;PFS—无进展生存期;KPS评分—Karnofsky功能状态评分
由表4可知,结直肠癌患者血液中SEPT9+IRF4、BCAT1+IKZF1和SEPT9+IRF4+BCAT1+IKZF1联合基因甲基化状态均与结直肠癌患者的肿瘤临床分期、肿瘤最大径、PFS和总生存期相关(均P<0.05);BCAT1+IKZF1联合基因甲基化还与病理部位和分化程度相关(均P<0.05)。
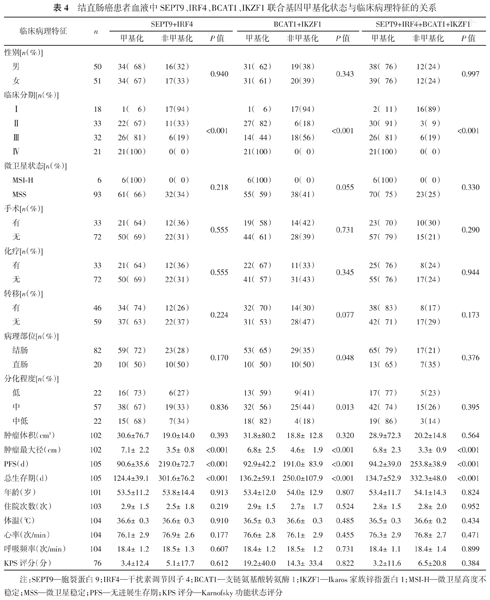
结直肠癌患者血液中SEPT9、IRF4、BCAT1、IKZF1联合基因甲基化状态与临床病理特征的关系
结直肠癌患者血液中SEPT9、IRF4、BCAT1、IKZF1联合基因甲基化状态与临床病理特征的关系
| 临床病理特征 | n | SEPT9+IRF4 | BCAT1+IKZF1 | SEPT9+IRF4+BCAT1+IKZF1 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 甲基化 | 非甲基化 | P值 | 甲基化 | 非甲基化 | P值 | 甲基化 | 非甲基化 | P值 | |||
| 性别[n(%)] | |||||||||||
| 男 | 50 | 34( 68) | 16(32) | 0.940 | 31( 62) | 19(38) | 0.343 | 38( 76) | 12(24) | 0.997 | |
| 女 | 51 | 34( 67) | 17(33) | 31( 61) | 20(39) | 39( 76) | 12(24) | ||||
| 临床分期[n(%)] | |||||||||||
| Ⅰ | 18 | 1( 6) | 17(94) | <0.001 | 1( 6) | 17(94) | <0.001 | 2( 11) | 16(89) | <0.001 | |
| Ⅱ | 33 | 22( 67) | 11(33) | 27( 82) | 6(18) | 30( 91) | 3( 9) | ||||
| Ⅲ | 32 | 26( 81) | 6(19) | 14( 44) | 18(56) | 26( 81) | 6(19) | ||||
| Ⅳ | 21 | 21(100) | 0( 0) | 21(100) | 0( 0) | 21(100) | 0( 0) | ||||
| 微卫星状态[n(%)] | |||||||||||
| MSI-H | 6 | 6(100) | 0( 0) | 0.218 | 6(100) | 0( 0) | 0.055 | 6(100) | 0( 0) | 0.330 | |
| MSS | 93 | 61( 66) | 32(34) | 55( 59) | 38(41) | 70( 75) | 23(25) | ||||
| 手术[n(%)] | |||||||||||
| 有 | 33 | 21( 64) | 12(36) | 0.555 | 19( 58) | 14(42) | 0.731 | 23( 70) | 10(30) | 0.290 | |
| 无 | 72 | 50( 69) | 22(31) | 44( 61) | 28(39) | 57( 79) | 15(21) | ||||
| 化疗[n(%)] | |||||||||||
| 有 | 33 | 21( 64) | 12(36) | 0.555 | 22( 67) | 11(33) | 0.345 | 25( 76) | 8(24) | 0.944 | |
| 无 | 72 | 50( 69) | 22(31) | 41( 57) | 31(43) | 55( 76) | 17(24) | ||||
| 转移[n(%)] | |||||||||||
| 有 | 46 | 34( 74) | 12(26) | 0.224 | 32( 70) | 14(30) | 0.077 | 38( 83) | 8(17) | 0.173 | |
| 无 | 59 | 37( 63) | 22(37) | 31( 53) | 28(47) | 42( 71) | 17(29) | ||||
| 病理部位[n(%)] | |||||||||||
| 结肠 | 82 | 59( 72) | 23(28) | 0.170 | 53( 65) | 29(35) | 0.048 | 65( 79) | 17(21) | 0.376 | |
| 直肠 | 20 | 10( 50) | 10(50) | 10( 50) | 10(50) | 13( 65) | 7(35) | ||||
| 分化程度[n(%)] | |||||||||||
| 低 | 22 | 16( 73) | 6(27) | 0.836 | 13( 59) | 9(41) | 0.013 | 17( 77) | 5(23) | 0.395 | |
| 中 | 57 | 38( 67) | 19(33) | 32( 56) | 25(44) | 42( 74) | 15(26) | ||||
| 中低 | 22 | 15( 68) | 7(34) | 18( 82) | 4(18) | 19( 86) | 3(14) | ||||
| 肿瘤体积(cm3) | 102 | 30.6±76.7 | 19.0±14.0 | 0.393 | 31.8±80.2 | 18.8± 12.8 | 0.320 | 28.9±72.3 | 20.2±14.8 | 0.564 | |
| 肿瘤最大径(cm) | 102 | 7.1± 2.2 | 3.5± 0.8 | <0.001 | 6.8± 2.5 | 4.6± 1.9 | <0.001 | 6.8± 2.3 | 3.3± 0.9 | <0.001 | |
| PFS(d) | 105 | 90.6±35.6 | 219.0±72.7 | <0.001 | 92.9±42.2 | 191.0± 83.9 | <0.001 | 94.2±39.0 | 253.8±38.9 | <0.001 | |
| 总生存期(d) | 105 | 124.4±39.1 | 301.6±76.2 | <0.001 | 136.2±59.1 | 250.0±107.9 | <0.001 | 134.7±52.9 | 332.3±48.0 | <0.001 | |
| 年龄(岁) | 101 | 53.5±11.2 | 53.8±14.4 | 0.913 | 53.4±12.0 | 54.0± 12.9 | 0.807 | 53.4±11.7 | 54.1±14.3 | 0.824 | |
| 住院次数(次) | 103 | 2.9± 1.5 | 2.5± 1.8 | 0.219 | 2.9± 1.5 | 2.7± 1.7 | 0.524 | 2.8± 1.5 | 2.8± 2.0 | 0.952 | |
| 体温(℃) | 104 | 36.6± 0.3 | 36.6± 0.3 | 0.910 | 36.5± 0.3 | 36.6± 0.3 | 0.485 | 36.5± 0.3 | 36.6± 0.2 | 0.434 | |
| 心率(次/min) | 104 | 76.1± 2.9 | 76.9± 2.6 | 0.177 | 76.6± 2.8 | 76.1± 2.9 | 0.455 | 76.3± 2.9 | 76.8± 2.7 | 0.471 | |
| 呼吸频率(次/min) | 104 | 18.4± 1.2 | 18.5± 1.3 | 0.607 | 18.4± 1.2 | 18.5± 1.2 | 0.731 | 18.4± 1.1 | 18.4± 1.4 | 0.899 | |
| KPS评分(分) | 76 | 3.4±12.4 | 5.1±17.7 | 0.612 | 19.2±40.0 | 14.3± 33.4 | 0.822 | 3.2±11.6 | 6.5±20.8 | 0.384 | |
注:SEPT9—胞裂蛋白9;IRF4—干扰素调节因子4;BCAT1—支链氨基酸转氨酶1;IKZF1—Ikaros家族锌指蛋白1;MSI-H—微卫星高度不稳定;MSS—微卫星稳定;PFS—无进展生存期;KPS评分—Karnofsky功能状态评分
以结直肠癌患者癌组织为验证样本,检测其中SEPT9、IRF4、BCAT1和IKZF1基因的甲基化状态。检测结果见表5,癌组织中SEPT9、IRF4、BCAT1和IKZF1单基因甲基化阳性率分别为83%(75/90)、83%(75/90)、72%(65/90)和61%(55/90),均高于癌旁组织中对应的单基因甲基化阳性率[9%(8/90)、9%(8/90)、13%(12/90)和6%(5/90)],差异均具有统计学意义(均P<0.001);癌组织中SEPT9+IRF4、SEPT9+BCAT1、IRF4+BCAT1、SEPT9+IRF4+BCAT1、SEPT9+IRF4+BCAT1+IKZF1联合基因甲基化阳性率分别为94%(85/90)、94%(85/90)、92%(83/90)、98%(88/90)和99%(89/90),均高于癌旁组织中对应的联合基因甲基化阳性率[10%(9/90)、17%(15/90)、17%(15/90)、18%(16/90)和21%(19/90)],差异均具有统计学意义(均P<0.001)。
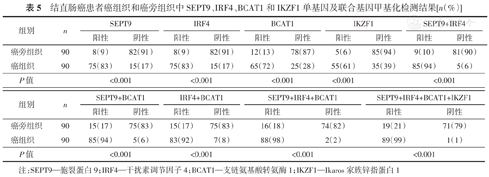
结直肠癌患者癌组织和癌旁组织中SEPT9、IRF4、BCAT1和IKZF1单基因及联合基因甲基化检测结果[n(%)]
结直肠癌患者癌组织和癌旁组织中SEPT9、IRF4、BCAT1和IKZF1单基因及联合基因甲基化检测结果[n(%)]
| 组别 | n | SEPT9 | IRF4 | BCAT1 | IKZF1 | SEPT9+IRF4 | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 阳性 | 阴性 | 阳性 | 阴性 | 阳性 | 阴性 | 阳性 | 阴性 | 阳性 | 阴性 | ||
| 癌旁组织 | 90 | 8(9) | 82(91) | 8(9) | 82(91) | 12(13) | 78(87) | 5(6) | 85(94) | 9(10) | 81(90) |
| 癌组织 | 90 | 75(83) | 15(17) | 75(83) | 15(17) | 65(72) | 25(28) | 55(61) | 35(39) | 85(94) | 5(6) |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | ||||||
| 组别 | n | SEPT9+BCAT1 | IRF4+BCAT1 | SEPT9+IRF4+BCAT1 | SEPT9+IRF4+BCAT1+IKZF1 | ||||
|---|---|---|---|---|---|---|---|---|---|
| 阳性 | 阴性 | 阳性 | 阴性 | 阳性 | 阴性 | 阳性 | 阴性 | ||
| 癌旁组织 | 90 | 15(17) | 75(83) | 15(17) | 75(83) | 16(18) | 74(82) | 19(21) | 71(79) |
| 癌组织 | 90 | 85(94) | 5(6) | 83(92) | 7(8) | 88(98) | 2(2) | 89(99) | 1(1) |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | |||||
注:SEPT9—胞裂蛋白9;IRF4—干扰素调节因子4;BCAT1—支链氨基酸转氨酶1;IKZF1—Ikaros家族锌指蛋白1
基因的异常甲基化是癌症发生发展的重要机制之一。SEPT9是高度保守的三磷酸鸟苷结合蛋白septin家族的成员之一,广泛存在于人体细胞中[12]。相关研究结果表明,SEPT9基因甲基化检测对结直肠癌筛查的灵敏度为48%,具有良好的临床指导意义[13],且SEPT9基因甲基化阳性率与结直肠癌分期相关[14]。IKZF1在调节免疫系统功能、造血干细胞的增殖和分化等生物进程中发挥着关键作用[15]。BCAT1是一种代谢调节剂,其作用是催化支链氨基酸降解的第一步,并促进谷氨酸的产生[16]。有文献报道,IKZF1和BCAT1失调与多种癌症相关,如鼻咽癌、上皮性卵巢癌、肺癌和结直肠癌[17]。Jedi等[18]发现,IKZF1和BCAT1在结直肠癌的各阶段均高度甲基化,但在邻近的非肿瘤组织中未发现甲基化。IRF4启动子CpG岛基因特异性高甲基化也被证明与癌症的进展相关[19]。Luo等[20]指出,IRF4过甲基化与结直肠癌的高风险(比值比为16.96)相关。因此,本研究选择了SEPT9、IRF4、BCAT1和IKZF1基因,研究其单基因和联合基因甲基化检测在结直肠癌早期诊断中的价值。
本研究结果显示,血液中SEPT9、IRF4、BCAT1和IKZF1单基因甲基化阳性率分别为67%、44%、45%和46%;而SEPT9+IRF4、BCAT1+IKZF1和SEPT9+IRF4+BCAT1+IKZF1联合基因甲基化阳性率分别为68%、60%和76%,均高于对应的单基因甲基化阳性率。王秀江等[21]发现,APC、P16、DCC和MLH1基因在结直肠癌组织中的甲基化阳性率分别为52.0%、32.0%、44.0%和60.0%,而这4种基因联合甲基化阳性率为92.0%。何樱等[22]的研究结果显示,p16INK4a、MG-MT和RASSF1A单基因甲基化检测结直肠癌的灵敏度分别为64%、61%和70%,而这3种基因甲基化联合检测的灵敏度为95.8%,表明联合检测可明显提高结直肠癌的诊断效能。本研究结果还显示,SEPT9+IRF4+BCAT1+IKZF1联合基因甲基化阳性率与PFS显著相关,提示联合检测这4种基因甲基化有助于结直肠癌的预后预测,在临床中具有潜在的应用价值。
组织活检是结直肠癌诊断的金标准。本研究结果发现,验证组癌组织样本中SEPT9+IRF4+BCAT1+IKZF1联合基因甲基化阳性率为99%,高于病例组血液样本的76%。但在结直肠癌早期筛查中,组织穿刺活检存在取材困难、安全性有限、有创等缺点[23],而血液检测具有取样方便、安全、无痛等优点,且血液中的cfDNA可作为肿瘤检测和预后监测的特异性分子标志物。由此可见,血液中SEPT9、IRF4、BCAT1和IKZF1基因甲基化联合检测在结直肠癌早期诊断中具有潜在的应用价值,其为结直肠癌的早期诊断提供了潜在生物标志物,有望成为结直肠癌无创诊断的一种新手段。
所有作者均声明不存在利益冲突



























