
探讨胸苷激酶1(TK1)、癌胚抗原(CEA)、糖类抗原(CA)19-9、CA15-3和CA72-4在结直肠肿瘤中的表达及临床意义。
采用酶联免疫吸附测定(ELISA)法和电化学发光免疫分析(ECLIA)法分别测定了124例结直肠癌患者、52例结直肠癌前病变患者、154例结直肠良性病变患者、106例健康体检者的血清TK1水平和血清CEA、CA19-9、CA15-3、CA72-4的水平。分析结直肠癌患者血清TK1和其临床病理特征之间的关系。探讨TK1、CEA、CA19-9、CA15-3和CA72-4单独检测与联合检测对结直肠癌的诊断效能。
结直肠癌患者的血清TK1表达水平与肿瘤分期、分化程度、淋巴结转移、远端转移及年龄相关(均P<0.05),但与患者性别无关(P>0.05)。在结直肠癌、癌前病变、良性病变和健康者中,血清TK1水平依次降低。TK1高表达的结直肠癌患者,其生存期更短。多标志物的联合检测的敏感性、特异性和准确率分别为93.5%、93.0%和93.1%。
血清TK1有望成为结直肠癌诊断及预后预测的独立标志物。TK1、CEA、CA19-9、CA15-3和CA72-4的联合检测具有结直肠癌诊断的临床意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌作为高发的恶性肿瘤,在2018年全球新发的1 810万例恶性肿瘤中占6.1%,却造成了9.1%的肿瘤死亡病例。发达国家中,结直肠癌的平均发病率为30.3例/10万人(列肿瘤第3位),死亡率为12.8例/10万人(列肿瘤第4位);发展中国家中,结直肠癌的平均发病率为8.4例/10万人(列肿瘤第4位),死亡率为5.7例/10万人(列肿瘤第5位)[1]。2015年,我国结直肠癌发病率为28.2例/10万人(列肿瘤第3位),死亡率为13.61例/10万人(列肿瘤第5位),其中城市人口比农村人口有更高的发病率和死亡率[2]。
随着生活水平及城市化率的提高,我国结直肠癌的发病率及死亡率逐年升高,因此寻找结直肠癌的特异性标志物,以便对其早期诊治显得尤为重要。胸苷激酶(thymidine kinase,TK)是一种参与DNA合成的细胞酶,分为TK1和TK2。TK1存在于分裂细胞的细胞质中,而TK2位于不增殖细胞的线粒体内[3]。TK1被认为是一种反映肿瘤增殖的生物学标志物,其参与细胞增殖的核苷酸回收途径,在增殖细胞和恶性肿瘤细胞中高表达[4,5]。研究结果表明,TK1的高表达与肿瘤的分期、分级和大小有关[6]。由于TK1几乎不存在于静态细胞中,它被用于监测肿瘤的预后和治疗效果[7]。目前,TK1已被用于早期宫颈上皮内瘤变及早期肺癌的诊断[8,9]。临床上,癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原(carbohydrate antigen,CA)19-9、CA15-3和CA72-4已被用于结直肠肿瘤的诊断,以提高诊断敏感性和特异性。本研究中,评估TK1水平与结直肠癌患者临床病理特征及预后的关系,并探讨TK1、CEA、CA19-9、CA15-3和CA72-4在结直肠肿瘤中的表达及其临床意义。
选择2017年1月1日至2018年4月30日在天津医科大学第二医院就诊的124例结直肠癌患者,其中男70例,女54例,年龄(63.33±7.88)岁。所有结直肠癌患者均行根治手术切除,按照中国结直肠癌诊疗规范进行治疗,并排除合并干扰性疾病因素。统计所有结直肠癌患者的TK1水平,收集患者的性别、年龄、临床分期、淋巴结转移情况、远端转移情况、肿瘤分化程度等信息。对所有结直肠癌患者进行电话随访,随访截止日期为2020年4月30日或患者死亡日期。
选择同时期在天津医科大学第二医院就诊(或查体)的52例结直肠癌前病变患者,其中男30例,女22例,年龄(64.19±8.18)岁,其病理表现为高级上皮内瘤变、锯齿状腺瘤;154例结直肠腺瘤样息肉患者,其中男80例,女74例,年龄(63.88±6.37)岁,其病理表现为管状腺瘤、绒毛状管状腺瘤、炎性息肉;106名中老年健康受试者(年龄范围为50~80岁),其中男62名,女44名,年龄(63.36±7.36)岁,所有健康受试者的体检报告均未见严重的感染或疾病。所有入组者均签署知情同意书。
胸苷激酶1(TK1)细胞周期分析试剂盒(华瑞同康生物技术有限公司)。Immulite 2000全自动化学发光免疫分析仪(德国西门子公司)。
采用单盲法随机分组。其中,106名健康受试者入健康组,154例结直肠腺瘤样息肉患者入良性组,52例结直肠癌前病变患者入癌前病变组,124例结直肠癌患者入结直肠癌组。上述4组中,入组者的性别及年龄等的差异无统计学意义(均P>0.05)。
于清晨采集所有受试者的空腹血样至不含肝素的抽血管中,室温静置30~60 min至血液凝固;以3 500 r/min离心10 min,收集上清液进行酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)。使用TK1细胞周期分析试剂盒并根据试剂盒的使用说明书检测血清TK1水平。检测方法为双抗体夹心法,具体原理为:单克隆抗体TK1制作成固相抗体;于微孔板中加入内含TK1的质控物、校准物、待测样品、TK1酶结合物及TK1结合抗体;适宜温度下培育后,形成抗原及抗体复合物,经过洗涤显色,终止反应后测定450 nm处的吸光度值;该吸光度值与TK1值正相关,通过校准品校准后计算样本的TK1水平。
具体检测步骤为:室温下(约25°)将微孔条固定于板架上并标记;先加入50 μl样品、TK1质控品和TK1校准品,再加入50 μl TK1抗体混匀,留置空白孔;用封口膜封闭条板,在37 ℃下孵育30 min;拿出反应板,去掉其中液体,用洗涤液清洗5次,甩干,小心避免气泡生成;除空白孔外,每孔加入100 μl TK1酶复合物。封闭好后37 ℃孵育30 min;用洗涤液清洗5次;各个孔内依次加入50 μl A、B显色剂,小心混匀,37 ℃下孵育15 min;在各孔内加入终止液50 μl,混匀;采用酶标仪测定450 nm处的吸光度值,再计算出TK1的水平。TK1的正常参考值为0~2.0 pmol/L。
在天津医科大学第二医院核医学科,使用电化学发光免疫分析(electrochemiluminescence immunoassay,ECLIA)法定量测定所有受试者血样中的CEA、CA19-9、CA15-3和CA72-4水平。
CEA、CA19-9、CA15-3和CA72-4的正常参考值分别为0~5 ng/mL、0~37 U/ml、0~35 U/mL和0~6.9 U/ml。
采用SPSS22.0软件进行统计学分析,计量资料以均值±标准差(Mean±SD)表示,两组间比较采用t检验,通过卡方(χ2)检验比较临床病理特征与TK1蛋白表达水平之间的相关性。以P<0.05为差异具有统计学意义。
根据TK1的正常参考值0~2.0 pmol/L,将所有受试者分为TK1阴性组(<2 pmol/L)和TK1阳性组(≥2 pmol/L)。
如表1,结直肠癌患者的血清TK1水平与性别的相关性无统计学意义(P>0.05),但TK1水平与患者年龄、临床分期、淋巴结转移情况、远端转移情况、肿瘤分化程度相关(均P<0.05)。此外,受试者血清TK1水平随结直肠癌患者年龄增大而降低(P<0.05);Ⅲ、Ⅳ期患者的血清TK1水平高于Ⅰ、Ⅱ期患者(P<0.05);有淋巴结转移的患者,其血清TK1水平更高(P<0.05);而低分化或黏液腺癌的患者,其血清TK1水平明显高于中、高分化的患者(P<0.05)。
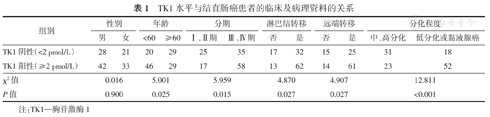
TK1水平与结直肠癌患者的临床及病理资料的关系
TK1水平与结直肠癌患者的临床及病理资料的关系
| 组别 | 性别 | 年龄 | 分期 | 淋巴结转移 | 远端转移 | 分化程度 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 男 | 女 | <60 | ≥60 | Ⅰ、Ⅱ期 | Ⅲ、Ⅳ期 | 否 | 是 | 否 | 是 | 中、高分化 | 低分化或黏液腺癌 | |
| TK1阴性(<2 pmol/L) | 28 | 21 | 20 | 29 | 25 | 35 | 17 | 32 | 15 | 25 | 31 | 18 |
| TK1阳性(≥2 pmol/L) | 42 | 33 | 46 | 29 | 17 | 58 | 13 | 62 | 14 | 61 | 23 | 52 |
| χ2值 | 0.016 | 5.001 | 5.959 | 4.870 | 4.907 | 12.811 | ||||||
| P值 | 0.900 | 0.025 | 0.015 | 0.027 | 0.027 | <0.001 | ||||||
注:TK1—胸苷激酶1
血清TK1水平<2 pmol/L和≥2 pmol/L的结直肠癌患者的生存曲线如图1所示。结果表明,TK1水平<2 pmol/L的患者,其生存期明显长于TK1水平≥2 pmol/L的患者(P<0.01),提示TK1可作为结直肠癌患者预后的预测指标。
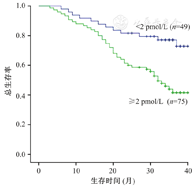

TK1—胸苷激酶1
各组的血清TK1、CEA、CA19-9、CA15-3和CA72-4水平见表2。结果显示,结直肠癌患者的血清TK1水平最高,癌前病变组其次,良性病变组及健康组最低(均P<0.05)。对于CEA、CA 19-9、CA15-3和CA72-4水平,健康组与癌前病变组及结直肠癌组之间的差异有统计学意义(均P<0.05);而良性病变组与健康组之间的差异无统计学意义(均P>0.05)。
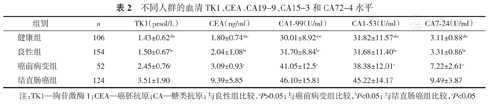
不同人群的血清TK1、CEA、CA19-9、CA15-3和CA72-4水平
不同人群的血清TK1、CEA、CA19-9、CA15-3和CA72-4水平
| 组别 | n | TK1(pmol/L) | CEA(ng/ml) | CA1-99(U/ml) | CA1-53(U/ml) | CA7-24(U/ml) |
|---|---|---|---|---|---|---|
| 健康组 | 106 | 1.43±0.62abc | 1.80±0.74abc | 30.01±8.92abc | 31.82±11.57abc | 3.11±0.88abc |
| 良性组 | 154 | 1.50±0.67bc | 2.04±1.08bc | 31.70±8.84bc | 31.68±11.40bc | 3.31±0.86bc |
| 癌前病变组 | 52 | 2.45±0.76c | 3.09±0.93c | 41.05±12.5c | 38.38±12.01c | 7.22±2.61c |
| 结直肠癌组 | 124 | 3.51±1.90 | 9.39±5.85 | 46.10±15.81 | 45.22±14.17 | 9.49±3.87 |
注:TK1—胸苷激酶1;CEA—癌胚抗原;CA—糖类抗原;与良性组比较,aP>0.05;与癌前病变组比较,bP<0.05;与结直肠癌组比较,cP<0.05
TK1、CEA、CA19-9、CA15-3和CA72-4的独立检测和联合检测对结直肠癌的诊断效能见表3。结果显示,联合检测的诊断效能明显高于独立检测,且联合检测的项目越多,敏感性、特异性、准确率越高。
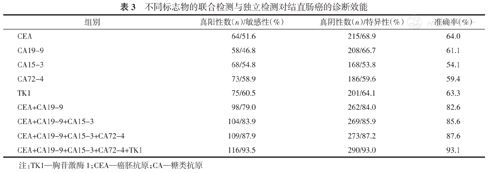
不同标志物的联合检测与独立检测对结直肠癌的诊断效能
不同标志物的联合检测与独立检测对结直肠癌的诊断效能
| 组别 | 真阳性数(n)/敏感性(%) | 真阴性数(n)/特异性(%) | 准确率(%) |
|---|---|---|---|
| CEA | 64/51.6 | 215/68.9 | 64.0 |
| CA19-9 | 58/46.8 | 208/66.7 | 61.1 |
| CA15-3 | 68/54.8 | 168/53.8 | 54.1 |
| CA72-4 | 73/58.9 | 186/59.6 | 59.4 |
| TK1 | 75/60.5 | 201/64.1 | 63.3 |
| CEA+CA19-9 | 98/79.0 | 262/84.0 | 82.6 |
| CEA+CA19-9+CA15-3 | 104/83.9 | 269/85.9 | 85.6 |
| CEA+CA19-9+CA15-3+CA72-4 | 109/87.9 | 273/87.2 | 87.6 |
| CEA+CA19-9+CA15-3+CA72-4+TK1 | 116/93.5 | 290/93.0 | 93.1 |
注:TK1—胸苷激酶1;CEA—癌胚抗原;CA—糖类抗原
2015年,我国有结直肠癌新发病例49 800例,结直肠癌死亡病例19 100例[10]。早期结直肠癌的症状很隐匿,在结肠镜筛查未普及的背景下,寻找诊断效能高的标志物非常重要。虽然,临床上已发现一些相关的肿瘤标志物,但其敏感性及特异性仍较低。在细胞周期中,TK1在嘧啶脱氧核苷酸的合成中起关键作用。血清TK1检测已被用于多种实体肿瘤的诊断和预后分析,包括肺癌、乳腺癌、结直肠癌[11,12,13]。Weagel等[14]发现结直肠癌患者的血清TK1水平较健康人明显升高,本研究结果与其一致。另有研究结果表明,在结肠癌患者中,TK1只在恶性肿瘤细胞的细胞膜上表达,而在正常细胞的细胞膜上不表达,提示TK1特异性定位于肿瘤细胞膜上。在血液系统肿瘤中,也有类似的发现[15]。癌症患者血清中,TK1的高表达提示TK1可能是一种与肿瘤生长相关的标志物,并可预测其进展情况。本研究中,分析了124例结直肠癌患者的血清TK1水平与其临床病理特征之间的关系。结果表明,TK1可用于结直肠癌患者的早期诊断和肿瘤进展评估。
此前的研究结果表明,部分诊断效能高的肿瘤标志物在肿瘤中表达稳定,尤其在肿瘤细胞的细胞膜上过表达,而在正常细胞或正常组织中低表达[16]。例如,人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)在乳腺癌、结直肠癌、胰腺癌中过表达[17]。对于HER2呈阳性的肿瘤,临床上是通过靶向细胞膜上的HER2来治疗的[17,18]。也有研究者发现,TK1在乳腺癌和结肠癌细胞系中高表达[19,20]。TK1水平升高表明肿瘤增殖活跃。Calzado等[21]发现Ⅱ期非小细胞肺腺癌患者的血清TK1水平高于Ⅰ期患者。Cho等[22]在对胃癌患者进行相关研究后发现,Ⅲ、Ⅳ期患者的TK1水平明显高于Ⅰ、Ⅱ期患者。Wang等[23]发现,对于同等大小的肺癌、胃癌及甲状腺癌肿瘤,TK1水平越高,患者的预后越差。Xu等[24]发现,TK1表达水平与肺癌的病理分期相关。McCartney[25]等则认为血清TK1水平升高是乳腺癌等高恶性肿瘤无法被完整切除的危险因素。
CEA、CA19-9、CA15-3和CA72-4是消化道肿瘤的常见标志物。CEA是一种最早从胚胎和结肠腺癌组织中提取到的糖蛋白,在包括结直肠癌的很多消化道肿瘤中高表达[26]。CEA的优势是判断肿瘤的性质,而非反映肿瘤增生的活跃度[27]。CA19-9是从大肠细胞中提取的糖类蛋白,其对于结直肠癌的诊断特异性较高,但敏感性较差。而CA15-3更多地用于乳腺癌的诊断,但其水平在结直肠癌、胰腺癌等消化道肿瘤中也有不同程度升高。CA72-4用于胃肠道肿瘤诊断时,敏感性较高,但单独作为标志物还不能满足相关肿瘤的临床诊断需求[28]。本研究结果表明,TK1、CEA、CA19-9、CA15-3和CA72-4联合检测的诊断效能较好,敏感性、特异性、准确率分别为93.5%、93.0%和93.1%。
综上,联合检测TK1、CEA、CA19-9、CA15-3和CA72-4可获得较好的结直肠癌诊断敏感度和特异度;较高血清TK1水平,提示更差的预后;血清TK1有望作为一个独立的结直肠癌标志物,其在结直肠癌的临床诊断及预后预测中具有应用潜力。
所有作者均声明不存在利益冲突






























