
金属硫蛋白(MT)是一种富含半胱氨酸、可结合多种金属的低相对分子质量蛋白。MT具有4种亚型(MT-1、MT-2、MT-3和MT-4)共11种功能性异构体,但其确切的生理功能尚不明了。MT可能具有维持微量元素的代谢和稳态、重金属解毒和拮抗氧化应激等作用。同时,MT基因及其多态性可参与动脉粥样硬化、糖尿病、肿瘤、神经变性以及炎症反应等病理过程而与多种疾病的发生发展关系密切。由于MT基因的多态性可影响其蛋白表达及功能,对MT基因多态性与病理学过程的关联性作一综述,为探讨MT的病理生理学意义提供科学依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
金属硫蛋白(metallothionein,MT)是一种富含半胱氨酸(~30%)、低相对分子质量(~7 ku)、可结合多种重金属如锌(Zn)、镉(Cd)、铜(Cu)的蛋白质[1,2]。自1957年在马肾皮质中以Cd结合蛋白被发现后,MT得到了广泛的研究。但迄今其确切的生理学功能仍未明了,其可能具有维持必需金属(Zn、Cu等)的代谢和稳态、重金属(Cd、Hg、Pb、As等)解毒以及拮抗氧化应激和损伤等作用,并参与调控细胞的存活、增殖、侵袭、凋亡及血管生成和炎症反应等病理生理学过程[1,2]。研究结果表明,MT的异常表达与重金属所致肾损伤、动脉粥样硬化、糖尿病、神经变性和肿瘤等病变有关[2]。由于MT基因的多态性可影响其蛋白的表达及功能,因此本文对MT基因的多态性及其相关的病理学过程作一综述,为进一步了解MT的功能提供参考。
哺乳动物的MT有4种异构体,分别为MT-1、MT-2、MT-3和MT-4。其中MT-1和MT-2广泛存在于各种细胞和组织中,以在肝和肾组织中的含量最高;MT-3主要分布于神经系统,但在胰腺和肠组织亦有少量表达;而MT-4仅存在于皮肤和舌的鳞状上皮细胞中[1]。人类MT至少有11种功能性异构体,即MT-1A、MT-1B、MT-1E、MT-1F、MT-1G、MT-1H、MT-1M、MT-1X、MT-2A、MT-3和MT-4,此外还有7种不表达的假基因(MT-1C、MT-1D、MT-1I、MT-1J、MT-1L、PT-1P和MT-2B),它们均定位于染色体16q12-22区域[1,2,3]。MT存在多种亚型,关于其功能性异构体以及假基因的作用尚不明了。
在MT-1和MT-2基因的启动子中含有调控其表达的TATA盒、GC盒和基础水平元件,此外还含有几个特异性调控元件如金属应答元件(metal response element,MRE)、抗氧化物应答元件、糖皮质激素应答元件和甲状腺素应答元件。一些应激因素(金属、激素、缺氧、炎症等)可通过介导MT表达的调控因子(如MRE结合转录因子-1、上游刺激因子-1和核因子-1等)与上述MT基因启动子中的转录调控结构和应答元件结合,在转录水平上诱导MT的合成[3,4]。相反,另一些蛋白如含有痘病毒和锌指结构序列的蛋白PZ120可与MT-2A基因启动子的转录起始点结合,抑制MT-2A的表达;而蛋白Ku80、DNA甲基转移酶(Dnmt 3a)可与甲基化CpG结合蛋白MBD3和染色质重塑蛋白Brg1相互作用,通过增加MT-1基因启动子的甲基化抑制MT-1的表达[4]。虽然MT-3基因的启动子也含有MRE,但其表达似乎不受Zn等金属的诱导,提示MT-3的表达调控有别于MT-1和MT-2[5]。相比于MT-1和MT-2的表达主要受Zn2+、Cd2+等二价阳离子的诱导,MT-4的表达更易受Cu+的影响[6]。
金属硫蛋白在种属间呈高度保守,在哺乳动物中,单个MT-1、MT-2和MT-4分子均由61~62个氨基酸组成,而MT-3含有68个氨基酸,其中半胱氨酸(Cys)多达20个。在MT的肽链中,Cys以Cys-X-Cys、Cys-XX-Cys或Cys-Cys的方式排列(X表示非Cys的其他氨基酸),并与赖氨酸(Lys)和精氨酸(Arg)并排形成金属结合的α-和β-结构域。β-结构域在MT的N-末端,由氨基酸1~30组成,最多可结合3个二价金属离子(如Zn2+、Cd2+、Hg2+或Pb2+等);而α-结构域位于C-末端边缘,由氨基酸31~61/68组成,可结合多达4个二价金属离子。α-和β-结构域由非Cys的其他氨基酸连接或间隔(图1)[7]。
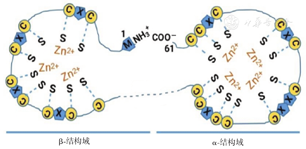

C—Cys;S—硫醇;X—非Cys的其他氨基酸
Zn是与MT结合的生理性金属离子,但其他非必需金属离子如Pb、Cd、Hg、Pt、Cr、Bi和Ag等与MT具有更强的亲和力,而Fe2+相应的亲和力则较低。MT-3与其他MT分子的序列高度相似(约70%相同),但MT-3的N-末端含有Cys-Pro-Cys-Pro(氨基酸6~9)序列,其他MT则无此序列,这可能是MT-3有别于其他MT分子并表现独特的抑制细胞生长作用的原因[7]。
MT富含Cys并可通过巯基与Zn2+结合的特点提示其具有抗氧化作用。研究结果表明,MT正是通过氧化还原循环清除过量的活性氧(reactive oxygen species, ROS)和活性氮等氧化活性物质。MT与ROS发生化学反应,在清除ROS的同时被氧化为二硫化物(MT-disulfide),Zn2+从MT中游离导致MT-Zn解离;在还原剂如谷胱甘肽存在的条件下,被氧化的MT转化为还原型MT(半胱氨酰硫醇)并促使Zn2+与MT结合,从而使MT恢复清除ROS的能力[8]。在生理条件下ROS是极其重要的第二信使,介导细胞生长、分化、周期进展和死亡的全过程。但在病理条件下,过量的ROS不仅可直接造成氧化应激和损伤,还可通过异常激活多个信号转导通路介导动脉粥样硬化、糖尿病、肿瘤、神经变性和炎症等病理过程[9]。而MT通过清除ROS的抗氧化作用在上述病理过程中发挥重要作用[1,3]。
MT基因约1.5 kb,经转录剪切后的mRNA约含有500个核苷酸,编码区仅200个核苷酸,但MT基因呈现丰富的单核苷酸多态性(single nucleotide polymorphisms,SNPs)(表1)。其中MT-1A、MT-1B、MT-1M、MT-2A、MT-3和MT-4的SNPs已在多个研究中被证实与肿瘤、糖尿病、心血管疾病、慢性炎症或重金属的代谢及负荷等多种病理过程存在关联[3]。3.1 MT-1A基因的SNPs(rs8052394、rs11640851以及rs11076161)
MT各亚型基因区域单核苷酸多态性及功能区域分布
MT各亚型基因区域单核苷酸多态性及功能区域分布
| MT基因亚型 | 数量(MAF>0.01) | 3′非翻译区 | 5′非翻译区 | 内含子 | 外显子 |
|---|---|---|---|---|---|
| MT-1A | 10 | 0 | 0 | 8 | 2 |
| MT-1B | 12 | 2 | 0 | 10 | 0 |
| MT-1E | 7 | 3 | 0 | 2 | 2 |
| MT-1F | 3 | 0 | 1 | 2 | 0 |
| MT-1G | 12 | 1 | 1 | 10 | 0 |
| MT-1H | 15 | 2 | 0 | 12 | 1 |
| MT-1M | 8 | 2 | 0 | 5 | 1 |
| MT-1X | 12 | 1 | 1 | 10 | 0 |
| MT-2A | 4 | 1 | 0 | 2 | 1 |
| MT-3 | 6 | 0 | 0 | 6 | 0 |
| MT-4 | 27 | — | — | — | — |
注:MT—金属硫蛋白;MAF—最小等位基因频率;"—"指未查到相关资料。表中数据来源于UCSC(https://genome.ucsc.edu/cgi-bin/hgTables)
rs8052394是位于MT-1A距起始密码子第152个核苷酸的SNP(c.152A>G),可导致MT-1A的氨基酸序列改变(Lys51Arg)。在职业性Pb暴露者中,G等位基因与尿N-乙酰-β-D-氨基葡萄糖苷酶(UNAG)和累积血Pb水平的时间加权指数增高相关[10]。病例对照研究结果发现,与A等位基因携带者相比,G等位基因携带者的血清超氧化物歧化酶活性显著降低,2型糖尿病(type 2 diabetes mellitus, T2DM)风险增加,提示rs8052394很可能是糖尿病易感基因位点之一[11,12]。但A等位基因携带者更易罹患口腔鳞状细胞癌,这可能是由于体内Zn、Cu平衡的改变影响了与其结合的蛋白如抑癌蛋白p53的功能[3]。此外有文献报道,在G等位基因携带者中,随着甲基汞摄入量的增加,头发中的Hg水平降低,G等位基因因其抗氧化作用而对较大的有髓神经具有保护作用[12]。
rs11640851是位于MT-1A编码区自外显子始第80个核苷酸的SNP(c.80C>A),可导致MT-1A第27位的苏氨酸改变为天冬酰胺(Thr27Asn)。通过Zinpyr-1荧光探针检测发现,在携带C等位基因的意大利老年妇女中,MT可释放更多的Zn2+,血中的MT和白细胞介素-6水平降低,罹患心血管疾病和T2DM的风险更高,而A等位基因携带者则更为长寿,提示rs11640851与Zn代谢、炎症发生和长寿有关[11]。此外,A等位基因可使个体神经毒性的敏感性增高,提示该序列还与神经毒性的敏感性有关[12]。
rs11076161位于MT-1A基因的第1个内含子区(c.29-28A>G)。在环境Cd高水平暴露的人群中,A等位基因携带者更易出现血Cd水平升高以及肾损害标志UNAG和尿白蛋白改变,提示rs11076161与重金属代谢及肾毒性有关[13]。在T2DM患者的研究中发现,G等位基因携带者更易患糖尿病性神经病变,这可能与机体细胞内的Zn利用率降低导致血清超氧化物歧化酶活性降低有关[12]。另有研究结果发现,A等位基因携带者患口腔鳞状细胞癌的风险降低,这可能是由于rs11076161参与了Zn和Cu的稳态调节,表明A等位基因可能对口腔癌具有保护作用[14]。此外,在接触Cd的中国人群中,MT-1A中的rs11076161以及MT-2A的rs10636与骨密度变异之间的相关性较弱。因此,MT的遗传变异是否与Cd引起的骨质流失有关尚待进一步研究[15]。
rs964372位于MT-1B基因的第1个内含子区(c.28+137C>G),rs7191779位于MT-1B基因的上游(c.-1975C>G),而rs8052334位于MT-1B基因的第2个内含子区(c.95-68T>C)。有研究结果发现,rs964372的G等位基因携带者其肝细胞癌的发病风险增高(风险比率比配为2.52),而同时携带rs8052394/rs964372/rs8052334分别为A/G/T等位基因的吸烟者罹患肝细胞癌的风险更高(风险比率比配为6.72),显示MT-1B对吸烟所致氧化应激具有影响[16]。在T2DM患者中,rs964372变异与脂肪酸利用率降低之间存在显著相关[12]。此外,rs964372及rs7191779的C等位基因携带者的口腔鳞状细胞癌发病风险均降低[比值比(odds ratio, OR)分别为0.49和0.36][14]。
rs2270836位于MT-1M基因的第2个内含子区(c.95-49G>A),rs9936741位于MT-1M mRNA的第327个核苷酸(c.*31T>C)。研究结果表明,rs2270836的AA基因型携带者其尿Hg水平明显低于GG基因型携带者,提示rs2270836可能通过改变MT的结构来影响蛋白与Hg离子的结合;rs9936741的TT基因型携带者其头发中的Hg含量低于TC或CC基因型携带者[17]。
rs10636位于MT-2A基因的3′非翻译区域(c.*77G>C)。研究者发现,在T2DM患者中,rs10636与高脂血症和T2DM并发神经病变显著相关[3]。在Pb暴露工人中,rs10636的CC基因型会提高手部的神经毒性敏感性,但对脚部影响不大[12]。病例对照研究结果显示,rs10636在共显性和隐性模式下与乳腺癌高风险相关(C/C比G/G:OR=1.86,95%CI:1.17~2.94,P=0.008;C/C比G/G+G/C:OR=1.96,95%CI:1.26~3.05,P=0.003)[18]。在颈动脉狭窄患者中,rs10636的G等位基因携带者更易形成颈动脉斑块,血液中的单核细胞趋化蛋白-1(monocyte chemoattractant protein-1, MCP-1)含量升高,自然杀伤细胞毒性和细胞内的Zn2+利用度降低,血红细胞中的Zn、Cu和Mg水平下降,而血浆中的Fe水平升高,提示微量元素内稳态失衡[19]。推断MCP-1含量升高和自然杀伤细胞毒性降低可能是Zn2+水平下降所致,而MCP-1与动脉粥样硬化的关系已在人体和动物模型上得以验证[19]。此外,rs10636的CC基因型携带者其尿Hg水平低于GG基因型携带者[17]。在奥地利学生中,rs10636变异与血Pb浓度呈负相关,同时也与尿中Cd、Cu和Zn的浓度较低有关,其似乎是调节尿Cd、Cu、Zn的"热点"[20,21]。
rs1610216位于MT-2A基因的启动子区域(c.-209A>G)。在非吸烟人群中,rs1610216与糖尿病无关联;但在吸烟人群中,A等位基因携带者罹患糖尿病的风险显著升高(OR=3.96);而在吸烟的冠心病患者中,糖尿病风险进一步升高(OR=5.50)[3]。有病例对照研究结果显示,rs1610216中CC基因型与TT基因型相比,群体罹患胃癌的风险增加了3.8倍[21]。
rs28366003位于MT-2A基因TATA盒与转录起始位点之间,在核心启动子的共有序列TGCACTC中(c.-77A>G),该遗传变异可改变转录因子与启动子的亲和力,从而影响MT-2A的转录[21]。研究结果发现,在As暴露人群中,rs28366003的G等位基因可导致MT-2A表达下调,从而使结合并运输至肝脏进行生物代谢的As减少,尿样分析结果可见As甲基化减少,亚砷酸盐[As(Ⅲ)]排泌增加[22]。在Pb暴露工人中,G等位基因使Pb神经毒性的敏感性有所提高,GG基因型携带者血液样本中的Pb浓度高于AA或AG基因型携带者[12]。在西班牙北部人群中,AG基因型携带者罹患干性年龄相关性黄斑变性的风险是AA基因型携带者的9倍以上(OR=9.39)[23],而同时携带rs10636 GC和rs28366003 AA基因型则可降低Pb暴露所致高密度脂蛋白胆固醇水平下降的风险[24]。另有研究结果发现,rs28366003 A/G等位基因携带者罹患喉癌的风险约增加1.6倍(OR=2.63,95%CI:1.41~2.85,P<0.001)[25]。-5A/G可影响鼻窦内翻性乳头状瘤组织中MT-2A的表达及Cd、Cu的含量[26]。与AA基因型携带者相比,GG基因型携带者罹患胃癌的风险增加了4倍[21]。此外,rs28366003可影响前列腺组织中MT-2A的表达,这可能与细胞缺乏对某些重金属(Cd、Pb)毒性作用的保护以及必需金属稳态的失常有关,但该特殊作用还有待进一步研究[26]。
MT-3亚型是脑特异性MT,故其在神经系统疾病发生发展中的作用备受关注。rs45570941位于MT-3基因的第2个内含子区(c.97+377G>C)。此基因型和等位基因频率在中国自闭症儿童与对照之间差异均具有统计学意义(均P<0.05),提示自闭症可能与金属代谢障碍有关[27]。但在另一项更大样本量的研究中(132例病患比132例对照),未能证实MT-3表达水平和MT-3遗传变异与自闭症存在关联[28]。因此,MT-3的基因多态性与神经疾病的关系尚有待作进一步探讨。
rs396230位于MT-4基因的第2个内含子区域(c.98-137A>G)。研究结果显示,与rs396230 AA基因型相比,GG基因型携带者的收缩压升高10 mmHg(1 mmHg=0.133 kPa);GG和GA型携带者间血清肌酐、尿素氮和尿酸等肾功能指标差异均具有统计学意义(均P<0.05),提示G等位基因携带者对Pb具有更大的易感性,应避免Pb暴露[29]。该结果可能对Pb暴露工人的就业前体检具有一定的指导性意义。
MT基因具有多种功能亚型和假基因形式,各MT亚型蛋白通过拮抗过量ROS等造成的氧化应激和损伤,参与人体动脉粥样硬化、糖尿病、肿瘤、神经变性等重要病理生理学过程,但MT各亚型间的结构差异及生理学功能仍有待进一步阐明。
MT基因的5′非翻译区、3′非翻译区、剪切位点等多种功能区域均存在SNPs,这些SNPs可能参与调控MT基因转录及蛋白结构改变,进而影响其生理学功能。虽已证实MT的部分SNPs与多种肿瘤、糖尿病等疾病存在显著关联,但仍难以全面反映MT基因的SNPs在病理生理学过程中的遗传效应以及可能存在的遗传-环境交互作用。此外,与疾病显著关联的SNPs是否可作为生物学标志用于预测疾病的发生、发展和预后,为疾病的个体化防治提供作用靶点,仍有待进一步研究。
所有作者均声明不存在利益冲突



























