
探讨中亚苦蒿硅胶柱分离组分(AEM-SC)对小鼠树突状细胞(DC)成熟及免疫功能的影响。
制备中亚苦蒿大孔吸附树脂70%乙醇洗脱组分,经硅胶柱进一步分离得到洗脱组分AEM-SC,并对其多糖、总黄酮、三萜类含量进行测定。流式细胞术检测AEM-SC对DC表面分子表达水平、抗原吞噬能力及刺激同种异体T细胞增殖能力的影响;酶联免疫吸附测定(ELISA)法检测AEM-SC对DC细胞因子表达的影响。
AEM-SC中多糖、黄酮类和萜类的含量分别为10.12%、5.70%和3.62%。体外功能实验结果显示,AEM-SC可明显降低脂多糖诱导的DC表面分子CD40、CD86和主要组织相容性复合体Ⅱ类(MHC-Ⅱ)的表达以及细胞因子白细胞介素-12p40(IL-12p40)、肿瘤坏死因子α(TNF-α)和IL-6的水平(均P<0.05),提高DC摄取抗原的能力(P<0.01),降低DC刺激小鼠脾脏CD4+ T与CD8+ T淋巴细胞增殖的能力(均P<0.001)。小鼠炎症模型实验中,AEM-SC可明显降低脂多糖诱导的小鼠体内DC表面分子CD40、CD86、CD80的表达(均P<0.001)以及血清中细胞因子TNF-α、IL-12p40的表达(均P<0.01)。
AEM-SC在体外与体内实验中均表现出抑制DC成熟的能力,显示AEM-SC具有一定的免疫抑制作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
树突状细胞(dendritic cell,DC)是功能强大的抗原呈递细胞,是机体免疫反应的驱动者,可调节各种效应细胞的功能[1]。DC的激活特征包括趋化因子受体(如CCR7)、黏附分子、共刺激分子(CD54、CD80和CD86)、主要组织相容性复合体Ⅰ类(major histocompatibility complex class Ⅰ,MHC-Ⅰ)和MHC-Ⅱ分子等上调,这些对于DC迁移至淋巴组织及激活免疫应答是必需的[2]。成熟的DC能激发免疫应答,同时也会造成机体免疫耐受,当细胞因子的分泌水平失衡时会导致自身免疫性疾病的发生[3]。目前,DC已成为自身免疫性疾病治疗的研究热点[4,5]。大量研究结果表明,中草药可通过促进DC的成熟来增强免疫反应,或通过抑制DC的成熟来抑制炎症或自身免疫性疾病的免疫反应[6,7]。例如甘草多糖可激活RAW264.7细胞[8],还可与基于DC的人乳头瘤病毒疫苗联用,在TC-1肿瘤小鼠模型中诱导人乳头瘤病毒特异性细胞应答并抑制肿瘤生长[9];阿魏菇水提物可上调小鼠骨髓来源DC中CD40、CD80、CD86和MHC-Ⅱ的表达,也可增加白细胞介素-12(interleukin-12, IL-12)的产生[10];刺山柑果实总生物碱粗提物可抑制脂多糖诱导的DC成熟[11]。由此可见,中草药可有效预防和治疗多种免疫疾病,是新型耐受佐剂的来源[12,13,14,15]。
蒿属(Artemisia L.)植物因其生化和药理学功能的多样性而受到越来越多的关注[16]。本研究所用的材料为中亚苦蒿(Artemisia absinthium L.),是菊科蒿属的多年生草本植物,以全草入药,味苦、性寒,药用部位为叶和茎[17]。中亚苦蒿具有抗感染、抗癌、驱风、镇痛等作用,可用于治疗关节肿痛、肿瘤、急性细菌性痢疾等疾病[18]。其主要成分为萜类衍生物、挥发油、黄酮类、酚类和木脂素等[19]。本课题组前期研究结果发现,中亚苦蒿水提物可促进免疫反应,而醇提物可抑制炎症反应[14]。因此,本研究对中亚苦蒿醇提物的提取工艺进行优化,然后依次采用大孔吸附树脂和硅胶柱对其进一步分离纯化得到中亚苦蒿硅胶柱分离组分(A. absinthium L. separated by silica gel column,AEM-SC),并探讨AEM-SC对DC成熟及功能的影响,为筛选安全、高效的免疫抑制剂提供候选材料。
胎牛血清、RPMI-1640培养基(美国Gibco公司),鼠源粒细胞-巨噬细胞集落刺激因子(美国Peprotech公司),二甲基亚砜(dimethyl sulfoxide,DMSO)、细菌脂多糖(美国Sigma公司),瑞沙托维(TAK-242)(美国MedChemExpress公司),异硫氰酸荧光素(flourescein isothiocyanate,FITC)标记的膜联蛋白V/碘化丙啶细胞凋亡检测试剂盒(上海翊圣生物科技有限公司),藻红蛋白(phycocyanin,PE)标记的大鼠抗小鼠CD11c抗体(PE-CD11c)、别藻蓝蛋白(allophycocyanin,APC)标记的大鼠抗小鼠CD40抗体(APC-CD40)、FITC标记的大鼠抗小鼠CD40抗体(FITC-CD40)、PE标记的大鼠抗小鼠MHC-Ⅱ抗体(PE-MHC-Ⅱ)、APC标记的大鼠抗小鼠CD11c抗体(APC-CD11c)、FITC标记的大鼠抗小鼠CD86抗体(FITC-CD86)、APC标记的大鼠抗小鼠CD4抗体(APC-CD4)和PE标记的大鼠抗小鼠CD8抗体(PE-CD8)(美国BD公司),小鼠IL-10酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒、小鼠IL-6 ELISA试剂盒、小鼠IL-12p40 ELISA试剂盒、小鼠肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)ELISA试剂盒(武汉博士德生物工程有限公司)。无水乙醇、甲醇、石油醚、乙酸乙酯均为国产分析纯。中亚苦蒿购自乌鲁木齐爱丽康维吾尔医药科技有限公司,并经新疆大学生命科学与技术学院买买提明·苏来曼教授鉴定确认。
健康清洁级6~8周龄雌性BALB/c小鼠21只,体质量范围15~20 g;健康清洁级6~8周龄雌性ICR小鼠10只,体质量范围15~20 g,均购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2016-0006。实验小鼠于新疆大学标准温控和光控动物饲养室内饲养。本研究所有的动物实验均获得新疆大学动物实验伦理委员会的批准。
550酶标仪(美国Bio-Rad公司),FACSCalibur流式细胞仪(美国BD公司),Nikon Eclipse Ti-E倒置荧光显微镜(日本Nikon公司),LABOROTA 4000旋转蒸发仪(德国Heidolph公司)。
AEM-SC的制备流程见图1。将中亚苦蒿的地上部分粉碎,过40目筛,按料液比1 g∶10 ml加入体积分数为85%的乙醇溶液;充分混匀后置于60 ℃水浴锅中,恒温浸提3次,每次2 h;合并上清,旋蒸浓缩后冻干即得中亚苦蒿85%醇提物。采用蒸馏水溶解中亚苦蒿85%醇提物,使其质量浓度为60 mg/ml,经AB-8大孔树脂柱纯化,依次使用蒸馏水、30%乙醇、50%乙醇、70%乙醇、85%乙醇、无水乙醇梯度洗脱,每个梯度洗脱3个柱体积,保留70%乙醇洗脱下来的组分,旋蒸浓缩后冻干即得中亚苦蒿大孔吸附树脂70%乙醇洗脱组分(AAEM-70%)。将AAEM-70%进一步经硅胶柱层析分离,依次以石油醚∶乙酸乙酯的体积比为10∶1、8∶1、6∶1、4∶1、2∶1、1∶1、1∶2、1∶4、1∶6、1∶8、1∶10进行洗脱,收集石油醚∶乙酸乙酯体积比为1∶10时洗脱下来的组分,旋蒸浓缩后冻干即得AEM-SC。用DMSO溶解AEM-SC,配成质量浓度为100 mg/ml的母液,经0.22 μm滤器过滤,分装后于-20 ℃保存。
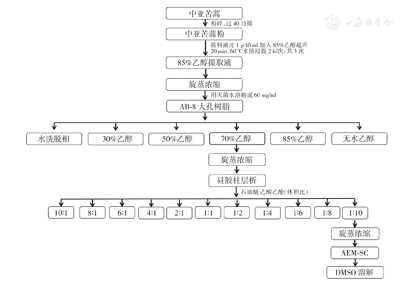

AEM-SC—中亚苦蒿硅胶柱分离组分;DMSO—二甲基亚砜
取1 ml AEM-SC母液与0.5 ml苯酚混合,再加入2.5 ml浓H2SO4,充分混匀后置于室温20 min。采用酶标仪测定上述反应液于490 nm处的吸光度值,根据多糖标准曲线求得多糖的质量浓度,并进一步换算出AEM-SC中的多糖含量。
取0.5 ml AEM-SC母液,加入30 μl质量浓度为5 g/L的NaNO2溶液,静置6 min;然后加入30 μl质量浓度为100 g/L的Al(NO3)3溶液,静置6 min;再加入0.4 ml 1 mol/L的NaOH溶液及40 μl体积分数为30%的乙醇溶液,静置15 min;采用酶标仪测定上述反应液于517 nm处的吸光度值,根据总黄酮标准曲线求得总黄酮的质量浓度,并进一步换算出AEM-SC中的总黄酮含量。
取1 ml AEM-SC母液,加入新鲜配制的质量浓度为50 g/L的香草醛-冰醋酸溶液0.6 ml,再加入1.4 ml高氯酸,置于60 ℃水浴锅中15 min;待其冷却至室温,加入5 ml冰醋酸充分混匀;采用酶标仪测定上述反应液于540 nm处的吸光度值,根据齐墩果酸标准曲线求得三萜类的质量浓度,并进一步换算出AEM-SC中的三萜类含量。
取BALB/c小鼠股骨和胫骨,用体积分数为70%的乙醇冲洗,再用磷酸盐缓冲液(phosphate buffered saline, PBS)清洗3次。将大腿骨与小腿骨分离,剪去腿骨两端,用RPMI-1640培养基反复吹打骨髓,得到单细胞悬液,260×g离心7 min,弃上清。用含有体积分数为10%胎牛血清、1%青霉素-链霉素和质量浓度为20 ng/ml粒细胞-巨噬细胞集落刺激因子的RPMI-1640完全培养基重悬细胞,接种于60 mm细胞培养平皿中,于37 ℃、5%CO2培养箱中培养。培养第2天和第5天均更换一半培养基,第3天更换全部培养基,第7天90%以上的小鼠骨髓细胞可被诱导分化为CD11c+细胞,收集细胞。分别采用不同质量浓度的AEM-SC(50、100、150 μg/ml)单独处理或将其与细菌脂多糖(80 ng/ml)联合处理DC 12 h。空白对照组不予处理,DMSO组采用DMSO处理。
AEM-SC处理DC 12 h后,收集各组细胞,260×g离心7 min,弃上清,采用含体积分数为0.5%胎牛血清的PBS洗涤细胞1次;加入APC-CD11c抗体,常温避光染色15 min;加入含体积分数为0.5%胎牛血清的PBS,260×g离心7 min,弃上清;用PBS重悬细胞,经200目铜网过滤至流式管中,采用流式细胞仪进行检测,FlowJo7.6软件处理数据。
AEM-SC处理DC 12 h后,收集各组细胞,260×g离心7 min,弃上清,采用含体积分数为0.5%胎牛血清的PBS洗涤细胞1次;一部分加入PE-CD11c、APC-CD40和FITC-CD80抗体,常温避光染色15 min;另一部分加入PE-MHC-Ⅱ、APC-CD86和PE-CD11c抗体,常温避光染色15 min;分别加入含体积分数为0.5%胎牛血清的PBS,260×g离心7 min,弃上清;用PBS重悬细胞,经200目铜网过滤后采用流式细胞仪进行检测。
AEM-SC处理DC 12 h后,加入FITC标记的葡聚糖(FITC-葡聚糖)(终质量浓度为50 μg/ml),避光孵育1 h;加入1 ml预冷的PBS,收集细胞后用含体积分数为0.5%胎牛血清的PBS进行洗涤;加入PE-CD11c抗体,常温避光染色15 min;加入5 ml PBS,260×g离心7 min,弃上清;用250 μl PBS重悬细胞,经200目铜网过滤后采用流式细胞仪进行检测。
不同质量浓度的AEM-SC单独处理或与脂多糖联合处理DC 12 h后,用倒置荧光显微镜的环状光阑PHL搭配低倍物镜×4将焦对准细胞,然后分别用环状光阑PH1搭配×10和×20物镜观察DC形态,拍照并进行记录。
AEM-SC处理DC 12 h后,收集各组DC的上清,采用对应的ELISA试剂盒检测DC上清中IL-10、IL-6、IL-12p40及TNF-α的含量,具体操作按试剂盒说明书进行,采用酶标仪检测各孔于450 nm处的吸光度值,根据标准曲线计算出对应的浓度。
AEM-SC处理DC 12 h后,加入质量浓度为10 μg/ml的丝裂霉素C处理1 h,PBS洗涤细胞后进行计数。取ICR小鼠脾脏细胞,加入活细胞荧光染料羟基荧光素二醋酸盐琥珀酰亚胺脂(CFSE),37 ℃避光染色12 h,轻轻吹下细胞后离心,弃上清,重悬细胞后计数。将DC与小鼠脾脏细胞分别按细胞数目比1∶5及1∶10铺至24孔板中,避光培养72 h;加入APC-CD4和PE-CD8抗体,室温避光染色15 min;加入含体积分数为0.5%胎牛血清的PBS,260×g离心7 min,弃上清;用PBS重悬细胞,经200目铜网过滤后采用流式细胞仪进行检测。
将21只雌性BALB/c小鼠按随机数字表法随机分为7组,分别采用不同剂量的AEM-SC(100、300 μg)单独注射或与质量浓度为100 mg/ml的脂多糖联合注射至小鼠脚掌内,空白对照组注射PBS,阴性对照组注射DMSO。24 h后颈椎脱臼法处死各组小鼠,处死前进行眼眶后静脉丛采血,将收集的血样置于37 ℃恒温箱1 h,4 ℃静置30 min,待其凝集成血块,260×g离心5 min,收集淡黄色血清,于-80 ℃保存备用。将血清稀释成不同倍数,用ELISA试剂盒检测血清中TNF-α、IL-12p40、IL-10的含量。小鼠处死后分离双腿的腿窝淋巴结,研磨制成单细胞悬液,一部分采用PE-CD11c抗体、APC-CD40抗体和FITC-CD80抗体染色15 min;另一部分采用APC-CD11c抗体、PE-MHC-Ⅱ抗体和FITC-CD86抗体染色15 min;分别加入5 ml含体积分数为0.5%胎牛血清的PBS,260×g离心7 min,弃上清;用250 μl PBS重悬细胞,经200目铜网过滤后采用流式细胞仪进行检测。
采用GraphPad Prism 5.0统计学软件处理数据,符合正态分布的计量资料采用均值±标准差(Mean±SD)表示,处理组与对照组比较采用One-way ANOVA分析,以P<0.05为差异具有统计学意义。
苯酚-硫酸法测得AEM-SC中多糖的质量浓度为10.12 mg/ml,多糖含量为10.12%;碱性法测得AEM-SC中总黄酮的质量浓度为5.70 mg/ml,总黄酮含量为5.70%;以齐墩果酸作为标准品测得AEM-SC中三萜类的质量浓度为3.62 mg/ml,三萜类含量为3.62%。
采用不同质量浓度(50、100、150 μg/ml)的AEM-SC处理DC 12 h后,加入APC-CD11c抗体避光染色,再用流式细胞术进行检测。如图2所示,以侧向角散射(SSC)-H和前向角散射(FSC)-H进行门控,再按图2B所示对该群细胞子集CD11c+细胞(DC)进行门控,分析AEM-SC对DC比例的影响。结果表明,与空白对照组相比,DMSO组和AEM-SC组的门控细胞比例均无明显变化(均P>0.05),且DC比例亦均无明显改变(均P>0.05)。由此可见,本研究所选的AEM-SC的剂量是安全的,可用于后续研究中。
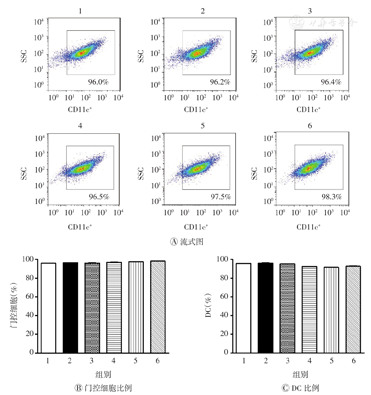

AEM-SC—中亚苦蒿硅胶柱分离组分;DC—树突状细胞;1—空白对照;2—脂多糖;3—DMSO;4—50 μg/ml AEM-SC;5—100 μg/ml AEM-SC;6—150 μg/ml AEM-SC;SSC—侧向角散射;DMSO—二甲基亚砜
DC成熟会上调CD40、CD80、CD86和MHC-Ⅱ的表达。本研究采用不同质量浓度(50、100、150 μg/ml)的AEM-SC处理DC 12 h后,利用流式细胞术及ELISA法进行检测,以验证AEM-SC对DC成熟的抑制作用。结果如图3,图4所示,与空白对照组比较,脂多糖可明显增加DC表面分子CD40、CD80、CD86、MHC-Ⅱ及其分泌的细胞因子(IL-12p40、TNF-α、IL-6、IL-10)的水平(均P<0.05),促进了DC的成熟;AEM-SC则可明显降低CD40、CD80、CD86的表达(均P<0.05),但对MHC-Ⅱ的表达无影响(均P>0.05),并可明显降低炎症因子TNF-α的水平(均P<0.05)。上述结果表明AEM-SC单独使用可抑制DC的成熟。
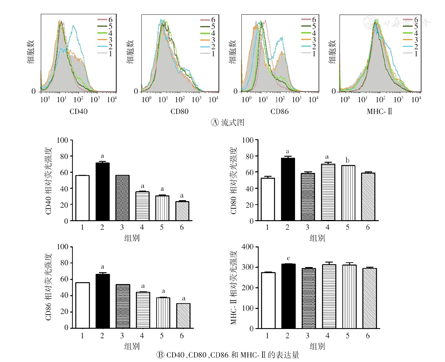

AEM-SC—中亚苦蒿硅胶柱分离组分;DC—树突状细胞;1—空白对照;2—脂多糖;3—DMSO;4—50 μg/ml AEM-SC;5—100 μg/ml AEM-SC;6—150 μg/ml AEM-SC;DMSO—二甲基亚砜;MHC-Ⅱ—主要组织相容性复合体Ⅱ类。与空白对照组比较,aP<0.001,bP<0.01,cP<0.05
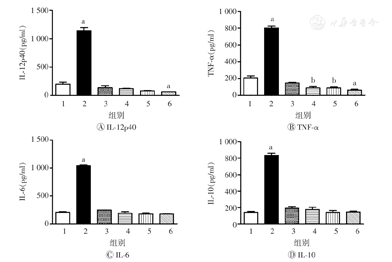

AEM-SC—中亚苦蒿硅胶柱分离组分;DC—树突状细胞;1—空白对照;2—脂多糖;3—DMSO;4—50 μg/ml AEM-SC;5—100 μg/ml AEM-SC;6—150 μg/ml AEM-SC;DMSO—二甲基亚砜;IL—白细胞介素;TNF-α—肿瘤坏死因子α。与空白对照组比较,aP<0.001,bP<0.01
脂多糖可促进DC的成熟,为进一步探讨AEM-SC能否抑制脂多糖对DC成熟的促进作用,本研究将不同质量浓度(50、100、150 μg/ml)的AEM-SC与脂多糖(80 ng/ml)联合处理DC 12 h,阳性对照采用脂多糖单独处理,然后分别利用流式细胞术及ELISA法检测DC表面分子及细胞因子的表达水平。流式细胞术检测结果如图5所示,与脂多糖组相比,AEM-SC可明显抑制脂多糖诱导的CD40、CD86和MHC-Ⅱ的表达,差异均具有统计学意义(均P<0.05)。ELISA检测结果见图6,与脂多糖组相比,AEM-SC可明显降低脂多糖诱导的DC分泌IL-12p40、TNF-α、IL-6的水平(均P<0.05),且高质量浓度的AEM-SC可明显升高脂多糖诱导的DC分泌细胞因子IL-10的水平(P<0.05)。上述结果表明AEM-SC可抑制脂多糖诱导的DC的成熟。
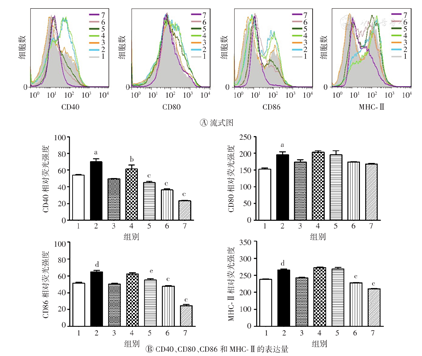

AEM-SC—中亚苦蒿硅胶柱分离组分;DC—树突状细胞;1—空白对照;2—脂多糖;3—DMSO;4—脂多糖+DMSO;5—50 μg/ml AEM-SC+脂多糖;6—100 μg/ml AEM-SC+脂多糖;7—150 μg/ml AEM-SC+脂多糖;DMSO—二甲基亚砜;MHC-Ⅱ—主要组织相容性复合体Ⅱ类。与空白对照组比较,aP<0.01;与脂多糖组比较,bP<0.05,cP<0.001;与空白对照组比较,dP<0.001;与脂多糖组比较,eP<0.01
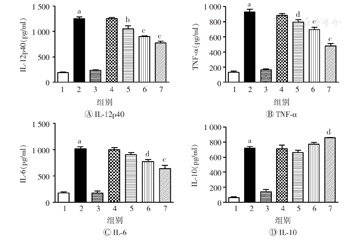

AEM-SC—中亚苦蒿硅胶柱分离组分;DC—树突状细胞;1—空白对照;2—脂多糖;3—DMSO;4—脂多糖+DMSO;5—50 μg/ml AEM-SC+脂多糖;6—100 μg/ml AEM-SC+脂多糖;7—150 μg/ml AEM-SC+脂多糖;DMSO—二甲基亚砜;IL—白细胞介素;TNF-α—肿瘤坏死因子α。与空白对照组比较,aP<0.001;与脂多糖组比较,bP<0.01,cP<0.001,dP<0.05
未成熟的DC具有较强的抗原吞噬能力,但抗原提呈能力较低。本研究采用不同质量浓度(50、100、150 μg/ml)的AEM-SC与脂多糖(80 ng/ml)联合处理DC 12 h,然后以FITC-葡聚糖(50 μg/ml)为抗原,与DC 37 ℃孵育1 h,最后采用流式细胞术检测DC内抗原的相对荧光强度。结果如图7所示,与脂多糖组相比,150 μg/ml AEM-SC+脂多糖组DC内FITC-葡聚糖的相对荧光强度增强,差异具有统计学意义(P<0.01),表明AEM-SC能抑制脂多糖诱导的DC成熟,提高其抗原吞噬能力。
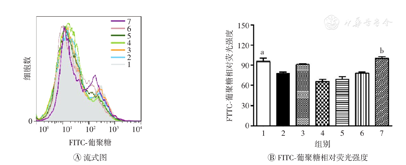

AEM-SC—中亚苦蒿硅胶柱分离组分;DC—树突状细胞;1—空白对照;2—脂多糖;3—DMSO;4—脂多糖+DMSO;5—50 μg/ml AEM-SC+脂多糖;6—100 μg/ml AEM-SC+脂多糖;7—150 μg/ml AEM-SC+脂多糖;DMSO—二甲基亚砜;FITC-葡聚糖—异硫氰酸荧光素标记的葡聚糖。与脂多糖组比较,aP<0.05,bP<0.01
AEM-SC与脂多糖联合处理DC 12 h后,采用倒置荧光显微镜观察DC的形态变化。结果如图8所示,与空白对照组比较,脂多糖组的DC突触增多;与脂多糖组比较,150 μg/ml AEM-SC+脂多糖组的DC明显变圆,突触减少,表明AEM-SC可在一定程度上抑制脂多糖对DC形态的改变。
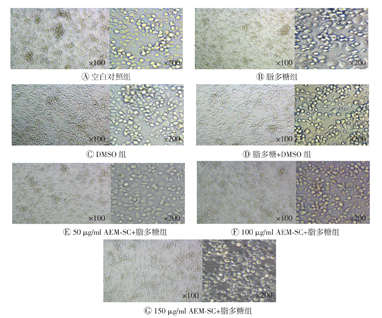

AEM-SC—中亚苦蒿硅胶柱分离组分;DC—树突状细胞;DMSO—二甲基亚砜
AEM-SC能显著抑制DC成熟及炎症细胞因子的表达水平,因此本研究又通过混合淋巴细胞反应检测AEM-SC对DC功能的影响。先采用AEM-SC处理DC 12 h,再将其与经CFSE染色的小鼠脾脏细胞共同孵育72 h,流式细胞术进行检测。如图9所示,当DC与小鼠脾脏细胞以细胞数目比1∶5混合时,脂多糖组脾脏细胞中的CD8+ T细胞比例明显高于空白对照组(P<0.01),50、100、150 μg/ml AEM-SC联合脂多糖组脾脏细胞中的CD8+ T细胞比例均低于脂多糖组(P<0.01,P<0.01,P<0.001);当DC与小鼠脾脏细胞以细胞数目比1∶10混合时,与脂多糖组相比,50、100、150 μg/ml AEM-SC联合脂多糖组脾脏细胞中的CD8+ T细胞比例均明显降低(均P<0.001),且150 μg/ml AEM-SC联合脂多糖组的CD4+ T细胞比例明显降低(均P<0.001)。上述结果表明,高质量浓度的AEM-SC与脂多糖联用时,可降低脂多糖诱导的DC促进CD4+ T与CD8+ T细胞增殖的作用。
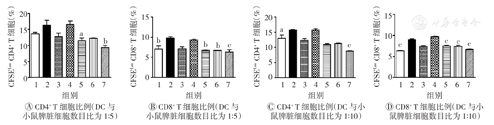

AEM-SC—中亚苦蒿硅胶柱分离组分;DC—树突状细胞;CFSE—羟基荧光素二醋酸盐琥珀酰亚胺脂;1—空白对照;2—脂多糖;3—DMSO;4—脂多糖+DMSO;5—50 μg/ml AEM-SC+脂多糖;6—100 μg/ml AEM-SC+脂多糖;7—150 μg/ml AEM-SC+脂多糖;DMSO—二甲基亚砜。与脂多糖组比较,aP<0.05,bP<0.01,cP<0.001
为进一步验证AEM-SC是否也能在体内抑制DC的成熟,本研究分别采用不同剂量的AEM-SC(100、300 μg)单独注射或与质量浓度为100 mg/ml的脂多糖联合注射至小鼠脚掌内,24 h后分离小鼠双腿的腿窝淋巴结,流式细胞术检测DC表面分子的表达。结果见图10,与脂多糖组相比,100 μg AEM-SC+脂多糖组和300 μg AEM-SC+脂多糖组DC表面分子CD40、CD80及CD86的表达均明显降低,差异均具有统计学意义(均P<0.001),表明AEM-SC在小鼠体内也可抑制脂多糖诱导的DC成熟。
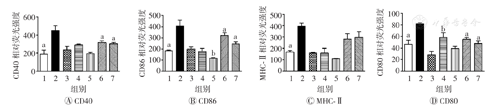

AEM-SC—中亚苦蒿硅胶柱分离组分;DC—树突状细胞;1—空白对照;2—脂多糖;3—DMSO;4—100 μg AEM-SC;5—300 μg AEM-SC;6—100 μg AEM-SC+脂多糖;7—300 μg AEM-SC+脂多糖;DMSO—二甲基亚砜;MHC-Ⅱ—主要组织相容性复合体Ⅱ类。与脂多糖组比较,aP<0.001,bP<0.05
对脚掌注射AEM-SC 24 h后的BALB/c小鼠眼球采血,收集血清后检测血清中细胞因子的分泌水平。结果见图11,与空白对照组相比,100 μg AEM-SC组和300 μg AEM-SC组血清中TNF-α、IL-12p40、IL-10的水平均无明显变化,差异均无统计学意义(均P>0.05);与脂多糖组相比,100 μg AEM-SC+脂多糖组和300 μg AEM-SC+脂多糖组血清中TNF-α、IL-12p40的水平均明显降低,差异均有统计学意义(均P<0.01)。上述结果进一步验证了AEM-SC具有抑制小鼠体内炎症的潜力。
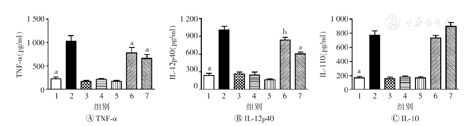

AEM-SC—中亚苦蒿硅胶柱分离组分;1—空白对照;2—脂多糖;3—DMSO;4—100 μg AEM-SC;5—300 μg AEM-SC;6—100 μg AEM-SC+脂多糖;7—300 μg AEM-SC+脂多糖;TNF-α—肿瘤坏死因子α;DMSO—二甲基亚砜;IL—白细胞介素。与脂多糖组比较,aP<0.001,bP<0.01
炎症是一个复杂的过程,其由激活的促炎性免疫细胞、细胞因子和趋化因子所介导[20,21]。在正常情况下,炎症是免疫防御的一种表现形式,可保护人体免受感染。但急性或由罕见因素介导的慢性炎症反应会导致组织损伤并导致严重疾病[22,23]。DC的成熟状态不同,能激活免疫反应的程度也不同,其成熟状态是诱导免疫耐受的关键点[24]。
多项研究结果表明,中草药的临床作用与免疫反应的上调或下调有关,特别是与DC成熟的调节有关[25,26]。本研究对中亚苦蒿醇提物进一步分离纯化获得了AEM-SC,并研究其对DC成熟的作用。体外功能实验结果显示,AEM-SC能抑制DC的成熟,显著降低脂多糖诱导的CD40、CD80、CD86的表达及IL-12p40、IL-6、TNF-α的分泌水平,并可增加IL-10的表达,提高DC的抗原吞噬能力,降低DC刺激脾脏细胞增殖的能力。小鼠体内模型实验结果显示,AEM-SC与脂多糖共同处理DC后,CD40、CD80、MHC-Ⅱ、IL-12p40及TNF-α的表达均降低。文献报道,丹参酮[27]、乙酰紫堇醇灵碱[28]和刺山柑果实乙醇提取物[11]等均能降低脂多糖对DC成熟的促进作用。一些中草药及其成分可用于治疗炎症、自身免疫性疾病等。
综上所述,AEM-SC能抑制脂多糖诱导的DC成熟及炎症细胞因子表达,这与文献[14]的研究结果一致。本研究结果表明AEM-SC具有潜在的免疫抑制作用,有望进一步开发成免疫抑制剂。但其功效成分的具体作用机制仍需进一步阐明,其功效成分之间是否均具有协同作用及具体协同作用机制仍待进一步验证。
所有作者均声明不存在利益冲突



























