
探讨p16/Ki-67免疫细胞化学双染(p16/Ki-67双染)技术在液基薄层细胞学检查(TCT)结果异常人群中的检测能力,并评价其对宫颈上皮内瘤变Ⅱ级及以上病变(CIN2+)的诊断效果。
收集2018年12月至2019年12月在天津市中心妇产科医院南开大学附属妇产医院就诊的TCT结果异常[≥非典型鳞状细胞,意义不明确(ASC-US)]的225例妇女为研究对象,进行p16/Ki-67双染检测,并与高危型人乳头瘤病毒(HR-HPV)检测及组织病理学结果比较。
p16/Ki-67双染阳性率随着TCT和组织病理学结果严重程度的加重而升高。对于检出CIN2+病变,p16/Ki-67双染的灵敏度(90.1%)略低于HR-HPV检测(98.2%)(P<0.05),但其特异度(58.8%)明显高于HR-HPV检测(21.6%)(P<0.001)。
与HR-HPV检测相比,p16/Ki-67双染对于检出CIN2+病变具有更佳的诊断效果。p16/Ki-67双染可对ASC-US及低级别鳞状上皮内病变(LSIL)患者进行更有效的分流管理,明显降低阴道镜转诊率(近50%),具有较高的临床应用价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
尽管现行的宫颈癌筛查手段越来越快速有效,人乳头瘤病毒(human papilloma virus, HPV)疫苗也已问世,但宫颈癌的发病率和病死率仍呈上升趋势。全球宫颈癌的发病率和病死率占女性恶性肿瘤第4位,每年全球新发病例约57万例,死亡病例约31万例[1]。在中国,这些数据同样一直呈上升态势。2015年,我国宫颈癌新发病例为11.1万例,死亡病例为3.4万例[2]。
目前,我国宫颈癌的筛查方法主要包括:宫颈细胞学筛查、高危型人乳头瘤病毒(high risk human papillomavirus, HR-HPV)检测、宫颈细胞学联合HR-HPV筛查。细胞学筛查历史悠久,在人类宫颈癌的预防史中发挥了重要作用,但其灵敏度低(仅为50%~ 70%)、重复性差[3],一些不确定阳性诊断如非典型鳞状细胞,意义不明确(atypical squamous cells of undetermined significance,ASC-US)的诊断重复性甚至低于50%[4,5]。HR-HPV检测已被广泛应用于宫颈癌的初筛及分流检测,可有效降低宫颈上皮内瘤变(cervical intraepithelial neoplasia, CIN)Ⅱ级及以上病变(CIN2+)的漏诊率。但遗憾的是目前的HR-HPV检测方法尚无法区分HPV感染是一过性还是持续性感染,其特异度较低,阳性预测值不满意,导致阴道镜转诊率增加。目前认为联合筛查是最佳的筛查方案[6],对30岁的女性应用联合筛查方案,不但可提高检出率,减少阴道镜转诊率,还可将筛查的间隔时间延长为3年。但联合筛查价格昂贵,难以在我国广大的经济及医疗水平欠发达地区有效开展。
随着对HPV相关宫颈癌分子发病机制的深入了解,研究者发现检测相关的生物标志物可用来弥补传统筛查方式的不足,提高宫颈癌及癌前病变的筛查效率。有大数据前瞻性研究结果显示,p16/Ki-67免疫细胞化学双染(p16/Ki-67双染)检测CIN2+的灵敏度与HR-HPV检测相似,但特异度高于HR-HPV检测[7,8]。
为了分析p16/Ki-67双染的具体应用价值,本研究回顾性分析了天津市中心妇产科医院南开大学附属妇产医院的225例液基薄层细胞学检查(thinprep cytologic test, TCT)结果异常(≥ASC-US)妇女的临床病理资料,对残余标本进行p16/Ki-67双染,并与HR-HPV检测及组织病理学结果比较,探讨p16/Ki-67双染在细胞学结果异常人群中的检测效果及其对CIN2+病变的诊断价值。
选取2018年12月至2019年12月在天津市中心妇产科医院南开大学附属妇产医院就诊的TCT结果为≥ASC-US的患者225例,年龄范围20~72岁,年龄(39.4±9.7)岁。纳入标准:①在天津市中心妇产科医院南开大学附属妇产医院同时行HR-HPV检测。②均有活检组织病理结果。③患者及家属知情同意。排除标准:①处于妊娠期及哺乳期。②有宫颈物理和手术治疗史。本研究符合2013年修订的《赫尔辛基宣言》的要求。
p16/Ki-67检测试剂盒(福州迈新生物技术开发有限公司),ThinPrep 2000液基薄层细胞学制片机(美国Hologic公司),Cobas® 4800 HPV检测系统(瑞士Roche公司)。
将TCT残余的细胞学标本程序化制片后置于体积分数为95%的乙醇溶液中固定30 min,然后进行抗原修复并阻断内源性过氧化物酶活性。采用p16/Ki-67检测试剂盒双染,具体操作按试剂盒说明书进行。将宫颈细胞薄片依次与一抗、二抗孵育,再用二氨基联苯胺显色及苏木精对比染色,封片后于显微镜下判读。双染结果由天津市中心妇产科医院南开大学附属妇产医院细胞学医师评估,医师在判读时不知晓患者的TCT和HR-HPV检测结果。镜下见≥1个细胞的胞质染为红色(Ki-67),同时这些细胞位于同一显微层面的胞核染为红褐色或棕黄色(p16)判读为阳性。225例标本中有12例标本因细胞量不足无法进行p16/Ki-67诊断而被排除,最终有效标本数为213例。
采用Cobas® 4800 HPV检测系统对宫颈细胞进行HR-HPV DNA检测,具体操作参见文献[9]。检测结果中HPV16、HPV18及其他12种HR-HPV类型中任意一种感染即为阳性。
所有纳入此研究病例的细胞学及组织病理学结果均由天津市中心妇产科医院南开大学附属妇产医院病理科经验丰富的医师评估。TCT结果依据2015年Bethesda分类系统进行报告,其中鳞状细胞类病变包括ASC-US、低级别鳞状上皮内病变(low-grade squamous intraepithelial lesions,LSIL)、LSIL+非典型鳞状细胞,不除外高级别鳞状上皮内病变(atypical squamous cells cannot except high-grade squamous intraepithelial lesion, ASC-H)、ASC-H、高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion, HSIL)、鳞状细胞癌(squamous cell carcinoma, SCC),将诊断结果中≥ASC-US界定为细胞学阳性。组织病理学诊断标准参照2014年世界卫生组织女性生殖器官肿瘤分类标准,分为:正常或炎症反应、CINⅠ~Ⅲ级、阴道上皮内瘤变(vaginal intraepithelial neoplasia, VaIN)Ⅱ~Ⅲ级、原位腺癌(adenocarcinoma in situ,AIS)、SCC。
采用SPSS20.0统计学软件处理数据,计数资料以百分比或构成比描述,组间差异性比较采用χ2检验或Fisher确切概率法,组内比较采用McNemar检验,以P<0.05为差异具有统计学意义。
由表1可知,随着TCT诊断级别的上升,p16/Ki-67双染的阳性率呈上升趋势;p16/Ki-67在TCT诊断为ASC-US、LSIL、LSIL+ASC-H、ASC-H、HSIL、SCC患者中的阳性率分别为52.3%、40.0%、52.9%、60.7%、86.1%、100.0%。而HR-HPV检测在各个级别的异常TCT诊断中的阳性率均很高,达81.8%~100.0%。
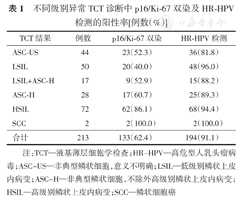
不同级别异常TCT诊断中p16/Ki-67双染及HR-HPV检测的阳性率[例数(%)]
不同级别异常TCT诊断中p16/Ki-67双染及HR-HPV检测的阳性率[例数(%)]
| TCT结果 | 例数 | p16/Ki-67双染 | HR-HPV检测 |
|---|---|---|---|
| ASC-US | 44 | 23(52.3) | 36(81.8) |
| LSIL | 50 | 20(40.0) | 48(96.0) |
| LSIL+ASC-H | 17 | 9(52.9) | 15(88.2) |
| ASC-H | 28 | 17(60.7) | 25(89.3) |
| HSIL | 72 | 62(86.1) | 68(94.4) |
| SCC | 2 | 2(100.0) | 2(100.0) |
| 合计 | 213 | 133(62.4) | 194(91.1) |
注:TCT—液基薄层细胞学检查;HR-HPV—高危型人乳头瘤病毒;ASC-US—非典型鳞状细胞,意义不明确;LSIL—低级别鳞状上皮内病变;ASC-H—非典型鳞状细胞,不除外高级别鳞状上皮内病变;HSIL—高级别鳞状上皮内病变;SCC—鳞状细胞癌
由表2可知,p16/Ki-67双染阳性率随着宫颈组织病理学病变程度的加重而呈升高趋势;p16/Ki-67双染在组织病理学诊断为正常或炎症反应患者中的阳性率为33.8%,在CINⅠ、CINⅡ、CINⅢ患者中的阳性率分别为54.1%、87.1%、89.7%,在SCC患者中的阳性率为94.1%,在VaINⅡ~Ⅲ和AIS患者中的阳性率均为100.0%。而HR-HPV检测在各类异常组织病理学诊断中的阳性率均很高(94.1%~100.0%),其在正常或炎症反应患者中的阳性率也高达69.2%。
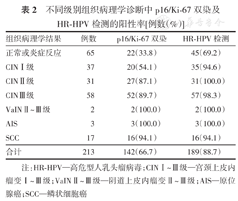
不同级别组织病理学诊断中p16/Ki-67双染及HR-HPV检测的阳性率[例数(%)]
不同级别组织病理学诊断中p16/Ki-67双染及HR-HPV检测的阳性率[例数(%)]
| 组织病理学结果 | 例数 | p16/Ki-67双染 | HR-HPV检测 |
|---|---|---|---|
| 正常或炎症反应 | 65 | 22(33.8) | 45(69.2) |
| CINⅠ级 | 37 | 20(54.1) | 35(94.6) |
| CINⅡ级 | 31 | 27(87.1) | 31(100.0) |
| CINⅢ级 | 58 | 52(89.7) | 57(98.3) |
| VaINⅡ~Ⅲ级 | 2 | 2(100.0) | 2(100.0) |
| AIS | 3 | 3(100.0) | 3(100.0) |
| SCC | 17 | 16(94.1) | 16(94.1) |
| 合计 | 213 | 142(66.7) | 189(88.7) |
注:HR-HPV—高危型人乳头瘤病毒;CINⅠ~Ⅲ级—宫颈上皮内瘤变Ⅰ~Ⅲ级;VaINⅡ~Ⅲ级—阴道上皮内瘤变Ⅱ~Ⅲ级;AIS—原位腺癌;SCC—鳞状细胞癌
分别以组织病理学诊断CIN2+与CIN Ⅲ级及以上病变(CIN3+)作为筛查终点,评价p16/Ki-67双染和HR-HPV检测这两种方法的诊断能力。McNemar检验结果显示,p16/Ki-67双染诊断CIN2+的灵敏度略低于HR-HPV检测(P<0.05),但特异度明显高于HR-HPV检测(P<0.001)(表3)。进一步使用受试者工作特征曲线分析中的约登指数综合评估上述两种检测方法对CIN2+的检出能力,结果显示p16/Ki-67双染和HR-HPV检测的约登指数分别为0.489和0.198,表明综合评估p16/Ki-67双染对CIN2+的检出能力要优于HR-HPV检测。此外,p16/Ki-67双染诊断CIN3+的灵敏度与HR-HPV检测相当(P>0.05),但特异度明显高于HR-HPV检测(P<0.001)(表3)。

p16/Ki-67双染和HR-HPV检测对CIN2+和CIN3+检出能力的比较(%)
p16/Ki-67双染和HR-HPV检测对CIN2+和CIN3+检出能力的比较(%)
| 检测方法 | 灵敏度 | 特异度 | 阳性预测值 | 阴性预测值 | |
|---|---|---|---|---|---|
| CIN2+ | |||||
| p16/Ki-67双染 | 90.1 | 58.8 | 70.4 | 84.5 | |
| HR-HPV检测 | 98.2 | 21.6 | 57.7 | 91.7 | |
| χ2值 | 5.818 | 26.740 | |||
| P值 | 0.012 | <0.001 | |||
| CIN3+ | |||||
| p16/Ki-67双染 | 91.3 | 48.1 | 51.4 | 90.1 | |
| HR-HPV检测 | 97.5 | 16.5 | 41.3 | 91.7 | |
| χ2值 | 1.778 | 36.750 | |||
| P值 | 0.180 | <0.001 | |||
注:HR-HPV—高危型人乳头瘤病毒;CIN2+—宫颈上皮内瘤变Ⅱ级及以上病变;CIN3+—宫颈上皮内瘤变Ⅲ级及以上病变
McNemar检验结果显示,44例ASC-US患者中p16/Ki-67双染检出CIN2+的灵敏度与HR-HPV检测相比,差异无统计学意义(P>0.05),但p16/Ki-67双染的特异度高于HR-HPV检测(P<0.001);50例LSIL患者中p16/Ki-67双染检出CIN2+的灵敏度略低于HR-HPV检测,差异具有统计学意义(P<0.05),但p16/Ki-67双染的特异度明显高于HR-HPV检测(P<0.001)(表4)。

p16/Ki-67双染和HR-HPV检测在ASC-US及LSIL患者中对CIN2+检出能力的比较(%)
p16/Ki-67双染和HR-HPV检测在ASC-US及LSIL患者中对CIN2+检出能力的比较(%)
| 检测方法 | 灵敏度 | 特异度 | 阳性预测值 | 阴性预测值 | |
|---|---|---|---|---|---|
| ASC-US(CIN2+) | |||||
| p16/Ki-67双染 | 84.6 | 61.3 | 47.8 | 90.5 | |
| HR-HPV检测 | 91.7 | 21.9 | 30.6 | 87.5 | |
| χ2值 | 0.500 | 9.600 | |||
| P值 | 1.000 | <0.001 | |||
| LSIL(CIN2+) | |||||
| p16/Ki-67双染 | 81.8 | 71.8 | 45.0 | 93.3 | |
| HR-HPV检测 | 94.1 | 3.0 | 33.3 | 50.0 | |
| χ2值 | 4.000 | 19.050 | |||
| P值 | 0.039 | <0.001 | |||
注:HR-HPV—高危型人乳头瘤病毒;ASC-US—非典型鳞状细胞,意义不明确;LSIL—低级别鳞状上皮内病变;CIN2+—宫颈上皮内瘤变Ⅱ级及以上病变
目前,宫颈癌筛查方式中的宫颈细胞学筛查及HR-HPV检测均存在局限性[10],两者联合筛查虽可避免各自的局限性,但因价格昂贵难以在欠发达和贫困地区开展。因此亟需从宫颈癌前病变和宫颈癌的生物学标志物入手[11,12],探究更为简单、经济有效的筛查和协助分流管理的方法。
p16/Ki-67双染的基本原理如下:在真核细胞中,细胞周期的调节节点主要位于G1-S期和G2-M期。G1-S期的调节主要通过细胞周期蛋白D1(cyclin D1)-周期蛋白依赖性激酶4/6(cyclin-dependent kinases 4/6,CDK4/6)-pRb-E2F和p14-MDM2-p53这两条途径来完成。p16通过前一条途径发挥抑制细胞周期的作用。正常情况下,cyclin D1与CDK4/6在G1期结合激活,激活后的cyclin D1-CDK4/6复合物使pRb-E2F复合体中的pRb发生磷酸化,从而失去对转录因子E2F的抑制能力进而促使细胞进入S期。p16在cyclin D1-CDK4/6-pRb-E2F途径中担负着负反馈调节作用,其通过抑制CDK4/6的活性,使未发生磷酸化的pRb增多而抑制细胞增殖。90%以上的宫颈癌归因于持续性HR-HPV感染,其导致HR-HPV致癌基因产生E6、E7蛋白,E6、E7蛋白与pRb蛋白结合后使得p16失去了负反馈调节作用而在细胞核及细胞质中过表达。因此,目前p16免疫组织化学染色被广泛应用于宫颈癌前病变的辅助诊断中。而Ki-67是一种反应细胞增殖活性的增殖细胞核抗原,因此p16与Ki-67不可能同时在一个正常细胞中表达。若在同一个细胞中同时检测到这两种抗原,说明该细胞的细胞周期失去了调控,发生癌变的机率大大增加[13,14]。
本研究中p16/Ki-67双染对研究对象CIN2+检出的灵敏度、特异度、阳性预测值及阴性预测值与国内[15]和国际上的多个研究报道的结果相近。在一篇包含20项研究的回顾性分析中,研究者统计了p16/Ki-67双染检测CIN2+的灵敏度、特异度、阳性预测值和阴性预测值范围分别为50.0%~100.0%、39.0%~90.4%、11.1%~92.3%和86.7%~100.0%[11]。不同研究中观察到p16/Ki-67双染的诊断性能存在明显差别,分析其差异是由年龄、种族、细胞学检测方法及宫颈病变类型等人群背景的差异所致。但鉴于这些研究所观察到受试者工作特征曲线下面积较大以及阴性预测值较高,p16/Ki-67双染检测CIN2+的能力仍是值得肯定的[11]。只是在如何应用才能使其发挥最佳诊断能力方面,还需结合具体应用情况来分析决定。从表1中不难发现,研究对象中各类TCT结果异常患者的HR-HPV阳性率均很高(≥81.8%),而p16/Ki-67双染具有较高的特异度和阴性预测值,故与HR-HPV检测相比p16/Ki-67双染对于检出CIN2+及CIN3+病变具有更佳的诊断效果。
另外本研究中包含了一部分TCT结果诊断为ASC-US和LSIL的轻度异常病例。尽管ASC-US和LSIL 5年发生CIN3+的风险分别仅为2.6%和5.2%[16],但随着筛查能力的提升,希望能将ASC-US中遗漏的和LISL中潜在患有HSIL的这部分高危人群筛选出来。本研究中p16/Ki-67双染在ASC-US和LSIL患者中的阳性率分别为52.3%和40.0%,而HR-HPV检测在这两类患者中的阳性率分别为81.8%和96.0%。与HR-HPV检测相比,p16/Ki-67双染对于检出ASC-US和LSIL患者中CIN2+病变具有相当的灵敏度和更高的特异度,因此通过p16/Ki-67双染对这两类轻微病变患者进行分流可大幅降低阴道镜转诊率。但因本研究涵盖的病例数量有限,结果可能具有局限性,在今后的工作中尚需扩大样本量进一步验证p16/Ki-67双染在ASC-US和LSIL患者分流管理中的应用价值。
总之,p16/Ki-67双染结果判读简单、客观,相关人员只需进行简单的培训即可掌握。p16/Ki-67双染用于TCT结果异常人群的分流具有优于HR-HPV检测的特异度以及与HR-HPV检测相近的灵敏度特性。p16/Ki-67双染检测可更有效地对ASC-US及LSIL患者进行分流管理,大幅降低阴道镜转诊率,具有较高的临床应用价值。
所有作者均声明不存在利益冲突



























