
研究高血脂人群的微小RNA-33a(microRNA-33a,miRNA-33a或miR-33a)和miR-33b的表达情况,探讨其与血脂指标的相关性。
纳入30例高血脂症患者为观察组,另纳入30位健康者为对照组。抽取观察组与对照组受试者的静脉血,采用全自动生化仪检测血清生化指标,包括:低密度脂蛋白胆固醇(LDL-C)、甘油三酯(TG)、血糖(GLU)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、载脂蛋白A1(ApoA1)和载脂蛋白B(ApoB)。采用实时定量聚合酶链式反应(qPCR)检测所有受试者的血清miR-33a和miR-33b表达量。
观察组血清LDL-C、TG、TC明显高于对照组,HDL-C明显低于对照组,差异有统计学意义(均P<0.05)。观察组miR-33a和miR-33b的相对表达量明显高于对照组(均P<0.05)。miR-33a和miR-33b的表达量与LDL-C、TG、TC、ApoB水平正相关,与HDL负相关(均P<0.05)。miR-33a和miR-33b的表达量的影响因素均为TG、TC和LDL-C。
miR-33在高血脂人群中表达量升高,且与LDL-C、TG、TC、ApoB有一定的相关性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
高血脂症是血液脂质代谢异常性疾病,与心血管疾病的发生发展密切相关,也会引起急性胰腺炎和脂肪肝等疾病。临床上通常将高脂血症分为高总胆固醇(total cholesterol,TC)血症、甘油三酯(triglyceride,TG)血症、混合型高脂血症、低高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)血症4个类型[1]。其中,混合型合并低HDL-C型最多见,其次为混合型[2]。生物信息学及试验研究结果表明,多种人类蛋白编码基因的表达受微小RNA(microRNA,miRNA或miR)的调控,同一种miRNA可能同时抑制多个目标基因或作用于多个mRNA。有研究结果表明,生物的发育、形成、代谢与凋亡等生命过程与miRNA的调控作用密切相关。其中,脂代谢的调控机理是一个多因素、多基因、多步骤的复杂过程。近年来研究者发现,miRNA在脂代谢中起重要作用,其对胆固醇、低密度脂蛋白受体、脂肪酸等代谢进行调控[3,4]。其中,miR-33是脂质代谢调控的重要元件,有2个具有相似功能的亚型:miR-33a和miR-33b。研究者发现,miR-33a在HDL的生物合成和胆固醇外排等代谢方面发挥重要作用[5,6],且对脂质代谢相关基因表达具有调控作用[7,8]。本研究中,研究高血脂人群中miR-33a和miR-33b的表达情况,探讨其与血脂指标的相关性。
选取北京市顺义区医院于2018年12月至2019年6月收治的高血脂症患者30例,年龄(62.4±12.1)岁。高脂血症诊断标准为《中国成人血脂异常防治指南》[9],患者生化指标满足下列纳入标准中的任意一项或多项即为高脂血症。纳入标准:空腹血清总胆固醇(TC)≥5.18 mmol/L、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)≥3.37 mmol/L、甘油三酯(TG)≥1.70以及高密度脂蛋白胆固醇(HDL-C)<1.04 mmol/L。排除标准:合并糖尿病、高血压病、冠心病以及严重肝肾功能异常性疾病,各种肿瘤疾病,自身免疫及血液病,吸烟者,酗酒者。
30例纳入的高血脂症患者入观察组,另选取30位健康体检者(60.8岁±11.2岁)入对照组。
miR-33a引物序列、miR-33b引物序列、U6 snRNA引物序列[生工生物工程(上海)股份有限公司]。IQ5型聚合酶链式反应(polymerase chain reaction,PCR)分析仪(美国Bio-Rad公司),7180型全自动生化仪(日本日立公司)。
于清晨抽取患者空腹静脉血。血样在3000 r/min条件下离心10 min,取血清。采用全自动生化仪检测血清生化指标;采用甘油磷酸氧化酶-过氧化物酶法检测TG;采用选择性可溶化法检测LDL-C;采用葡萄糖氧化酶法检测血糖(glucose,GLU);采用免疫浊度法检测载脂蛋白A1(apolipoprotein A1,ApoA1)和载脂蛋白B(ApoB)。
采用茎环引物反转录合成第一链cDNA,利用PCR分析仪定量检测血清中miR-33a和miR-33b的表达情况,所用引物序列见表1。以U6 snRNA作为标准化对照,采用比较CT(cycle-threshold)值法对样品扩增进行计算,再分别计算miR-33a和miR-33b的相对表达量,计算公式如下:
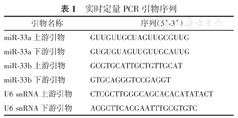
实时定量PCR引物序列
实时定量PCR引物序列
| 引物名称 | 序列(5’-3’) |
|---|---|
| miR-33a上游引物 | GUUGUUGCUAGUUGCGUUG |
| miR-33a下游引物 | GUGUGUAGUUGUUGCAUUG |
| miR-33b上游引物 | GCGTGCATTGCTGTTGCAT |
| miR-33b下游引物 | GTGCAGGGTCCGAGGT |
| U6 snRNA上游引物 | CTCGCTTGGGCAGCACACATATACT |
| U6 snRNA下游引物 | ACGCTTCACGAATTTGCGTGTC |
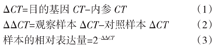
采用SPSS21.0软件对数据进行统计学分析。对数据进行方差齐性和正态分布检验。计量资料数据以均值±标准差(Mean±SD)表示,组间比较采用t检验,计数资料比较采用卡方(χ2)检验,相关性分析采用Pearson检验。以P<0.05为差异有统计学意义。
两组患者的临床资料见表2。结果表明,两组患者的性别、年龄、体质量指数(body mass index,BMI)、血糖、血清ApoA1及ApoB水平的差异均无统计学意义(均P>0.05);观察组患者的血清LDL-C、TG、TC水平明显高于对照组,而HDL-C水平明显低于对照组,差异均有统计学意义(均P<0.05)。
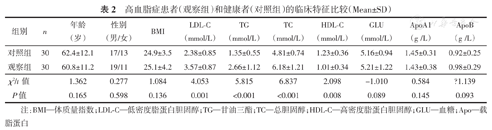
高血脂症患者(观察组)和健康者(对照组)的临床特征比较(Mean±SD)
高血脂症患者(观察组)和健康者(对照组)的临床特征比较(Mean±SD)
| 组别 | n | 年龄(岁) | 性别(男/女) | BMI | LDL-C(mmol/L) | TG(mmol/L) | TC(mmol/L) | HDL-C(mmol/L) | GLU(mmol/L) | ApoA1(g /L) | ApoB(g /L) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 对照组 | 30 | 62.4±12.1 | 17/13 | 24.9±3.5 | 2.38±0.85 | 1.35±0.55 | 4.81±0.74 | 1.23±0.36 | 5.16±0.94 | 1.45±0.31 | 0.92±0.25 |
| 观察组 | 30 | 60.8±11.2 | 19/11 | 25.1±4.2 | 3.57±0.87 | 2.66±1.12 | 6.18±1.21 | 1.01±0.34 | 5.21±1.22 | 1.43±0.38 | 0.98±0.29 |
| χ2/t值 | 1.362 | 0.277 | 1.084 | 4.053 | 5.815 | 6.837 | 2.098 | -1.010 | 0.584 | ?1.139 | |
| P值 | 0.165 | 0.598 | 0.136 | 0.001 | <0.001 | <0.001 | 0.008 | 0.089 | 0.145 | 0.093 |
注:BMI—体质量指数;LDL-C—低密度脂蛋白胆固醇;TG—甘油三酯;TC—总胆固醇;HDL-C—高密度脂蛋白胆固醇;GLU—血糖;Apo—载脂蛋白
结果显示,高血脂症患者(观察组)血清中miR-33a和miR-33b的相对表达量均高于健康者(对照组)(均P<0.05),且分别升高4.03±0.68倍和3.08±0.51倍。(图1)


与对照组比较,aP<0.05
分析高血脂者(观察组)血清中miR-33a和miR-33b的表达水平与其临床特征指标的相关性。结果表明,miR-33a和miR-33b表达水平与LDL-C、TG、TC、ApoB正相关,与HDL负相关,见表3。进一步分别以miR-33a和miR-33b的相对表达量为因变量并以临床特征指标为自变量,进行多元回归分析。结果显示,miR-33a和miR-33b的相对表达量的影响因素均为TG、TC和LDL-C,见表4。
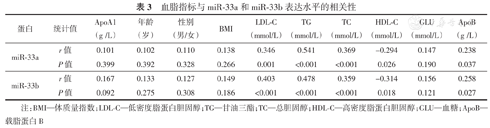
血脂指标与miR-33a和miR-33b表达水平的相关性
血脂指标与miR-33a和miR-33b表达水平的相关性
| 蛋白 | 统计值 | ApoA1(g /L) | 年龄(岁) | 性别(男/女) | BMI | LDL-C(mmol/L) | TG(mmol/L) | TC(mmol/L) | HDL-C(mmol/L) | GLU(mmol/L) | ApoB(g /L) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| miR-33a | r值 | 0.101 | 0.102 | 0.110 | 0.138 | 0.346 | 0.541 | 0.369 | -0.294 | 0.147 | 0.238 |
| P值 | 0.399 | 0.392 | 0.328 | 0.266 | 0.001 | <0.001 | <0.001 | 0.026 | 0.190 | 0.037 | |
| miR-33b | r值 | 0.167 | 0.133 | 0.127 | 0.149 | 0.403 | 0.478 | 0.359 | -0.314 | 0.156 | 0.258 |
| P值 | 0.092 | 0.275 | 0.308 | 0.186 | <0.001 | <0.001 | <0.001 | 0.018 | 0.121 | 0.027 |
注:BMI—体质量指数;LDL-C—低密度脂蛋白胆固醇;TG—甘油三酯;TC—总胆固醇;HDL-C—高密度脂蛋白胆固醇;GLU—血糖;ApoB—载脂蛋白B
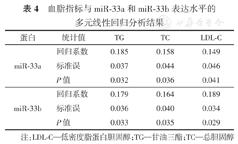
血脂指标与miR-33a和miR-33b表达水平的多元线性回归分析结果
血脂指标与miR-33a和miR-33b表达水平的多元线性回归分析结果
| 蛋白 | 统计值 | TG | TC | LDL-C |
|---|---|---|---|---|
| 回归系数 | 0.185 | 0.158 | 0.149 | |
| miR-33a | 标准误 | 0.037 | 0.044 | 0.046 |
| P值 | 0.032 | 0.036 | 0.041 | |
| 回归系数 | 0.179 | 0.164 | 0.189 | |
| miR-33b | 标准误 | 0.036 | 0.040 | 0.034 |
| P值 | 0.033 | 0.035 | 0.029 |
注:LDL-C—低密度脂蛋白胆固醇;TG—甘油三酯;TC—总胆固醇
心脑血管类疾病以及胰腺炎等多种常见病与血脂代谢异常有密切关系。不良的饮食习惯和饮食结构、脂代谢相关的基因出现缺陷或突变是原发性高脂血症的主要病理基础,脂代谢相关的基因包括ApoB基因、LDL-R基因、脂蛋白脂肪酶(lipoprteinlipase,LPL)基因、ATP结合盒转运体A1(ATP-binding cassette transporter A1,ABCA1)基因等。继发性高血脂症的诱因包括代谢紊乱性疾病,常伴有糖尿病、甲功低下、高血压、肥胖症、肝病等[10]。
microRNA是一类在进化上高度保守的单链成熟非编码RNA,在人类及其他动物体内的巨噬细胞、肝细胞、内壁细胞中表达,在保持生理内稳态和疾病发生过程中起到重要的调节作用。随着对microRNA研究的深入,研究者发现microRNA参与调控脂质代谢,有调控血脂的动态平衡基因的作用。miR-122、miR-370、miR-27a/b、miR-302a、miR-33等多个microRNA主要通过相应的靶基因上调或下调对转录调控血脂的代谢,包括转录调控低密度脂蛋白受体、脂肪酸、胆固醇的合成途径,参与脂肪酸线粒体的氧化,催化甘油三酯类合成。其中,miR-33在胆固醇逆向转运方面起重要作用。研究结果表明,miR-33a和miR-33b通过抑制ABCA1 mRNA以及蛋白的表达,实现调节胆固醇逆转运[5]。有研究者通过miR-33模拟物实现miR-33的表达增强,发现细胞中ABCA1 mRNA和蛋白的表达受明显抑制,进而降低流向ApoA1的胆固醇量;而内源性的miR-33在受抑制后,ABCA1蛋白表达增强,增大流向ApoA1的胆固醇量。黄芪甲苷抗动脉粥样硬化的作用机制主要是通过调控miR-33a,对下游信号ABCA1的表达起到调控作用,进而导致胆固醇从巨噬细胞内流出,从而达到抗动脉粥样硬化的作用[11,12]。通过研究巨噬细胞和其他造血细胞中miR-33的丢失或miR-33b的添加如何影响动脉粥样硬化的发生,发现巨噬细胞特异性miR-33丢失可减少高脂血症条件下的脂质积聚和炎症,从而减少斑块负担[13]。还有研究者发现抑制miR-33a和miR-33b是一种可靠的提升HDL,降低极低密度脂蛋白(very LDL,VLDL)的治疗手段,可用于心血管病相关的血脂异常靶向治疗[8]。
miR-33与HDL的水平也存在相关性。针对非洲绿猴的研究结果表明,以miR-33a和miR-33b为靶点的抗miRNA寡核苷酸的全身递送增强了ABCA1的肝脏表达,并在12周内诱导血浆HDL水平持续升高[14]。在小鼠和人细胞中,miR-33通过调控ABCA1的表达,减少胆固醇向ApoA1的流出。在小鼠巨噬细胞中,miR-33也以ABCG1为靶点,减少胆固醇向新生HDL的流出。针对小鼠肝脏的研究结果表明,慢病毒介导miR-33抑制下游ABCA1的表达可使循环HDL水平明显降低;而体内miR-33的沉默增强了肝脏ABCA1的表达和血浆HDL水平。上述研究结果提示miR-33可调节肝脏中HDL的生成和细胞胆固醇的流出[5]。
miR-33不仅与HDL密切相关,与LDL水平也存在一定相关性。脂代谢相关基因低密度脂蛋白受体(LDL-R)参与脂蛋白的转运和代谢。有研究结果表明,miR-33a和miR-33b在28例高胆固醇血症儿童血浆中的表达明显高于25例健康儿童,且miR-33a和miR-33b的表达量与TC、LDL-C、LDL-C、HDL-C、ApoB的水平正相关[15]。针对鸡肝脏的研究结果表明,miR-33可能通过负调节CROT和HADHB基因的表达,在鸡肝脂质代谢中发挥重要作用,其中CROT和HADHB基因是编码脂质氧化的关键酶[16]。此外,SREBP-2在他汀类药物治疗的高胆固醇血症患者中的临床重要性被揭示,即他汀类药物通过增加SREBP-2及其靶点LDL受体的肝脏表达来降低LDL-C水平。在高脂饮食喂养的小鼠中,通过miR-MSN的miR-33干预显著降低了18.9%的血清TG水平,并降低了肝脏的脂肪变性[17,18]。
本研究中,研究了高血脂人群血清miR-33a和miR-33b的表达情况,发现miR-33a和miR-33b在高血脂患者血清中的表达明显高于健康者。发现miR-33a和miR-33b的表达量与血清LDL-C、TG、TC、ApoB水平正相关,与HDL负相关,该结果与相关研究结果相似[15]。多元线性回归分析结果表明,miR-33a和miR-33b的表达量的影响因素均为TG、TC和LDL-C。上述结果提示,miR-33在高血脂人群中异常表达,其机制可能是miR-33通过靶向参与维持胆固醇、脂肪酸、脂蛋白稳态等相关基因,进而参与调控脂类代谢。
综上,miR-33在高血脂人群的血清中表达增强,且表达量与LDL-C、TG、TC、ApoB水平有一定的相关性。本研究结果有助于认识血脂代谢的机制,并为改进临床治疗方法提供一些新的思路。本研究的局限性在于样本数量相对较少,未来需开展多中心、多样本研究,并进一步揭示可能的作用机制。
所有作者均声明不存在利益冲突



























