
研究评估维持性血液透析患者发生蛋白质能量消耗(PEW)的方法。
选择166例维持性血液透析患者,收集其临床资料、身体指标,并对患者进行营养风险筛查2002、主观全面营养状态评价、营养不良通用筛查工具评分。按是否发生PEW将患者分为PEW组和非PEW组,比较两组间各指标的差异,分析各指标和营养评分量表结果对发生PEW的诊断效能。
PEW组和非PEW组的体质量、体质量指数(BMI)、体表面积、腹围、肱三头肌皮褶厚度、上臂围(AC)、小腿围的差异均有统计学意义(均P<0.05)。单一的身体指标或营养评分指标对PEW的诊断效能有限。经logistic模型分析得到了PEW危险的简化公式。经受试者工作特征曲线分析,该公式诊断PEW的灵敏度为67.7%,特异度为94.4%。
临床中可联合腹围、主力手握力、BMI、AC 4个指标来综合评估是否存在PEW以提高对维持性血液透析患者发生营养不良的诊断效能。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
蛋白质能量消耗(protein energy wasting,PEW)是指在慢性肾脏病患者中发生的各种营养和代谢异常导致机体蛋白质能量储备降低的"营养不良"状态[1]。在维持性血液透析(maintenance hemodialysis,MHD)患者中,PEW的发生率非常高,可高达22.4%~75.0%[2,3],轻、中、重度营养不良的MHD患者住院率分别为32.93%、56.67%和83.33%,病死率分别为3.66%、6.67%和80.00%[4]。
2008年,国际肾营养和代谢学会(International Society of Renal Nutrition and Metabolism,ISRNM)提出从4个方面进行综合分析来判断患者是否存在PEW,包括:①生化指标;②非预期的身体质量降低;③肌肉量丢失;④饮食蛋白质和热量摄入不足[5]。目前临床上使用的营养评估方法仍以此为核心,这需要临床医师结合患者病史和各项检查指标来综合判定,包括实验室检查(如血清白蛋白、前白蛋白、转铁蛋白等)、体格检查[如体质量、体质量指数(body mass index,BMI)]、人体测量、单/多频生物电阻抗分析等)。目前也有很多营养评估量表可供选择,如患者提供的主观全面营养状态评价(scored patient-generated subjective global assessment,PG-SGA)、营养风险筛查2002(nutritional risk screening 2002,NRS2002)和营养不良通用筛查工具(manutriation universal screening tools,MUST)等,但大部分评分量表都不能同时达到临床要求的可靠、廉价、无创和方便操作,所以临床应用有限。
基于目前的研究现状,本研究收集天津市第三中心医院肾内科MHD患者的一般临床资料及实验室检查结果,并进行身体测量及多项评分的问卷调查。比较有无PEW两组间各指标的差异,比较身体测量及各评分量表的诊断效能,并试图寻找更适于临床应用的多指标联合的评估方法。
选取2019年9月至12月在天津市第三中心医院行MHD的患者166例,年龄(61.24±10.06)岁。共筛选患者200例,排除34例。纳入标准:①年龄≥18岁。②透析龄≥3月。排除标准:①已知恶性肿瘤的患者。②近1个月因重症感染住院治疗者。③近3个月有新发脑梗死、脑出血的患者。本研究已通过天津市第三中心医院伦理委员会审核批准,所有研究对象均签署了知情同意书。
研究人员使用统一的调查问卷,对研究对象进行现场调查,问卷内容包括以下3种:①一般情况:性别,年龄,透析龄,婚姻状态,文化程度。②原发病情况:是否有糖尿病,高血压等。③生活情况:每日排便情况,每日睡眠时间,每日蛋白及主食摄入情况,每周运动时长,是否有口腔炎,是否服用维生素或氨基酸等。
收集患者血液透析治疗单上的信息,包括透析前后体质量、血压、超滤量、透析方式、血流量、透析通路等。
收集透析中心近3个月的检验单,包括血常规、肝肾功电解质、甲状旁腺素、血糖、血脂、铁蛋白、转铁饱和度等指标。
对全部研究对象于透析前进行身体测量。测量内容包括:身高,体质量,腹围,小腿围,上臂围(arm circumference,AC),上臂皮褶厚度(triceps skinfold thickness,TSF),BMI,主力手握力等。肱三头肌皮褶厚度测量方法:使用皮褶厚度仪在非造瘘手臂的肩峰和鹰嘴之间的中点上2 cm测量肱三头肌皮褶厚度,在中点的位置用皮尺绕臂1周测量AC。测量腹围、小腿围时被测量者取垂直站立姿势,充分放松,使体质量均匀分布。腹围测量是经肚脐绕腹1周的长度;小腿围测量是在腿肚最粗壮处;测量主力手握力时采用站立姿势,双脚与肩同宽,双手下垂,使用非内瘘侧手握住握力器。上述指标均测量3次,若测量值相当,取3组平均值,若测量值相差较大,去掉相差较大值,取相近两组的平均值。
对所有研究对象进行NRS2002、PG-SGA、MUST评分。
根据2008年ISRNM推荐的指标进行诊断,满足以下4条诊断标准(每项中至少1项符合)考虑存在PEW,①生化指标:白蛋白<38 g/L,前ALB<300 mg/L,胆固醇<2.59 mmol/L。②非预期的体质量降低:BMI<23 kg/m2,或3个月内非意向性体质量下降5%或6个月内体质量下降10%,或脂肪含量<10%。③肌肉量丢失:3个月内肌肉量减少5%或6个月内肌肉量减少10%,上臂中段肌围(arm midsection muscle circumference,AMC)减少>10%,AMC(cm)=AC(cm)-3.14×TSF(cm)。④饮食蛋白质和热量摄入不足:透析患者非意向性饮食蛋白质摄入<0.8 g/(kg·d)至少持续2个月以上,或非意向性饮食能量摄入<25 kcal/(kg·d)至少持续2个月以上。满足以上4条任意3条即诊断为PEW。根据不同的BMI将PEW分为3个不同的级别:重度,BMI≤18.5 kg/m2;中度,BMI=18.6~20.0 kg/m2;轻度,BMI>20.0 kg/m2[6]。由于患者对长期体质量的监测往往不够精确,并且透析患者体质量受透析间期水负荷影响较大,因此本研究在选取身体数据时统一选择透析前测量,体质量降低标准选择相对客观且方便获取的BMI指标。
用SPSS 26.0软件进行统计学处理。符合正态分布的计量资料以均值±标准差( ±s)表示;两组间计量资料比较采用t检验,计数资料比较采用χ2检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析评估各量表的诊断效能。以P<0.05为差异有统计学意义。
±s)表示;两组间计量资料比较采用t检验,计数资料比较采用χ2检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析评估各量表的诊断效能。以P<0.05为差异有统计学意义。
共纳入166例患者,其中,男性100例(60%)、女性66例(40%);PEW组共130例(其中轻度104例、中度18例、重度8例),非PEW组36例。两组PEW组间年龄、性别、透析龄、透析血流量、合并糖尿病情况、血管通路、每日排便、每日睡眠、服用氨基酸及降压药、每日运动情况等比较,差异无统计学意义。
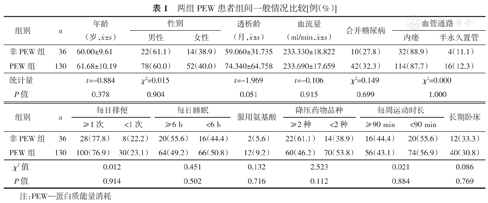
两组PEW患者组间一般情况比较[例(%)]
两组PEW患者组间一般情况比较[例(%)]
| 组别 | n | 年龄(岁, ±s) ±s) | 性别 | 透析龄(月, ±s) ±s) | 血流量(ml/min, ±s) ±s) | 合并糖尿病 | 血管通路 | ||
|---|---|---|---|---|---|---|---|---|---|
| 男性 | 女性 | 内瘘 | 半永久置管 | ||||||
| 非PEW组 | 36 | 60.00±9.61 | 22(61.1) | 14(38.9) | 59.060±31.735 | 233.330±18.822 | 10(27.8) | 32(88.9) | 4(11.1) |
| PEW组 | 130 | 61.68±10.19 | 78(60.0) | 52(40.0) | 74.340±64.758 | 233.690±17.659 | 42(32.3) | 114(87.7) | 16(12.3) |
| 统计量 | t=-0.884 | χ2=0.015 | t=-1.969 | t=-0.106 | χ2=0.149 | χ2=0.000 | |||
| P值 | 0.378 | 0.904 | 0.051 | 0.915 | 0.699 | 1.000 | |||
| 组别 | n | 每日排便 | 每日睡眠 | 服用氨基酸 | 降压药物品种 | 每周运动时长 | 长期卧床 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| ≥1次 | <1次 | ≥6 h | <6 h | ≥2种 | <2种 | ≥90 min | <90 min | ||||
| 非PEW组 | 36 | 28(77.8) | 8(22.2) | 20(55.6) | 16(44.4) | 2(5.6) | 22(61.1) | 14(38.9) | 16(44.4) | 20(55.6) | 12(33.3) |
| PEW组 | 130 | 100(76.9) | 30(23.1) | 64(49.2) | 66(50.8) | 12(9.2) | 60(46.2) | 70(53.8) | 56(43.1) | 74(56.9) | 40(30.8) |
| χ2值 | 0.012 | 0.451 | 0.132 | 2.523 | 0.021 | 0.086 | |||||
| P值 | 0.914 | 0.502 | 0.716 | 0.112 | 0.884 | 0.769 | |||||
注:PEW—蛋白质能量消耗
统计分析结果显示,两组间比较,血压水平、每日蛋白摄入、服用维生素、尿酸、肌酐、血钙水平方面的差异均有统计学意义(均P<0.05);身体测量方面的多项指标包括体质量、BMI、体表面积、腹围、肱三头肌皮褶厚度、AC、小腿围的差异均有统计学意义(均P<0.05),PG-SGA评分差异有统计学意义(P<0.05),其余均无统计学意义。(表2)
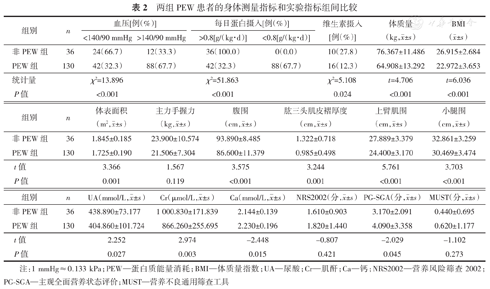
两组PEW患者的身体测量指标和实验指标组间比较
两组PEW患者的身体测量指标和实验指标组间比较
| 组别 | n | 血压[例(%)] | 每日蛋白摄入[例(%)] | 维生素摄入[例(%)] | 体质量(kg, ±s) ±s) | BMI( ±s) ±s) | ||
|---|---|---|---|---|---|---|---|---|
| <140/90 mmHg | >140/90 mmHg | >0.8[g/(kg·d)] | <0.8[g/(kg·d)] | |||||
| 非PEW组 | 36 | 24(66.7) | 12(33.3) | 36(100.0) | 0(0.0) | 10(27.8) | 76.367±11.486 | 26.915±2.684 |
| PEW组 | 130 | 42(32.3) | 88(67.7) | 42(32.3) | 88(67.7) | 16(12.3) | 64.908±13.292 | 22.972±3.653 |
| 统计量 | χ2=13.896 | χ2=51.863 | χ2=5.108 | t=4.706 | t=6.036 | |||
| P值 | <0.001 | <0.001 | 0.024 | <0.001 | <0.001 | |||
| 组别 | n | 体表面积(m2, ±s) ±s) | 主力手握力(kg, ±s) ±s) | 腹围(cm, ±s) ±s) | 肱三头肌皮褶厚度(cm, ±s) ±s) | 上臂肌围(cm, ±s) ±s) | 小腿围(cm, ±s) ±s) |
|---|---|---|---|---|---|---|---|
| 非PEW组 | 36 | 1.845±0.185 | 23.900±10.574 | 93.890±8.485 | 1.322±0.718 | 27.889±3.379 | 32.861±3.259 |
| PEW组 | 130 | 1.725±0.190 | 21.506±7.304 | 86.600±11.379 | 0.985±0.498 | 24.400±3.170 | 30.469±3.474 |
| t值 | 3.366 | 1.567 | 3.575 | 3.244 | 5.761 | 3.703 | |
| P值 | 0.001 | 0.119 | <0.001 | 0.001 | <0.001 | <0.001 |
| 组别 | n | UA(mmol/L, ±s) ±s) | Cr(μmol/L, ±s) ±s) | Ca(mmol/L, ±s) ±s) | NRS2002(分, ±s) ±s) | PG-SGA(分, ±s) ±s) | MUST(分, ±s) ±s) |
|---|---|---|---|---|---|---|---|
| 非PEW组 | 36 | 438.890±73.177 | 1 000.830±171.839 | 2.144±0.139 | 1.610±0.903 | 3.170±2.091 | 0.440±0.695 |
| PEW组 | 130 | 404.860±101.724 | 866.260±255.695 | 2.230±0.196 | 1.820±1.440 | 4.090±3.358 | 0.620±1.177 |
| t值 | 2.252 | 2.974 | -2.448 | -0.807 | -2.029 | -1.102 | |
| P值 | 0.027 | 0.003 | 0.015 | 0.421 | 0.045 | 0.273 |
注:1 mmHg≈0.133 kPa;PEW—蛋白质能量消耗;BMI—体质量指数;UA—尿酸;Cr—肌酐;Ca—钙;NRS2002—营养风险筛查2002;PG-SGA—主观全面营养状态评价;MUST—营养不良通用筛查工具
ROC曲线分析评估身高、体质量、BMI、体表面积、主力手握力、腹围、肱三头肌皮褶厚度、AC、小腿围、NRS2002、PG-SGA、MUST评分的诊断效能见表3。
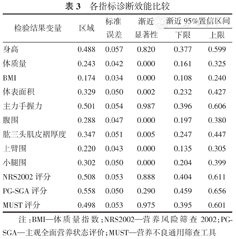
各指标诊断效能比较
各指标诊断效能比较
| 检验结果变量 | 区域 | 标准误差 | 渐近显著性 | 渐近95%置信区间 | |
|---|---|---|---|---|---|
| 下限 | 上限 | ||||
| 身高 | 0.488 | 0.057 | 0.820 | 0.377 | 0.599 |
| 体质量 | 0.243 | 0.042 | 0.000 | 0.161 | 0.325 |
| BMI | 0.174 | 0.034 | 0.000 | 0.108 | 0.240 |
| 体表面积 | 0.329 | 0.050 | 0.002 | 0.232 | 0.427 |
| 主力手握力 | 0.501 | 0.054 | 0.987 | 0.396 | 0.606 |
| 腹围 | 0.288 | 0.047 | 0.000 | 0.197 | 0.380 |
| 肱三头肌皮褶厚度 | 0.347 | 0.051 | 0.005 | 0.247 | 0.447 |
| 上臂围 | 0.220 | 0.043 | 0.000 | 0.135 | 0.305 |
| 小腿围 | 0.302 | 0.050 | 0.000 | 0.204 | 0.399 |
| NRS2002评分 | 0.508 | 0.053 | 0.888 | 0.404 | 0.611 |
| PG-SGA评分 | 0.558 | 0.050 | 0.290 | 0.459 | 0.656 |
| MUST评分 | 0.498 | 0.053 | 0.975 | 0.395 | 0.601 |
注:BMI—体质量指数;NRS2002—营养风险筛查2002;PG-SGA—主观全面营养状态评价;MUST—营养不良通用筛查工具
通过二分类logistic回归模型用身高、体质量、BMI、体表面积、主力手握力、腹围、肱三头肌皮褶厚度、AC、小腿围、NRS2002、PG-SGA、MUST评分这些指标计算预测概率(采用forward:LR的自变量筛选法),得出结果(表4)。该回归模型结果显示,BMI、主力手握力、腹围、AC 4个变量可预测患者是否有PEW,而其他指标没有预测意义。
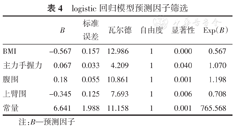
logistic回归模型预测因子筛选
logistic回归模型预测因子筛选
| B | 标准误差 | 瓦尔德 | 自由度 | 显著性 | Exp(B) | |
|---|---|---|---|---|---|---|
| BMI | -0.567 | 0.157 | 12.986 | 1 | 0.000 | 0.567 |
| 主力手握力 | 0.067 | 0.033 | 4.209 | 1 | 0.040 | 1.070 |
| 腹围 | 0.18 | 0.055 | 10.861 | 1 | 0.001 | 1.198 |
| 上臂围 | -0.345 | 0.125 | 7.693 | 1 | 0.006 | 0.708 |
| 常量 | 6.641 | 1.988 | 11.158 | 1 | 0.001 | 765.568 |
注:B—预测因子
依据上述结果计算危险因素得分为
Logit(p)=6.641-0.567×BMI+0.067×主力手握力+0.180×腹围-0.345×AC
对该预测指标Logit(p)重新进行ROC曲线分析:AUC=0.864,诊断效能较高。(图1)
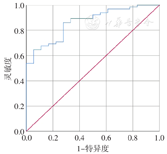

但上述公式复杂,不利于临床使用,故将上述公式两侧除以0.18再减去9.5进行简化后,PEW危险评分简化公式为:27.4+腹围+0.4×主力手握力-3.2×BMI-1.9×AC(AUC=0.864),并通过约登指数计算最佳阈值为0.043 346,约等于0;灵敏度67.7%,特异度94.4%。也就是说,当PEW危险评分简化公式计算值≥0时,考虑存在PEW。
PEW是MHD患者常见的并发症,与患者死亡密切相关[5],已引起大家的重视。PEW的原因主要集中于蛋白质及热量摄入不足、透析不充分、微炎症状态、糖尿病、容量负荷过重及代谢性酸中毒等方面,目前研究还发现了泛素-蛋白酶体系统、胃饥饿素、Mirco-RNAs、肌细胞凋亡与再生能力缺陷、维生素D缺乏等细胞因子和内分泌因素[6,7],这些因素会互相影响、互相促进形成恶性循环,最终导致PEW患者出现乏力、萎靡不振等临床表现[1,8],严重时还会增加患抑郁症的风险[9]。
寻找早期筛查及随访PEW的单一指标,一直是PEW领域的研究热点。有关PEW的临床评估,目前临床上使用的方法仍以ISRNM所提出的PEW诊断标准为核心。这要求临床医师需掌握人体测量学和膳食调查分析,并对患者近3个月是否出现体质量及肌肉量减少有严密的随访,因此其复杂性也导致其无法在临床方便操作。
笔者认为,与重视化验指标的变化相比,身体测量指标更加明确和有意义。Inoue等[10]的研究结果也显示,过度重视血磷的控制,易让患者出现PEW状态,从而对其造成比高磷更大的危害。目前除了常见的身体指标测量,还有很多种评分,本研究中纳入了比较常用的NRS2002、PG-SGA、MUST评分,但通过ROC曲线分析显示,其诊断效能均不高,最高的是PG-SGA评分,AUC也仅仅是0.558。可见单独一项指标,不论是身体测量还是评分量表,均不能很好地评估PEW,所以笔者尝试寻找多项指标联合的评估方法。通过logistic回归模型分析,发现BMI、主力手握力、腹围、AC这4个变量可预测患者是否有PEW,而其他指标没有预测意义。目前越来越多的研究者都发现肌肉含量变化能更直观地反映患者的营养状态[11],有学者也发现肌肉含量及主力手握力与PEW的发生成线性反比关系[12]。
本研究进一步推算,PEW危险评分简化公式为:27.4+腹围+0.4×主力手握力-3.2×BMI-1.9×AC,最佳阈值约等于0。即PEW危险评分简化公式计算值≥0时,考虑存在PEW。运用本公式代入所有患者数据,并重新进行ROC曲线分析,得出AUC=0.864,诊断效能较高。但由于本研究纳入的患者较少,有待在以后的临床应用中进一步印证。
综上所述,PEW是MHD患者常见的合并症,且随着病程进展其发生率越来越高[13]。本研究通过有无PEW组的组间比较,发现身体测量指标的重要性。综合评估腹围、AC、主力手握力等指标,可进一步辅助临床评估PEW状态。总之,早期诊断并及时干预PEW是提高MHD患者生活质量的重要措施。
所有作者均声明不存在利益冲突



























