
随着全球癌症负担的进一步增加,各种疾病日益挑战着人类的健康状况和生活质量,因此癌症的早期筛查至关重要。尿液挥发性有机化合物(VOCs)检测具有样品易获得、患者接受程度高、无创等优点受到研究者的青睐和关注。主要对现有基于尿液VOCs进行癌症诊断的技术方法进行总结,并综述了对相关癌症诊断的一些研究,最后对存在的障碍和未来展望进行了深入思考和探讨。通过介绍尿液VOCs的一些前沿检测技术,以期为这一跨医学、材料学等多学科领域的研究者对于尿液VOCs检测提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
最新统计数据显示,世界范围内癌症发病率和病死率的负担正与日俱增。表1显示,2020年全世界约有1 930万的新增癌症患者,因癌症而死亡的人数约有1 000万例,世界范围内的肿瘤疾病的负担估计会在2040年增至2 840万,较2020年增长47%[1]。因此,癌症的负担将继续给个人、家庭、社区和医疗系统带来巨大的压力。据最新报道的数据显示,目前我国恶性肿瘤患者的5年相对生存率约为40.5%,与10年前相比,我国恶性肿瘤患者生存率总体提高约10个百分点,但是与发达国家还有很大差距,从表2和图1中就可以看出[2,3,4]。预防和早期筛查仍然是减轻我国癌症日益加重负担的关键战略。
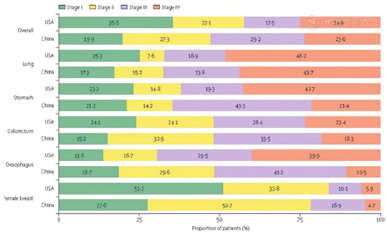

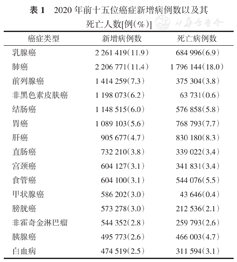
2020年前十五位癌症新增病例数以及其死亡人数[例(%)]
2020年前十五位癌症新增病例数以及其死亡人数[例(%)]
| 癌症类型 | 新增病例数 | 死亡病例数 |
|---|---|---|
| 乳腺癌 | 2 261 419(11.9) | 684 996(6.9) |
| 肺癌 | 2 206 771(11.4) | 1 796 144(18.0) |
| 前列腺癌 | 1 414 259(7.3) | 375 304(3.8) |
| 非黑色素皮肤癌 | 1 198 073(6.2) | 63 731(0.6) |
| 结肠癌 | 1 148 515(6.0) | 576 858(5.8) |
| 胃癌 | 1 089 103(5.6) | 768 793(7.7) |
| 肝癌 | 905 677(4.7) | 830 180(8.3) |
| 直肠癌 | 732 210(3.8) | 339 022(3.4) |
| 宫颈癌 | 604 127(3.1) | 341 831(3.4) |
| 食管癌 | 604 100(3.1) | 544 076(5.5) |
| 甲状腺癌 | 586 202(3.0) | 43 646(0.4) |
| 膀胱癌 | 573 278(3.0) | 212 536(2.1) |
| 非霍奇金淋巴瘤 | 544 352(2.8) | 259 793(2.6) |
| 胰腺癌 | 495 773(2.6) | 466 003(4.7) |
| 白血病 | 474 519(2.5) | 311 594(3.1) |
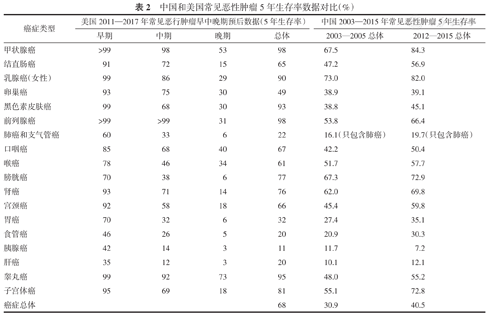
中国和美国常见恶性肿瘤5年生存率数据对比(%)
中国和美国常见恶性肿瘤5年生存率数据对比(%)
| 癌症类型 | 美国2011—2017年常见恶行肿瘤早中晚期预后数据(5年生存率) | 中国2003—2015年常见恶性肿瘤5年生存率 | ||||
|---|---|---|---|---|---|---|
| 早期 | 中期 | 晚期 | 总体 | 2003—2005总体 | 2012—2015总体 | |
| 甲状腺癌 | >99 | 98 | 53 | 98 | 67.5 | 84.3 |
| 结直肠癌 | 91 | 72 | 15 | 65 | 47.2 | 56.9 |
| 乳腺癌(女性) | 99 | 86 | 29 | 90 | 73.0 | 82.0 |
| 卵巢癌 | 93 | 75 | 30 | 49 | 38.9 | 39.1 |
| 黑色素皮肤癌 | 99 | 68 | 30 | 93 | 38.8 | 45.1 |
| 前列腺癌 | >99 | >99 | 31 | 98 | 53.8 | 66.4 |
| 肺癌和支气管癌 | 60 | 33 | 6 | 22 | 16.1(只包含肺癌) | 19.7(只包含肺癌) |
| 口咽癌 | 85 | 68 | 40 | 67 | 42.2 | 50.4 |
| 喉癌 | 78 | 46 | 34 | 61 | 51.7 | 57.7 |
| 膀胱癌 | 70 | 38 | 6 | 77 | 67.3 | 72.9 |
| 肾癌 | 93 | 71 | 14 | 76 | 62.0 | 69.8 |
| 宫颈癌 | 92 | 58 | 18 | 66 | 45.4 | 59.8 |
| 胃癌 | 70 | 32 | 6 | 32 | 27.4 | 35.1 |
| 食管癌 | 46 | 26 | 5 | 20 | 20.9 | 30.3 |
| 胰腺癌 | 42 | 14 | 3 | 11 | 11.7 | 7.2 |
| 肝癌 | 35 | 12 | 3 | 20 | 10.1 | 12.1 |
| 睾丸癌 | 99 | 92 | 73 | 95 | 48.0 | 55.2 |
| 子宫体癌 | 95 | 69 | 18 | 81 | 55.1 | 72.8 |
| 癌症总体 | 68 | 30.9 | 40.5 | |||
许多癌症的早期症状往往很模糊,可能被误认为是常见的良性疾病。肿瘤学的一个长期目标是在早期诊断癌症,以改善临床结果。所以疾病的早期筛查和发现能够有效地提高后续患者针对性治疗的成功率。现有为数不多的筛查与早期诊断方法(医学影像学检查、组织病理学活检以及常规检查等)还存在很多问题,往往存在操作复杂、价格高、侵入性、有辐射、可及性和民众对于筛查的依从性低等问题,不适用于大规模尚无症状人群的筛查。因此开发一种无创或者微创、便捷、精准且适用于大规模人群的癌症筛查方法势在必行。而通过分析癌症生物标志物,研发非侵入性检测的分析工具对于疾病诊断、后续治疗和预后监测非常重要,生物标志物的高频测量可以更好地阐明个体表型特征,改善诊断并告知人类健康和疾病的差异[5]。生物标志物可以使用生物传感器进行检测,由于其可快速检测、准确反映人体生理过程等优点,是传统方法的有效替代品。此外,生物传感领域的不断创新,改善了患者生物体液中肿瘤标志物水平的测定[6]。
挥发性有机化合物(volatile organic compounds,VOCs)的检测是一个新兴领域,人体内的VOCs通过肺部呼吸、细胞活动等途径产生,存在于血液、粪便和尿液等环境中,包含了大量细胞行为及其新陈代谢信息。而癌细胞和健康细胞在各种行为和代谢中都会产生不同的VOCs。但是在正常生理过程中某些VOCs不会产生,但其产生与病理条件有关。因为许多VOCs仅在癌变过程中产生,并成为癌症检测的候选生物标志物[7]。相较于血液检测等侵入性强的取样方式,尿液基质干扰比较少,尿液的预浓缩过程使得检测时VOCs浓度较高,同时尿液稳定性较强,McFarlane等[8]提出,在储存生物样品之前,室温下的最长持续时间可达12个小时,与粪便或呼吸相比,尿液受饮食或肠道内其他共生细菌的影响要小得多。随着代谢组学的发展,分析代谢组挥发性部分,即临床样本(如尿液等生物流体)顶空(气相)中存在的低分子量VOCs,是一种很有前景的癌症筛查新工具。
气相色谱-质谱法(gas chromatography-mass spectrometry, GC-MS)是用于对作为癌症生物标志物的VOCs进行化学定性的金标准,而选择离子流管质谱(selected ion flow tube-gas chromatography, SIFT-MS)和质子转移反应质谱(proton transfer mass spectrometry, PTR-MS)是另外可替代质谱法的方法[9]。模式识别传感器阵列,如电子鼻以及基于离子迁移率光谱法的技术也被用于创建VOCs轮廓的特定"气味指纹"。相关研究结果显示,动物可以有效感知患者癌症的存在,特别是在尿液样本中[10,11]。VOCs谱反映了炎症、坏死、癌症发展和微生物群改变引起的代谢变化。通过各种分析平台,从高端GC-MS到模拟生物嗅觉系统(电子鼻)的低成本、便携式技术,提高标志物的可检测性。此外创新技术如人工智能、计算机辅助诊断系统、代谢组学技术等已被用于癌症的早期诊断,并显示出良好的前景[12]。
本文主要讨论人体尿液中的VOCs的体外检测方法以及不同检测方法的工作原理,同时对比了它们的优势和局限性(表3)。最后介绍了这些技术在前列腺癌、膀胱癌、结直肠癌等癌症诊断中的相关研究(表4)。相关证据表明,患者尿液中的VOCs可以用作生物特征标志,它含有疾病状态的信息,通过使用尿液样本能够成功区分癌症与健康对照组。

挥发性有机化合物常用分析技术的优势与局限性
挥发性有机化合物常用分析技术的优势与局限性
| 分析技术 | 优势 | 局限性 |
|---|---|---|
| 气相色谱-质谱法(GC-MS) | 灵敏度高;选择性强 | 只针对特定目标分析物;劳动密集型和耗时;价格昂贵;专业人员使用 |
| 离子流管-质谱法(SIFT-MS) | 非专业人员可操作;可实时采集在线分析;无需校准曲线的直接化合物定量 | 用于在线分析时;无法区分结构异构体化合物 |
| 质子转移反应质谱(PTR-MS) | 高灵敏度和低检测限;其操作不需要载气;可实时在线检测;无需样品预处理 | 无法分离同分异构体;只能测定质子亲和力高于水分子的化合物 |
| 离子迁移率光谱技术(FAIMS) | 重复性好;灵敏;不受质谱法的限制;快速且成本效益高 | 本身不能识别特定的挥发性有机化合物 |
| 化学电阻单传感器 | 传感器表面敏感材料复杂多样 | 只针对单一气体,不能检测混合气体 |
| 电子鼻(EN) | 分析时间比较短;设备尺寸小,便于运输;成本较低 | 比单传感器占面积;需结合复杂的统计分析;与质谱法相比寿命更短;缺乏临床实践的标准化 |
| 动物嗅觉系统 | 诊断准确率较高 | 需要经历昂贵且耗时的犬类训练 |
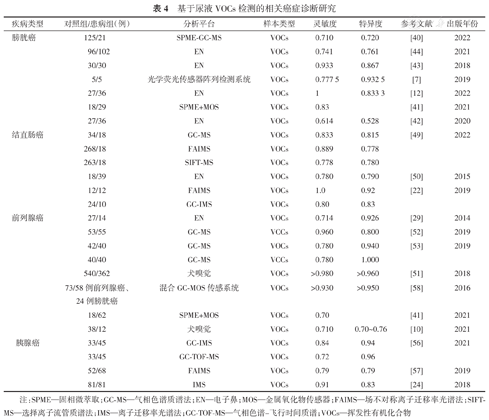
基于尿液VOCs检测的相关癌症诊断研究
基于尿液VOCs检测的相关癌症诊断研究
| 疾病类型 | 对照组/患病组(例) | 分析平台 | 样本类型 | 灵敏度 | 特异度 | 参考文献 | 出版年份 |
|---|---|---|---|---|---|---|---|
| 膀胱癌 | 125/21 | SPME-GC-MS | VOCs | 0.710 | 0.720 | [40] | 2022 |
| 96/102 | EN | VOCs | 0.741 | 0.761 | [44] | 2021 | |
| 30/30 | EN | VOCs | 0.933 | 0.867 | [43] | 2018 | |
| 5/5 | 光学荧光传感器阵列检测系统 | VOCs | 0.777 5 | 0.932 5 | [7] | 2019 | |
| 27/36 | EN | VOCs | 1 | 0.833 3 | [12] | 2022 | |
| 18/29 | SPME+MOS | VOCs | 0.83 | [41] | 2021 | ||
| 27/36 | EN | VOCs | 0.614 | 0.528 | [42] | 2020 | |
| 结直肠癌 | 34/18 | GC-MS | VOCs | 0.833 | 0.815 | [49] | 2022 |
| 268/18 | FAIMS | VOCs | 0.889 | 0.778 | |||
| 263/18 | SIFT-MS | VOCs | 0.778 | 0.780 | |||
| 18/39 | EN | VOCs | 0.780 | 0.790 | [50] | 2015 | |
| 12/12 | FAIMS | VOCs | 1.0 | 0.92 | [22] | 2019 | |
| 24/10 | GC-IMS | VOCs | 0.80 | 0.83 | |||
| 前列腺癌 | 27/14 | EN | VOCs | 0.714 | 0.926 | [29] | 2014 |
| 53/55 | GC-MS | VCCs | 0.960 | 0.800 | [52] | 2019 | |
| 42/40 | GC-MS | VOCs | 0.780 | 0.940 | [53] | 2019 | |
| 40/40 | GC-MS | VCCs | 0.780 | 1.000 | |||
| 540/362 | 犬嗅觉 | VOCs | >0.980 | >0.960 | [51] | 2018 | |
| 73/58例前列腺癌、24例膀胱癌 | 混合GC-MOS传感系统 | VOCs | >0.930 | >0.950 | [58] | 2016 | |
| 18/62 | SPME+MOS | VOCs | 0.70 | [41] | 2021 | ||
| 38/12 | 犬嗅觉 | VOCs | 0.710 | 0.70~0.76 | [10] | 2021 | |
| 胰腺癌 | 33/45 | GC-IMS | VOCs | 0.84 | 0.94 | [56] | 2021 |
| 33/45 | GC-TOF-MS | VOCs | 0.72 | 0.96 | |||
| 52/68 | FAIMS | VOCs | 0.79 | 0.79 | [57] | 2019 | |
| 81/81 | IMS | VOCs | 0.91 | 0.83 | [24] | 2018 |
注:SPME—固相微萃取;GC-MS—气相色谱质谱法;EN—电子鼻;MOS—金属氧化物传感器;FAIMS—场不对称离子迁移率光谱法;SIFT-MS—选择离子流管质谱法;IMS—离子迁移率光谱法;GC-TOF-MS—气相色谱-飞行时间质谱;VOCs—挥发性有机化合物
GC-MS是最常用的气体分析技术,是一种较为准确、全面的气体剖面分析技术。它具有检测下限低、灵敏度高、定性和定量准确度高等优点。但是该技术依赖于昂贵和笨重的仪器,受到尺寸和成本的限制[9]。GC-MS是识别和量化呼出气中VOCs生物标志物以及体液和粪便样本顶空中VOCs生物标志物最常用的方法,通过统计分析和模式识别对健康受试者和癌症患者的呼吸、液体和粪便样本中的VOCs成分和浓度水平进行比较,以诊断癌症。由于人体VOCs的含量比较低,通过固相微萃取技术(solid-phase microextraction,SPEM)对样品进行预浓缩处理,以提高检测率[13]。许多研究已经报道了GC-MS在寻找肿瘤患者VOCs生物标志物方面的工作[14,15]。除了VOCs,GC-MS还被广泛用于检测癌症患者血浆和尿样中的代谢物[16,17]。总之,GC-MS为肿瘤生物标志物的研究提供了一种新的思路和方法。
在直接注入质谱技术中,最有前途的是SIFT-MS和PTR-MS。前者在呼气VOCs分析中提供实时分析,无需呼气收集和储存,降低了样品处理过程中样品丢失或污染的风险[18]。SIFT-MS是能够检测和量化呼吸中VOCs的几种公认技术之一,它没有预浓缩过程,允许取样现场实时检测,并且灵敏度较高。与呼吸样本相比,使用SIFT-MS分析尿液的频率较低[19]。但是比起GC-MS劳动密集型和耗时等局限性,SIFT-MS在临床上更容易受到检测人员的青睐。PTR-MS是上述技术的再一次飞跃,由于其高灵敏度和低检测限而越来越受欢迎。离子源产生的离子使待测分子离子化后进入质谱仪中进行检测。其操作不需要使用载气或其他专用介质,这意味着即使在实验室之外也可以成功使用,在与GC-MS联用时,还可以快速量化选定的物质[20]。PTR-MS技术主要应用于大气科学、植物研究、食品科学和医疗应用等领域[21]。
另一种新的疾病检测分析模式,即将GC与IMS相结合。先使用气相色谱仪,根据VOCs与涂层毛细管柱的相互作用进行分离;后使用漂移管离子迁移率光谱仪检测这些VOCs,测量化学离子沿漂移管(在缓冲气体的流动下)移动的时间。不同大小的化学离子沿漂移管移动的时间长短不同,这可用于分离化学物种[22]。作为一种临床工具,GC-IMS使用简单,便于携带,它拥有分离和识别尿液样本中的化学成分的技术。
场不对称离子迁移率光谱法(field asymmetric ion mobility spectrometry,FAIMS)是一种基于VOCs物理化学性质的离子迁移率方法[23]。它是基于测量电离分子在极高电场中的移动方式,该仪器能够分离生物样品中发现的复杂化学品混合物。FAIMS允许气体分子在大气压和室温下被分离和分析,从而大大降低了设备的复杂性和成本。它的优点是重复性好,比电子鼻灵敏,且不需要专门且昂贵的基础设施。缺点是它本身并不能确定具体的VOCs种类[24]。FAIMS技术也被证明在定量分析中是准确的,特别是与质谱法一起使用时[25]。
电子鼻将多个具有特定目标分析物选择性的传感器集成到一个阵列中,而单个传感器装置是基本功能元件,从而决定了人工嗅觉的整体性能。阵列中传感器对不同类型VOCs的反应不同,就可以获得给定VOCs混合物的"指纹"。早在20世纪80年代,它通过评估复杂化合物混合物的总化学特征来模拟生物嗅觉系统[26]。电子鼻属于一种模式识别技术,其对于疾病的诊断需要结合复杂的统计分析方法,以检测和分析灵敏度低的VOCs。基于电阻传感技术的商用电子鼻已被用于疾病患者样本检测,比如女性妇科疾病、肺癌、膀胱炎等[27,28]。尿液顶空也被证明是电子鼻测量前列腺癌的合适样本[29],综合测试也开始应用于研究中,Zaim等[30]采用多感官系统(电子鼻和电子舌)应用于肝硬化,分别用于呼出气和尿液样本中的VOCs,结果表明该系统具有分类和预测能力。因此,具有精心选择的传感材料(受体)和多变量传感器的混合气体传感器阵列对于尿液VOCs高性能识别非常有前景。

经过训练的犬被证明能够通过嗅觉检测各种人类疾病,是最常用的癌症生物探测器,包括检测膀胱癌、前列腺癌、结肠癌、宫颈癌、肺癌、卵巢癌等[31,32,33,34,35,36]。犬类无创地检测疾病条件下产生的VOCs,其灵敏度、特异度和阳性预测值都比任何人造系统要好,这证明了癌症有特定的气味特征。尿液中的"挥发性组"(VOCs)可能会引起犬的嗅觉反应,在癌症诊断中显示出前景。最新研究通过训练蚂蚁的嗅觉检测VOCs,相对于犬训练昂贵又费时,蚂蚁作为训练的对象就更有优势,通过几次训练就可以学习、记忆和可靠地检测人类癌细胞的气味[11]。该研究发现表明,使用蚂蚁作为活体工具来检测人类癌症的生物标志物是可行的,并且比使用其他动物要省力和快速。这表明,动物嗅觉系统也可以实现对尿液VOCs的检测,为癌症无创诊断提供了新的方法和视角。
膀胱癌是最常见的癌症之一,具有较高的复发率和病死率。目前诊断膀胱癌的主要方法是膀胱镜检查和细胞学检查,部分患者甚至需要终生依赖于膀胱镜间期检查,以确保其不复发或者恶化[37]。膀胱镜检查是一种侵入性、劳动密集型、昂贵且有风险的检查方法,因此膀胱癌的非侵入性检测仍然是泌尿外科肿瘤学正在进行的研究重点[38]。美国国家卫生与保健卓越研究所也概述了监测中使用膀胱癌生物标志物的必要性,以减少膀胱镜检查的频率[39]。而尿液VOCs分析可以作为重要的替代技术,可以在膀胱镜检查之前作为主要辅助方法。
Lett等[40]使用SPEM结合GC-MS得到尿路上皮性膀胱癌(urothelial bladder cancer,UBC)的尿液VOCs谱,实验预测模型评估结果显示在UBC患者中观察到特有的VOCs图谱,具有统计意义的VOCs趋势在一定程度上区分了有无UBC的患者。但是该研究晚期患者样本数小,需要更多的数据,以便调查疾病不同阶段VOCs谱的变化。Bannaga等[41]提出了一种检测肝癌、膀胱癌和前列腺癌(prostate cancer,PCa)的非侵入性方法,通过SPEM对尿液中的VOCs进行检测,同时它采用了金属氧化物传感器(metal oxide sensor,MOS)作为探测器,该阵列生成的数据可以通过多元技术进行处理,以识别复杂混合物。Zhu等[7]建立了一个检测膀胱癌相关尿液VOCs的新平台,实验结果表明,聚偏氟乙烯膜上的灵敏物质能够响应膀胱癌相关VOCs的存在并反映其荧光光谱的变化,为检测膀胱癌提供必要的信息。
电子鼻技术近些年发展较快,它通过整体分析样本来模拟生物嗅觉系统。Matsumoto等[42]使用电子鼻,通过尿液气味特征来区分泌尿系统疾病。Heers等[43]使用电子鼻对膀胱癌患者尿液样本进行分析,获得了93.3%的灵敏度和86.7%的特异度,然而这项研究样本量相对较小,其预测模型缺乏外部验证。Bassi[44]用了一种配备32个传感器的电子鼻来检测膀胱癌尿液顶空,其灵敏度为74.1%,特异度为76.0%,而当通过选择其中最有效的传感器时,灵敏度和特异度分别提升到91.1%和89.1%。最新的一项研究[11]报告了一种由聚苯胺衍生物制成的人工智能化化学电阻传感器阵列,该阵列被证明可以通过临床尿液样本在早期无创诊断膀胱癌,并在室温下通过"闻"临床尿液样本维持术后监测,结果获得了非常高的灵敏度(100%)和准确率(96.67%),超过了当前技术在实践中获得的灵敏度和准确率,同时混杂的临床因素对电子鼻性能的影响并没有改变检出率。上述研究结果表明,电子鼻可能是一种潜在的快速、准确和经济有效的非侵入性膀胱癌诊断工具。
在胃肠道肿瘤中,结直肠癌(carcinoma of colon and rectum,CRC)很常见。结肠镜检查和活检被认为是CRC和其他下消化道疾病,尤其是肠易激综合征等疾病筛查的金标准,但是这种方法侵入性强、成本高,不适合大规模人群筛查。粪便免疫细胞化学血检是目前应用最广泛的无创性筛查工具之一,特异性较好,但敏感性差异变化很大,同时患者接受度低。而健康人和结直肠癌患者的粪便样本之间的差异是由于肿瘤细胞产生的VOCs所致[45]。这种利用粪便样本快速检测的方法开辟了一个新领域,可作为另外一种非侵入性诊断工具使用[46]。但是,粪便中VOCs会直接受到饮食和肠道内其他共生细菌的影响。而用尿液检测VOCs具有样品易收集、易获得、患者可接受性高等优点,它也易储存,并在中期内表现出稳定性[47]。这些因素使其成为开发筛查工具的理想重点,以替代基于粪便的测试。
Arasaradnam等[48]首次报道FAIMS对尿液中CRC检测的效能,FAIMS能够通过分析尿液和粪便中VOCs模式的变化来识别炎症性肠病患者,大肠癌患者的VOCs谱呈紧密聚集性,可与对照组区分开来。Mozdiak等[22]使用FAIMS和GC-IMS,对粪便潜血检测阳性患者的尿液进行分析,并使用机器学习算法对数据进行分析,以计算针对腺瘤和其他胃肠道病变对结直肠癌进行正确分类的测试准确率,结果表明,两者能正确地将大肠癌与对照组和腺瘤进行分类,因此在筛查人群中通过尿液VOCs检测大肠癌和腺瘤是可行的。Boulind[49]使用了三种技术来分析尿液样本,GC-MC区分CRC的灵敏度和特异度可以达到83.3%和81.5%,FAIMS为88.9%和77.9%,而SIFT-MS则为77.8%和88.0%。该研究结果还表明,GC-MS对该患者组中的癌症和息肉的鉴别具有良好的灵敏度和特异度,这表明尿液VOCs分析具有作为分类工具的效用。尿液VOCs可能不会取代肠镜检查,但有助于对有症状或无症状的患者进行风险分层,作为肠镜检查的辅助工具。
Westenbrink等[50]采用华威大学新开发的电子鼻仪器,它基于13个电化学和光学传感器阵列来测量尿液顶空的气体挥发物含量,将尿液VOCs检测大肠癌与肠易激综合征进行比较,结果显示,其检测CRC的灵敏度和特异度分别为78%和79%。从而加强了电子鼻技术作为诊断工具从另一种常见疾病和健康对照中检测CRC的可能性。
PCa是男性中最常被诊断出的癌症,其潜伏期长,在早期阶段具有潜在的治愈性,适用于早期筛查程序。前列腺特异性抗原(prostate specific antigen,PSA)被认为是检测早期PCa最有用的生物标志物,但其特异性较低,且在不同研究中,该生物标志物的灵敏度和特异度的报告值不一致,常规临床应用会产生大量不必要的活检和漏检,并可能错误地检测出良性疾病。理想的生物标志物应是在人体大量含有的生物体液(如血液、尿液、前列腺液)中定量获取,从而减少结果延迟和经济成本。
Bax等[6]基于尿液分析的早期PCa检测方法在医学诊断学领域的研究进行了系统综述,主要包括使用训练有素的狗的感官方法、基于电子鼻的传感仪器方法以及基于尿液化学特征的分析技术。基于液相色谱或GC-MS的方法是最可靠的,可以在较低的浓度下以高灵敏度检测代谢物。但由于癌症的特异性气味并非是单一化合物,而是多种成分形成的气味特征,所以越来越多的研究开发了基于VOCs的模型来对PCa诊断。Jiménez-Pacheco等[51]比较了PCa和良性前列腺增生症患者尿液中的VOCs水平,研究得出呋喃和对二甲苯可作为PCa候选生物标志物,支持VOCs可作为PCa生物标志物的提议。此外,Gao等[52]开发了一个基于11种VOCs的尿液VOC模型,其检测PCa的准确率(87%)高于单独的PSA(59%)。Lima等[53]使用大量样本对PCa患者的尿液进行GC-MS分析,获得了PCa患者尿液的全面挥发性代谢特征,涵盖了首次报道的大量挥发性羰基化合物。外部样本集验证具有令人满意的灵敏度、高特异度和高准确率。该研究建立了一个由6个挥发性生物标志物组成的PCa诊断小组,在外部验证中对新的PCa和对照样本进行了良好的预测。Bax等[54]还将基于尿味分析的喷墨打印氧化锌传感器用于PCa的早期检测,利用MOS对PCa患者和健康者尿液样本发出的气味进行分析,以期识别出一种特异的嗅觉指纹。在诊断准确率、灵敏度和特异度方面取得的结果(约80%)证明了喷墨MOS在PCa早期检测方面具有挑战性的潜力。
McFarlane等[8]通过训练犬的嗅觉检测PCa,通过GC-MS鉴定VOCs,并进行微生物区系分析。用犬的诊断训练神经网络对GC-MS数据进行处理,这是首次对同一尿样中的尿液VOCs和微生物种群进行分析。此外,基于电子鼻进行的气味分析与尿液样本的化学特征相结合,考虑未来开发"混合"系统是现实的,这应不同于该领域以往的研究,侧重于气味分析,并利用电子鼻分析强调的嗅觉差异。这可能侧重于识别那些引起尿液气味变化的化合物,从而简化尿液化学特征,并为发现新的、更有效的PCa特异性生物标志物提供创新途径。
胰腺癌是一种消化系统恶行肿瘤,常见的胰腺恶性肿瘤是胰腺导管腺癌(pancrpancreatic ductal adenocarcinomas,PDAC),占胰腺外分泌部所有恶性肿瘤的85%以上,且生存率低[55]。胰腺癌由于预后差,病死数(46.6万)几乎与病例数(49.6万)接近[1]。这种异常不良的预后主要是由于诊断较晚、早期转移和晚期表现,目前的胰腺癌诊断技术依赖于成像、内镜超声检查和活检对肿瘤组织学进行分级[12]。目前筛查主要应用于高危人群,通常诊断时已是晚期。
Arasaradnam等[24]证实,尿液VOCs谱的变化是一种有价值的生物流体,不仅可以区分PDAC患者和正常人,还可以区分早期PDAC和晚期PDAC。此外,Daulton等[56]以尿液为生物基质,应用两个VOC分析技术:GC-IMS和气相色谱-飞行时间-质谱(gas chromatography-time of flight mass spectrometry,GC-TOF-MS),测量了PDAC患者、慢性胰腺炎患者和健康对照组的尿液顶空,结果显示:GC-IMS和GC-TOF-MS数据都能以良好的灵敏度和特异度将PDAC与健康对照组区分开来。然而,两种分析技术区分PDAC组和慢性胰腺炎组并不明显,表明这两种情况涉及相同的生物标志物。此外,GC-IMS数据明确区分了慢性胰腺炎组和健康对照组,而GC-TOF-MS的结果较差。GC-IMS数据和GC-TOF-MS数据都无法区分PDAC和慢性胰腺炎组。此结果表明,PDAC和慢性胰腺炎组可能在尿液顶空中产生类似的VOCs分布。Blake等[21]还使用FAIMS分析尿液顶空的VOCs,将胰腺癌患者与健康对照组区分开来,结果显示,使用FAIMS分析尿液的灵敏度为91%,特异度为83%。Nissinen等[57]发现FAIMS可以根据尿液标本将胰腺癌和胰腺前期病变与健康对照组区分开来,还能从对照组中区分出胰腺癌和胰腺前期病变。但是FAIMS不能区分急性和慢性胰腺炎与胰腺癌。这首次表明,胰腺癌或胰腺前期病变患者与对照组之间的尿液VOCs存在差异。仍需要更多的研究来提高胰腺癌检测的准确率,这对于胰腺癌这一高危人群的提前筛查来说至关重要。
由于现阶段疾病早期诊断常使用的放射性检查或者组织病理学活检有一定的局限性,很多疾病早期筛查用的非侵入性工具和方法被开发出来,癌症生物标志物检测是一个很有潜力的方向,癌细胞会产生一些健康细胞在正常生理过程中不会产生的代谢物,从而进入人体体液。许多研究小组致力于识别新的生物标志物,以提高传统测试的诊断和预后准确率。他们结合不同的分析技术,用于检测和量化癌症样本与健康样本相比的代谢物水平变化。而人体尿液是常规检测中最有用的人体生物流体之一,一直是评估疾病的有用信息来源。尿液中VOSs检测是一种侵入性更小、相对准确的工具,可以在早期诊断或癌症复发时进行检测。此外,尿液中的VOCs可能会被检测到更高的浓度,因为尿液的复杂性相对较低,与血液等相比,出现的基质干扰较少,而且VOCs在排泄前也会被肾脏浓缩。这种检测疾病的方法面临多种挑战,这反映了人类疾病的复杂性,而且在筛查人群中,以生物标志物为主导的疾病检测可能需要一组标志物,而不是专注于单一标志物。
在上述癌症诊断研究中,还存在一些问题:①实验样本缺失或者是样本数量不够。②缺乏VOCs分析和数据统计处理的标准化程序,这是VOCs评估领域的一个普遍问题和富有争议的话题。③尿液中的VOCs可能因患者的癌症类型和阶段而不同,差异性很大,也有可能受到药物、食物等生活方式的影响,也可能因其遗传学环境暴露而不同。
综上所述,癌症的早期筛查还处在发展阶段,尿液VOCs分析是一个很有前景的研究领域,有可能发现新的癌症早期生物标志物。但是也存在一些挑战以及未来有可能发展的一些方向:①不同研究针对疾病诊断的尿液VOCs生物标志物是不同的,确定癌症的高度特异性的VOCs生物标志物,需要建立统一的分析平台数据库,而这需要大量样本数据,还可以通过机器学习和深度学习等方法对大量数据进行学习,以便为后续的尿液VOCs的嗅觉机器人提供更多的帮助。②由于癌症早期的VOCs生物标志物浓度太低,对于早期癌症的诊断,各种分析技术的检测极限应尽可能低;同时开发新材料,可用于有效预富集VOCs,以供质谱分析;此外,尿液VOCs的采样和释放方法应建立一个操作标准,以确保VOCs样品的均匀性和准确性,提高研究结果的再现性。③将仪器微型化,以便于携带,即时检测,同时需要保持准确率、灵敏度和特异度。通过开发最小化系统,以低功耗精确测量传感信号。考虑到采用经过训练的动物来开发大规模诊断工具的局限性,基于电子鼻来分析尿液样本的研究正在逐渐增加。
在解决了上述问题后,通过尿液VOCs检测进行疾病诊断和筛查可能会取得很大进展。
所有作者均声明不存在利益冲突



























