
回顾性分析不同类型阴道感染情况、阴道微生态特点与合并人乳头瘤病毒(HPV)感染的相关性。
采用回顾性分析的方法,统计天津中医药大学第一附属医院门诊6 056例进行阴道微生态检查的患者,筛出阴道感染并进行HPV检测的患者,统计各类型阴道感染的检出率、合并HPV感染情况及不同年龄段的感染情况。
6 056例检查者中筛出2 737例阴道感染患者,占45.2%,检出7种阴道感染类型,检出率前3位的是细菌性阴道病(BV)、外阴阴道假丝酵母菌病(VVC)、需氧性阴道感染(AV);6 056例患者中有1 843例同时进行了HPV检测,其中HPV阳性的检出率前3位的分别是BV、混合性感染、VVC;阴道感染同时合并有高危型HPV感染者中前3位分别为BV、混合性感染、BV中间型;各类型阴道感染合并HPV感染在年龄分布上有差异性,好发年龄段为31~40岁,且随年龄变化趋势特点明显。
BV与HPV感染密切相关,建议有阴道感染尤其是年龄31~40岁的BV患者同时行HPV检测,对HPV筛查和预防具有重要的临床意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
阴道感染是妇科门诊的常见疾病,具有很高的发病率和复发率,严重时对日常生活、工作、性生活和自我形象等均会产生影响,是育龄妇女痛苦和不适的常见原因。
据世界卫生组织统计,2018年全球宫颈癌新发病例约57万例,其中我国每年有10.6万新发宫颈癌病例[1]。近期欧洲及其他各地的人群人乳头瘤病毒(human papilloma virus,HPV)筛选结果证实,99.7%的宫颈癌患者均有HPV感染[2]。尤其是高危型HPV持续感染是宫颈癌发生、发展的最主要因素。阴道微生物可能在HPV的感染和持续以及随后的宫颈癌发展中发挥着极大作用[3]。
阴道感染和HPV感染存在极强关联性,尤其是细菌性阴道病(bacterial vaginosis,BV)和HPV感染呈正相关[4,5,6]。世界卫生组织和美国疾病控制与预防中心提出了阴道炎管理准则,然而,阴道感染合并HPV感染率居高不下,说明阴道感染的防治仍有待进一步加强[7]。研究显示,乳酸杆菌优势的下降和机会性病原体的过度生长是发生阴道感染的主要原因,乳酸杆菌已被证明是抵御这些病原体的第一道防线[8]。尽管有这种天然的初级防御,阴道感染还是会反复发生[9]。及时发现并阻断宫颈HR-HPV持续感染是防治宫颈癌的关键,但是由于HPV感染患者并没有明显的临床症状及体征,因此很难评估,本研究通过阴道微生态分析,了解当前常见阴道感染的情况,进一步探讨不同类型阴道感染与HPV感染的相关性,为预防和治疗阴道感染及HPV感染提供临床依据。
6056例标本均来自2019年6月至2021年9月就诊于天津中医药大学第一附属医院妇科门诊的患者,对标本检测结果进行回顾性统计分析。
阴道微生态诊断标准,依据《阴道微生态评价的临床应用专家共识》[10]判定。
阴道菌群的密集度为Ⅱ~Ⅲ级、多样性为Ⅱ~Ⅲ级、优势菌为乳酸大杆菌、阴道pH值介于3.8~4.5;BV诊断:Nugent评分≥7分,可诊断为BV;Nugent评分4~6分,可诊断为BV中间型。
外阴阴道假丝酵母菌病(vulvovaginal candidiasis,VVC)诊断:镜检发现芽生孢子或菌丝;滴虫性阴道感染(trichomonas vaginitis,TV)诊断:革兰染色阳性,较白细胞略大,形态不规则,内有食物泡,周边有大量的白细胞或上皮细胞碎片或湿片法显微镜下见到阴道毛滴虫;需氧性阴道感染(aerobic vaginitis,AV)诊断:Donders评分≥3分;菌群抑制诊断:镜检无优势菌;存在2种及以上阴道感染诊断为混合型阴道感染。
阴道微生态检查:使用无菌干棉签取阴道上1/3侧壁处分泌物,均匀涂抹在清洁载玻片上,同时点图在pH试纸上测定pH,对标本进行革兰染色和固定,在显微镜下观察。
HPV检查:临床医生充分暴露宫颈,擦拭宫颈分泌物,再将用于HPV检测的宫颈刷放置于宫颈口,转动宫颈刷取样,将其放置入保存液中,标本送病理进行HPV检测。
采用SPSS 23.0统计学软件处理数据。计数资料采用百分率(%)表示,分析各类型阴道感染、微生态、HPV感染等分组计数资料所占的比例。利用JFreeChart在线生成柱状图,分析阴道感染的检出率、HPV感染的阳性率、HPV感染的分型和年龄分布情况。
在6 056例阴道微生态检查患者中共检出阴道感染患者2 737例,检出率为45.2%,统计出7种阴道感染类型,其中检出率由高到低依次为BV 841例(13.9%)、VVC 543例(8.9%)、AV 500例(8.3%)、混合性感染356例(5.9%)、菌群抑制328例(5.4%)、BV中间型166例(2.7%)、TV 3例(0.1%),见图1。
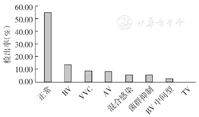

356例混合性感染中检出了11种类型,其中检出率由高到低依次为BV+VVC 140例(39.3%),AV+VVC 73例(20.5%),BV中间型+VVC 48例(13.5%),AV+BV中间型30例(8.4%),AV+BV 28例(7.9%),VVC+菌群抑制14例(3.9%),BV+TV 13例(3.7%),AV+TV 6例(1.6%),VVC+TV 2例(0.6%),BV中间型+TV 1例(0.3%),VVC+AV+BV 1例(0.3%)。
分别从pH值、菌群密集度、多样性、优势菌、Nugent评分5方面进行统计,pH值≤4.5(68.4%),密集度Ⅱ~Ⅲ级(94.1%),多样性Ⅱ~Ⅲ级(94.4%),优势菌以G+大杆菌(63.9%)为主,G-短杆菌(20.0%),G+小杆菌(9.4%),G+球菌(1.4%),G+链球菌(0.1%),其他菌(5.2%)。Nugent评分中0~3分(64.7%),4~6分(18.4%),≥7分(16.9%),见表1。
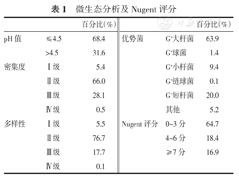
微生态分析及Nugent评分
微生态分析及Nugent评分
| 百分比(%) | 百分比(%) | ||||
|---|---|---|---|---|---|
| pH值 | ≤4.5 | 68.4 | 优势菌 | G+大杆菌 | 63.9 |
| >4.5 | 31.6 | G+球菌 | 1.4 | ||
| 密集度 | Ⅰ级 | 5.4 | G+小杆菌 | 9.4 | |
| Ⅱ级 | 66.0 | G+链球菌 | 0.1 | ||
| Ⅲ级 | 28.1 | G-短杆菌 | 20.0 | ||
| Ⅳ级 | 0.5 | 其他 | 5.2 | ||
| 多样性 | Ⅰ级 | 5.5 | Nugent评分 | 0~3分 | 64.7 |
| Ⅱ级 | 76.7 | 4~6分 | 18.4 | ||
| Ⅲ级 | 17.7 | ≥7分 | 16.9 | ||
| Ⅳ级 | 0.1 |
在6 056例阴道微生态检查患者中有1 843例患者同时进行了HPV筛查,其中HPV阳性者共390例(21.2%)。阴道微生态正常患者的HPV阳性率20.5%,阴道感染中合并HPV感染者,前3位为BV 28.4%,混合性感染22.5%,VVC 22.4%。(表2)
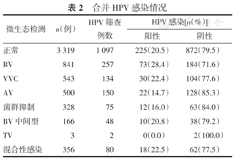
合并HPV感染情况
合并HPV感染情况
| 微生态检测 | n(例) | HPV筛查例数 | HPV感染[n(%)] | |
|---|---|---|---|---|
| 阳性 | 阴性 | |||
| 正常 | 3 319 | 1 097 | 225(20.5) | 872(79.5) |
| BV | 841 | 257 | 73(28.4) | 184(71.6) |
| VVC | 543 | 134 | 30(22.4) | 104(77.6) |
| AV | 500 | 150 | 22(14.7) | 128(85.3) |
| 菌群抑制 | 328 | 75 | 12(16.0) | 63(84.0) |
| BV中间型 | 166 | 48 | 10(20.8) | 38(79.2) |
| TV | 3 | 2 | 0(0.0) | 2(100.0) |
| 混合性感染 | 356 | 80 | 18(22.5) | 62(77.5) |
390例HPV阳性患者中高危型189例(48.5%),低危型74例(18.9%),高低危型共127例(32.6%)。阴道感染患者中以高危型感染为主,前3位分别为BV 42例(57.5%),混合性感染10例(55.6%),BV中间型5例(50.0%)。(表3)
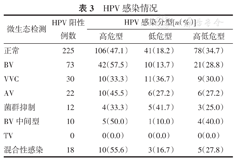
HPV感染情况
HPV感染情况
| 微生态检测 | HPV阳性例数 | HPV感染分型[n(%)] | ||
|---|---|---|---|---|
| 高危型 | 低危型 | 高低危型 | ||
| 正常 | 225 | 106(47.1) | 41(18.2) | 78(34.7) |
| BV | 73 | 42(57.5) | 10(13.7) | 21(28.8) |
| VVC | 30 | 10(33.3) | 11(36.7) | 9(30.0) |
| AV | 22 | 10(45.5) | 6(27.2) | 6(27.2) |
| 菌群抑制 | 12 | 4(33.3) | 5(41.7) | 3(25.0) |
| BV中间型 | 10 | 5(50.0) | 1(10.0) | 4(40.0) |
| TV | 0 | 0(0.0) | 0(0.0) | 0(0.0) |
| 混合性感染 | 18 | 10(55.6) | 3(16.7) | 5(27.8) |
在年龄分布上,微生态正常人群中HPV感染好发于年轻人,31~40岁比例最高,随年龄呈先升后降趋势。在阴道感染中,BV、VVC合并HPV感染较其他类型比例偏高,尤其是31~40岁的比例最高,呈随年龄先升后降趋势;混合性感染及AV合并HPV感染人群20~30岁居多,随年龄增长呈下降趋势;而菌群抑制合并HPV感染人群51~60岁居多,呈先低后高趋势,BV中间型合并HPV感染人群在40岁之前相对平稳,40岁之后随年龄下降。(表4)
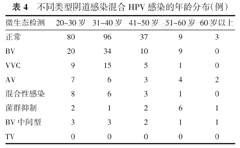
不同类型阴道感染混合HPV感染的年龄分布(例)
不同类型阴道感染混合HPV感染的年龄分布(例)
| 微生态检测 | 20~30岁 | 31~40岁 | 41~50岁 | 51~60岁 | 60岁以上 |
|---|---|---|---|---|---|
| 正常 | 80 | 96 | 37 | 9 | 3 |
| BV | 20 | 34 | 10 | 9 | 0 |
| VVC | 9 | 15 | 5 | 1 | 0 |
| AV | 7 | 6 | 3 | 4 | 2 |
| 混合性感染 | 8 | 6 | 3 | 1 | 0 |
| 菌群抑制 | 2 | 1 | 2 | 6 | 1 |
| BV中间型 | 3 | 3 | 2 | 1 | 1 |
| TV | 0 | 0 | 0 | 0 | 0 |
女性阴道微生态系统是人体微生态系统的组成之一,正常的阴道微生物菌群以乳杆菌为优势菌,与其他微生物互相共生和拮抗,共同形成结构复杂的微生态系统,阴道微生态平衡失调时,可导致阴道对致病微生物的抵抗力降低,继发感染。阴道感染是妇科常见病,近年来其发病率居高不下,同时有很高的复发率,本研究显示来就诊的患者中近45%的患者检查出阴道感染,与国内报道的阴道感染检出率一致[11,12]。在诸多地区阴道感染统计中发现BV和VVC发病率相对较高[13,14]。本研究中仍以BV和VVC多见,且混合性感染中BV+VVC的比例也相对较高。
阴道感染和HPV感染关系密切,阴道作为与宫颈相邻的器官,微生态环境对HPV感染有着非常重要的作用,是机体抵御HPV的第一道防线。诸多研究表明,阴道感染患者HPV感染的比例要高于无阴道感染者,这可能与阴道中优势菌群的紊乱、乳酸杆菌的相对丰度较低有关,组织上皮发生感染反应时,其通透性增大后产生一些对宫颈上皮细胞造成损害的物质,HPV趁机侵袭[15,16,17]。不同类型阴道感染患者之间HPV感染率也存在着明显的差异,BV患者由于阴道内厌氧菌大量繁殖,乳酸杆菌减少,阴道的酸性环境被破坏,使阴道屏障作用减弱,容易导致HPV侵入[18,19]。沈媛媛等[17]认为BV、VVC及TV的HPV感染率显著高于正常人HPV感染率,且三者间的HPV感染率差异无统计学意义。陈平莲等[20]发现BV及TV更容易感染HPV引起宫颈上皮内病变,而VVC与正常人相比差异无统计学意义。谢萍[21]认为VVC和TV合并HPV感染的比率明显高于健康人,AV和BV患者HPV感染率和正常人差异无统计学意义。本研究结果显示BV患者中HPV感染阳性率最高,占28.4%,其次是混合型感染及VVC的患者,分别占22.5%、22.4%,这与国内外研究结果一致[21,22]。
有研究报道,阴道菌群与HPV感染和宫颈癌的关系密切,低乳杆菌环境使低危型HPV感染比例增加了3~5倍,高危型HPV感染和宫颈癌的比例增加了2~3倍[23]。有学者认为增加的G-杆菌使患宫颈高/低级别鳞状上皮内瘤变疾病的风险增加近6倍以上,高级别鳞状上皮内瘤变比低级别鳞状上皮内瘤变女性中G-杆菌更为常见[24,25]。已有研究证实BV感染会增加高危型HPV感染率,高危型HPV感染可影响宫颈癌的分化程度,增加鳞癌与腺癌发生的风险[26,27]。本次回顾性分析显示BV合并HPV感染中高危型占57.5%,进一步证明BV会增加高危型HPV感染。
从年龄层面上看,各类型阴道感染合并HPV感染在年龄分布上有差异性,好发年龄段及随年龄变化趋势特点明显。BV合并HPV感染随着年龄呈先升后降的趋势,30~40岁女性比例最高,考虑这个年龄段妇女性相对活跃,阴道微环境改变,优势菌群减少,使阴道屏障功能下降,故而发病率较高,同时通过分析显示BV与HPV感染密切相关,提示30~40岁有阴道感染尤其是BV患者应建议同时行HPV检测,对HPV筛查和预防具有重要的临床意义;但AV及混合型阴道感染患者合并HPV感染后好发于30岁以下的青年女性,提示在临床诊治中更加需要关注这部分患者,及时筛查HPV和行阴道微生态检查,预防感染,及早诊治;中青年女性发生菌群抑制合并HPV感染的比例较低,而50岁以上的人群居高,考虑高龄人群阴道干涩、菌群减少、抵抗力低下等原因导致菌群抑制后合并HPV感染更可能发生,所以对于这个年龄段菌群抑制的患者要及时筛查HPV,预防宫颈癌的发生。
本研究显示,BV和VVC仍是临床中发生率较高的类型,同时提示阴道感染与HPV有相关性,因此在预防HPV感染中防治阴道感染亦关键,尤其是对BV的防治;同时也提示临床妇科医生要注重年龄段HPV的筛查,尤其是30~40岁BV患者,对HPV筛查和预防具有重要的临床意义。
所有作者均声明不存在利益冲突



























