
探讨腹膜透析患者腹透引出液中生物标志物的变化及其与腹膜小分子溶质转运速率(PSTR)的关系。
选取2014年9月29日至2018年4月26日天津中医药大学第一附属医院腹透中心70名新置管腹膜透析患者。测量不同时间点腹透引出液中生物标志物纤溶酶原激活物抑制剂-1(PAI-1)、基质金属蛋白酶-2(MMP-2)和血管内皮生长因子(VEGF)的水平以及随访2年4 h透析液/血肌(D/P)肌酐值,并考察腹透引出液中生物标志物与4 h D/P肌酐的相关性。
纵向研究显示PAI-1(P<0.001)和VEGF(P=0.04)随腹膜透析持续时间增加而增加。基线时的PSTR和随访2年时的PSTR均与基线时的PAI-1、MMP-2和VEGF水平显著相关。2年时的PSTR也与6个月时的MMP-2水平和基线时的PAI-1水平相关。
在2年期间腹膜透析患者腹透引出液中的生物标志物PAI-1、MMP-2和VEGF与PSTR呈正相关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
腹膜透析是用于终末期肾脏病的替代疗法之一。在临床实践中,最常见的腹透方案是基于葡萄糖的。研究表明长期腹透会使晚期糖基化产物在腹膜中沉积,从而导致腹膜功能和结构改变[1,2]。最常见的功能改变是腹膜小分子溶质转运速率(peritoneal small molecule solute transport rate,PSTR)升高[1]。在临床实践中,腹膜平衡试验(peritoneal equilibration test,PET)通常用于检查腹膜透析中的溶质转运速率。在先前的研究中,已经广泛检查了PET和患者预后的相关性[3]。PET的基本原理是在一定条件下获得腹透液和肌酐以及血液中葡萄糖的比例,从而确定患者腹膜转运功能的类型。然而,单次PET检查的D/P肌酐值不能充分预测腹膜转运功能,因此必须监测其变化。PET对于样品测量是步骤繁琐且费时的,因此希望在血液或腹透引出液中可以测量几种生物标志物作为腹膜透析期间腹膜损伤的补充指标。
纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor-1,PAI-1)的相对分子质量约为50 000,由多种类型细胞如内皮细胞和血管平滑肌细胞产生[4]。PAI-1是腹膜透析期间影响纤维蛋白溶解的因素之一。研究表明,腹透引出液中PAI-1和组织型纤溶酶原激活物(tissue-type plasminogen activator,tPA)的相关性不依赖于透析液中的葡萄糖水平[5]。因此,腹透引出液中的PAI-1是腹膜修复,尤其是纤维化相关的生物标志物[5]。基质金属蛋白酶-2(matrix metallo proteinases-2,MMP-2)的相对分子质量为72 000,为明胶酶,可以降解明胶、IV型胶原、纤连蛋白、层黏连蛋白、蛋白聚糖和弹性蛋白[2, 6]。MMP-2曾被报道为腹膜损伤的标志物,促进溶质转运并延缓腹膜硬化的发展[2, 6]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是指具有高肝素亲和力的同型二聚体糖蛋白,包括5种亚型[7]。VEGF诱导内皮细胞增殖,并在正常和异常的血管生成中起关键作用。VEGF产生的最强刺激来自缺血缺氧[8]。研究表明,高葡萄糖腹透液可增加腹膜细胞中VEGF的表达[9]。基于葡萄糖的腹透液影响腹膜结构与功能,假设这些影响可以用从腹透引出液中获得的多种生物标志物的浓度来表示。本研究旨在探讨腹膜透析患者腹透引出液中生物标志物的变化及其与PSTR的关系。
选取2014年9月29日至2018年4月26日天津中医药大学第一附属医院腹透中心70名新置管腹膜透析患者。纳入标准为新导管植入并接受腹膜透析治疗超过3个月,年龄>18岁且观察期内临床情况稳定的患者。排除标准为临床信息不完整者;由于死亡而在6个月内停止腹膜透析治疗,转向血液透析,肾脏移植或转移至其他医院者;晚期肝病、恶性肿瘤和研究期间发生腹膜炎者。知情同意书是在研究开始前经过各个受试者同意获得的。本研究获得高雄长庚纪念医院人类研究委员会批准(文件编号102-5925B),并且根据《赫尔辛基宣言》原则进行,所有研究对象均签署知情同意书,享有知情权。
每月测量一次血常规和生化指标的血液参数。腹膜透析开始后的第1个月进行标准PET,每6个月重复一次。残余肾功能(residual renal function,RRF)计算为24 h尿素氮和肌酐清除率的平均值,在腹膜透析开始后1个月和此后每6个月测量一次。使用Du Bois公式和患者体质量将RRF标准化为体表面积[10]。记录数据包括患者人口统计资料、糖尿病史、药物史、腹膜透析充分性和腹膜转运类别。
第1、6、24个月进行PET时,收集腹透引出液以进行MMP-2、VEGF和PAI-1的测量。所有测量均使用商业ELISA试剂盒进行。
临床结果以PSTR衡量,定义为在PET实验4 h透析液/血肌(D/P)肌酐值。4 h透析液/血肌(D/P)肌酐值,并考察不同时间点及随访2年腹透引出液中生物标志物与4 h D/P肌酐的相关性。
所有分析均使用Stata 11.0版软件进行。计量数据采用均数±标准差( ±s)表示,组间比较采用配对t检验;计数资料以例数和百分数表示。不同时间点腹透引出液中生物标志物与4 h D/P肌酐的相关性使用Pearson相关性分析。使用线性回归分析评估随访2年腹透引出液中生物标志物、协变量和4 h D/P肌酐的相关性。单变量回归分析确定单个生物标志物与每个变量的关联。此外,多元回归分析检查在调整年龄、性别、是否伴有糖尿病、是否服用血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitor,ACEi)/血管紧张素受体阻滞剂(angiotensin receptor blocker,ARB)和他汀类等协变量后不同时间点VEGF、PAI-1和MMP-2的相关性。以P<0.05为差异有统计学意义。
±s)表示,组间比较采用配对t检验;计数资料以例数和百分数表示。不同时间点腹透引出液中生物标志物与4 h D/P肌酐的相关性使用Pearson相关性分析。使用线性回归分析评估随访2年腹透引出液中生物标志物、协变量和4 h D/P肌酐的相关性。单变量回归分析确定单个生物标志物与每个变量的关联。此外,多元回归分析检查在调整年龄、性别、是否伴有糖尿病、是否服用血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitor,ACEi)/血管紧张素受体阻滞剂(angiotensin receptor blocker,ARB)和他汀类等协变量后不同时间点VEGF、PAI-1和MMP-2的相关性。以P<0.05为差异有统计学意义。
共纳入研究70名新置管腹膜透析患者,平均年龄为56.4岁,性别分布相等,使用ACEi/ARB或他汀类药物的比例相对较低,腹膜转运分类:高转运占20.3%,高平均转运为33.3%,低平均转运为31.9%,低转运占14.5%。(表1)
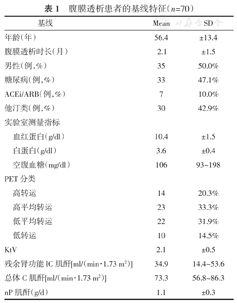
腹膜透析患者的基线特征(n=70)
腹膜透析患者的基线特征(n=70)
| 基线 | Mean | SD | |
|---|---|---|---|
| 年龄(年) | 56.4 | ±13.4 | |
| 腹膜透析时长(月) | 2.1 | ±1.5 | |
| 男性(例,%) | 35 | 50.0% | |
| 糖尿病(例,%) | 33 | 47.1% | |
| ACEi/ARB(例,%) | 7 | 10.0% | |
| 他汀类(例,%) | 30 | 42.9% | |
| 实验室测量指标 | |||
| 血红蛋白(g/dl) | 10.4 | ±1.5 | |
| 白蛋白(g/dl) | 3.6 | ±0.4 | |
| 空腹血糖(mg/dl) | 106 | 93~198 | |
| PET分类 | |||
| 高转运 | 14 | 20.3% | |
| 高平均转运 | 23 | 33.3% | |
| 低平均转运 | 22 | 31.9% | |
| 低转运 | 10 | 14.5% | |
| KtV | 2.1 | ±0.5 | |
| 残余肾功能lC肌酐[ml/(min·1.73 m2)] | 34.9 | 14.4~53.6 | |
| 总体C肌酐[ml/(min·1.73 m2)] | 73.3 | 56.8~86.3 | |
| nP肌酐(g/d) | 1.1 | ±0.3 | |
从基线(0.69)到腹膜透析2年(0.70),4 h D/P肌酐显著增加(P=0.02)。从基线到治疗6个月后,VEGF(21.6~22.2 pg/ml,P=0.04)和PAI-1(0.6~1.1 ng/ml,P<0.001)浓度显著增加。MMP-2浓度在6个月内保持不变。(表2)
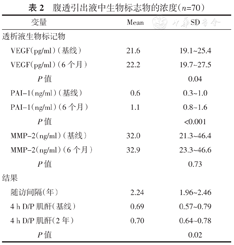
腹透引出液中生物标志物的浓度(n=70)
腹透引出液中生物标志物的浓度(n=70)
| 变量 | Mean | SD | |
|---|---|---|---|
| 透析液生物标记物 | |||
| VEGF(pg/ml)(基线) | 21.6 | 19.1~25.4 | |
| VEGF(pg/ml)(6个月) | 22.2 | 19.7~27.5 | |
| P值 | 0.04 | ||
| PAI-1(ng/ml)(基线) | 0.6 | 0.3~1.0 | |
| PAI-1(ng/ml)(6个月) | 1.1 | 0.8~1.6 | |
| P值 | <0.001 | ||
| MMP-2(ng/ml)(基线) | 32.0 | 21.3~46.4 | |
| MMP-2(ng/ml)(6个月) | 32.9 | 23.3~46.6 | |
| P值 | 0.73 | ||
| 结果 | |||
| 随访间隔(年) | 2.24 | 1.96~2.46 | |
| 4 h D/P肌酐(基线) | 0.69 | 0.57~0.79 | |
| 4 h D/P肌酐(2年) | 0.70 | 0.64~0.78 | |
| P值 | 0.02 | ||
Pearson分析显示,基线时的PSTR与基线时的PAI-1、MMP-2和VEGF浓度之间存在显著相关性,2年后的PSTR与基线时的PAI-1、MMP-2和VEGF浓度及6个月时的MMP-2水平显著相关。(表3)
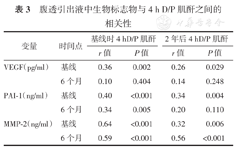
腹透引出液中生物标志物与4 h D/P肌酐之间的相关性
腹透引出液中生物标志物与4 h D/P肌酐之间的相关性
| 变量 | 时间点 | 基线时4 hD/P肌酐 | 2年后4 hD/P肌酐 | ||
|---|---|---|---|---|---|
| r值 | P值 | r值 | P值 | ||
| VEGF(pg/ml) | 基线 | 0.36 | 0.002 | 0.26 | 0.029 |
| 6个月 | 0.10 | 0.404 | 0.14 | 0.248 | |
| PAI-1(ng/ml) | 基线 | 0.40 | <0.001 | 0.34 | 0.004 |
| 6个月 | 0.34 | 0.005 | 0.20 | 0.110 | |
| MMP-2(ng/ml) | 基线 | 0.64 | <0.001 | 0.32 | 0.006 |
| 6个月 | 0.59 | <0.001 | 0.56 | <0.001 | |
在单变量分析中,基线时腹透引出液中的VEGF、PAI-1和MMP-2水平与2年后4 h D/P肌酐显著相关。除PAI-1(β=0.36,P=0.039)外,多变量分析中没有这些相关性。多变量分析显示,MMP-2在6个月时和2年后4 h D/P肌酐之间存在显著相关性(β=0.69,P<0.001)。多变量分析表明,在基线或2年时,协变量与4 h D/P肌酐均无显著相关性。(表4)
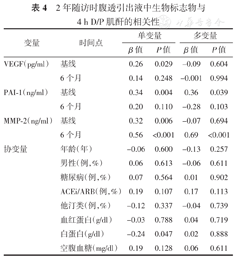
2年随访时腹透引出液中生物标志物与4 h D/P肌酐的相关性
2年随访时腹透引出液中生物标志物与4 h D/P肌酐的相关性
| 变量 | 时间点 | 单变量 | 多变量 | ||
|---|---|---|---|---|---|
| β值 | P值 | β值 | P值 | ||
| VEGF(pg/ml) | 基线 | 0.26 | 0.029 | -0.09 | 0.604 |
| 6个月 | 0.14 | 0.248 | -0.001 | 0.994 | |
| PAI-1(ng/ml) | 基线 | 0.34 | 0.004 | 0.36 | 0.039 |
| 6个月 | 0.20 | 0.110 | -0.28 | 0.103 | |
| MMP-2(ng/ml) | 基线 | 0.32 | 0.006 | -0.07 | 0.694 |
| 6个月 | 0.56 | <0.001 | 0.69 | <0.001 | |
| 协变量 | 年龄(年) | -0.06 | 0.600 | -0.13 | 0.257 |
| 男性(例,%) | 0.06 | 0.613 | -0.06 | 0.611 | |
| 糖尿病(例,%) | 0.07 | 0.564 | 0.01 | 0.902 | |
| ACEi/ARB(例,%) | 0.19 | 0.107 | 0.17 | 0.113 | |
| 他汀类(例,%) | -0.12 | 0.337 | -0.04 | 0.739 | |
| 血红蛋白(g/dl) | -0.03 | 0.788 | 0.04 | 0.719 | |
| 白蛋白(g/dl) | -0.24 | 0.047 | 0.02 | 0.888 | |
| 空腹血糖(mg/dl) | 0.19 | 0.128 | 0.06 | 0.611 | |
基于葡萄糖的腹透液会引起腹膜损伤[1,2]。腹膜改变包括纤维化、新血管生成和硬化。在过去几年中,从腹透引出液中得到的生物标志物与腹膜功能改变之间关系的研究持续更新。通常研究的生物标志物是PAI-1、MMP-2和VEGF。PAI-1和MMP-2代表与腹膜纤维化相关的生物标志物,而VEGF代表与新血管生成相关的生物标志物[4, 6, 9, 11]。本研究考查了腹透引出液中这些生物标记物在预测新置管腹膜透析患者长期PSTR中的潜力。同时还观察了新腹膜透析患者腹透6个月期间这些生物标记物的动态变化。结果显示,在6个月的腹膜透析治疗期间,腹透引出液中的PAI-1和VEGF浓度显著增加。MMP-2浓度的增加并不明显。同时,基线时的PAI-1和6个月的MMP-2在2年时与PSTR(以4 h D/P肌酐表示)显著相关。总的来说,本研究结果与先前的研究互相证实[2, 9]。研究表明,腹透液的滞留会触发局部腹膜纤维化,而较长的腹膜透析治疗会增加其浓度。这些浓度变化与腹膜中复杂的生理和病理变化有关。MMP-2和PAI-1都参与了血管生成、细胞生长,侵袭和转移等病理生理过程[12]。PAI-1主要通过在损伤部位抑制纤维蛋白溶解系统中的纤溶酶原来保护细胞,并可能逆转MMPs,从而增加MMP-2水平并增强细胞外基质降解[2, 6]。此外,MMP-2在间皮细胞由上皮向间充质转化过程中可能被上调[13]。腹膜血管生成还需要MMP-2和PAI-1才能激活和消退[14]。腹膜中的这些功能和结构改变是根据腹透引出液中生物标志物浓度的变化来表达的。
腹膜表面纤维蛋白的形成与腹膜透析患者黏连的出现有关。间皮细胞表现出与t-PA产生相关的纤溶活性。在腹部手术模型的研究中,当发生炎症反应时,整个间皮下组织中都发现了PAI-1[15]。然而,先前的一项研究并未揭示腹膜组织t-PA/PAI系统与腹膜功能特性之间的密切关系[11]。腹透引出液中PAI-1的浓度代表了纤溶的昼夜节律[5]。PAI-1浓度随腹透液中停留时间增加而逐渐升高[5]。本研究考察了过夜停留后腹透引出液中PAI-1的浓度。透析液D/P肌酐比的测量时间为4 h腹透液停留时间。采样测量中的时间差异可能与前期研究结果不一致。本研究中,这种时间效应还影响了PAI-1浓度与透析液D/P肌酐比之间的相关性。本研究发现每隔2年腹透引出液中的基线(腹膜透析治疗1个月)PAI-1与D/P肌酐比显著相关。然而,在6个月时,PAI-1浓度的相关性消失了。与MMP-2的关联测试也遇到了类似的情况。本研究发现在6个月时腹透引出液中的MMP-2与PSTR显著相关,但与基线时与MMP-2的相关性消失了。因此,将来有必要进行统一采样测量的进一步研究,以便可以清楚地证明从腹透引出液中获得的生物标志物浓度与PSTR之间的真实关系。
VEGF是新血管生成的介质。在使用基于葡萄糖的腹透液进行长期腹膜透析治疗中,腹膜中局部产生VEGF[9, 16]。研究表明,VEGF在腹膜转运中起重要作用。腹透引出液中的VEGF水平与溶质转运面积系数肌酐值和葡萄糖吸收值相关,与经毛细血管超滤负相关[9]。在另一项针对腹膜透析患者的横断面研究中,与腹膜低平均转运患者相比,高平均和高转运患者的血浆和透析液VEGF浓度增加,还证实了PSTR与血浆和透析液VEGF浓度之间的关联[1,2]。然而,VEGF的遗传多态性可能影响腹膜转运的纵向变化。与其他基因型相比,AA基因型在24 h D/P肌酐水平上表现出显著增加[17]。本研究没有发现基线和6个月间隔测量的腹透引出液中的VEGF与1年间隔的PSTR之间存在显著相关性。由于短时遗传多态性检查,本研究结果需要进一步验证以阐明这些关系。
目前的研究受到一些限制。首先,采样时间与以前的研究不同。因此,头对头比较存在差异。其次,本研究没有测量所选生物标志物的血浆浓度。因此,根据以前的研究结果,认为这些生物标志物是在腹膜局部产生的。第三,没有研究单个生物标记中遗传多态性对腹膜转运功能的影响。第四,没有在研究期间通过C-反应蛋白和白细胞介素-6等炎症标志物测试来检查个别新腹膜透析患者的炎症状态。因此,不能检查腹膜腔内炎症对腹透引出液中生物标志物浓度变化的影响。最后,样本量相对较小,可能会影响统计分析。尽管如此,本研究的优势在于记录了新置管腹膜透析患者在过去2年中的纵向腹膜溶质转运功能变化情况,并检查了腹膜透析治疗开始的前6个月期间腹透引出液中生物标志物浓度的相关性。
综上所述,就腹膜转运相关参数而言,腹透引出液中的PAI-1和MMP-2可用作新置管腹膜透析患者的生物标志物,但仍需要更深入的进一步研究来证实本研究的结果。
所有作者均声明不存在利益冲突



























