
褐藻糖胶是一种具有多种生物活性的硫酸化多糖,主要存在于褐藻的细胞壁,在海洋无脊椎动物如海参和海胆中也有发现,因其良好的抗肿瘤和免疫调节作用而被广泛研究。不仅如此,褐藻糖胶与化疗药物联合治疗肿瘤,不仅增强抗肿瘤功效,还减轻了化疗所带来的不良反应。褐藻糖胶的功能与结构、相对分子质量、硫酸基团取代度、单糖组成、藻类来源以及采集时间密切相关。从褐藻糖胶促进细胞凋亡、诱导细胞周期阻滞、抗血管生成及细胞迁移以及对免疫细胞的激活等方面综述了其抗肿瘤和免疫调节作用的研究进展,为其开发利用及临床应用提供理论指导。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
多糖是一类广泛存在于植物、动物和微生物中的多聚物,具有广泛的生物活性,尤其是抗肿瘤[1]和免疫调节[2]活性。研究表明,多糖的分子结构经过修饰,如硫酸化[3]、磷酸化[4]等可能会增强其生物学活性,Guan[5]通过硫酸化修饰苦瓜多糖,显著增强了其抗肿瘤活性。在天然或合成的生物聚合物中,硫酸化多糖是一类特殊的大分子,与未硫酸化的多糖相比具有许多新的或更强的生物活性[6]。大型藻类具有易于获得、可实现大范围养殖的特点,使其成为了多糖的重要来源[7,8]。
褐藻糖胶作为一种海洋来源的硫酸化多糖,主要存在于褐藻的细胞壁,具有多种生物活性,包括抗病毒[9]、抗氧化[10]、抗肿瘤[11]以及免疫调节[12,13,14]等。褐藻糖胶主要通过促进细胞凋亡、诱导细胞周期阻滞、抗血管生成及细胞迁移等发挥抗肿瘤功效[12]。此外,褐藻糖胶还能通过调控体内巨噬细胞、自然杀伤细胞和树突状细胞(dendritic cell,DC)等免疫细胞的激活状态对肿瘤产生免疫应答[12,13,14,15]。Zhang等[16]发现泡叶藻Ascophyllum nodosum中提取的褐藻糖胶可以通过促进DC成熟,诱导干扰素-γ(interferon-γ,IFN-γ)的分泌从而诱导辅助T细胞(helper T cell,Th)1型细胞免疫反应,清除肿瘤细胞。此外,褐藻糖胶可作为一种新型佐剂,在研制肿瘤疫苗中具有潜在的应用价值[15]。但褐藻糖胶的异质性、结构的复杂性等因素限制了其在临床上的应用。因此,本文基于褐藻糖胶的相对分子质量、硫酸基团取代度和单糖组成等影响因素,综述了褐藻糖胶抗肿瘤和免疫调节作用的研究进展,为其开发利用及在临床上的进一步应用提供理论指导。
褐藻糖胶是一种富含岩藻糖的硫酸化多糖,具有复杂的结构,含有半乳糖、糖醛酸、甘露糖和木糖。研究表明,影响褐藻糖胶抗肿瘤活性的结构因素主要是硫酸基团含量和多糖骨架的连接方式;影响抗氧化和抗凝血活性的主要因素是硫酸基团含量和多糖相对分子质量[17]。
褐藻糖胶的结构虽然复杂,但其多糖主干一般分为2种类型(图1),类型Ⅰ含有重复的(1→3)-α-L-岩藻吡喃糖,而类型Ⅱ含有交替重复的(1→3)、(1→4)-α-L-岩藻吡喃糖[18,19]。其结构的复杂性受硫酸基团取代度、相对分子质量、单糖组成、收获季节和提取方法的影响。
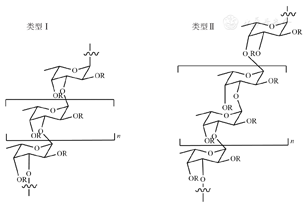

不论高相对分子质量还是低相对分子质量的褐藻糖胶都被证明具有多种生物活性,然而,高相对分子质量的褐藻糖胶阻碍了它们在医学上的应用[20],因此,低相对分子质量的褐藻糖胶受到了越来越多的关注。Yang等[21]采用温和条件水解,降低褐藻糖胶的相对分子质量,与未降解的褐藻糖胶相比,其肿瘤抑制率从37.6%上升至75.9%,证明了小分子褐藻糖胶可能具有更高的浓度以及更大的分子迁移率和扩散性。Kim等[22]从海洋细菌鞘氨醇单胞菌中分离得到一种褐藻糖胶酶,可将裙带菜Undaria pinnatifida孢子叶中提取的褐藻糖胶降解到相对分子质量1 000~4 000,并发现其具有较好的抗1型单纯疱疹病毒活性[23]。Chen等[24]也相继证明了海带Laminaria japonica中褐藻糖胶的相对分子质量>5 000,相对分子质量越小,其美白活性越好。由此可见,相对分子质量大小影响褐藻糖胶的生物学功能。
硫酸基团取代度通常被用来表示多糖分子上羟基被硫酸基团取代的程度。研究指出硫酸基团在抑制癌细胞中起主要作用,Cho等[25]通过比较不同相对分子质量褐藻糖胶硫酸化修饰后硫酸基团含量的改变,证明了处于松散的分子构象更适合硫酸基团的取代,并且发现相对分子质量较小、取代度较高的褐藻糖胶具有更好的抗癌活性。采用壳聚糖微球分离纯化得到硫酸基团取代度为0.94的褐藻糖胶,其脱硫衍生物硫酸基团取代度为0.11,抑制血管生成能力与未脱硫的褐藻糖胶相比显著下降[26]。Techel等[20]对墨角藻Fucus vesiculosus和糖海带Saccharina latissima来源的褐藻糖胶及其降解组分进行活性比较,发现褐藻糖胶与趋化因子配体12(C-X-C chemokine ligand 12,CXCL12)结合的能力随着硫酸基团取代度的增大而增强,更有效地抑制了CXCL12的趋化作用,结果表明褐藻糖胶对CXCL12/趋化因子受体4(C-X-C chemokine receptor 4,CXCR4)的干扰可以通过增加取代度来改善。由此可见,高相对分子质量褐藻糖胶聚合物可能将硫酸基团隐藏在其球形构象内,阻碍硫酸基团与癌细胞的反应[21, 25];另一方面,低相对分子质量褐藻糖胶更有可能以松散和线性的形式存在,从而更有利于硫酸基团与肿瘤细胞的相互作用[27]。
从裙带菜分离的褐藻糖胶中岩藻糖和半乳糖所占的比例很高,这种结构被认为具有更强的抗癌活性[10]。Silchenko等[28]从海洋细菌Wenyingzhuangia fucanilytica CZ1127T中鉴定出了一种褐藻糖胶内切硫酸酯酶swf5,该酶可以去除非主链上的由交替的α-(1→3)-和α-(1→4)-连接的硫酸化L-岩藻糖残基,该研究发现经swf5剪切后的褐藻糖胶抑制人结直肠腺癌上皮DLD-1细胞和人乳腺癌MCF-7细胞的集落形成效率较低。采用乙二胺四乙酸二钠从海带中提取褐藻糖胶,并采用阴离子交换色谱将其纯化为F1、F2和F3 3个组分,F1和F2中的岩藻糖和甘露糖含量明显高于F3,这与F1、F2具有更高的抗肿瘤和抗氧化活性密切相关[29]。采用阴离子交换色谱对粗品褐藻糖胶进行纯化,以不同浓度的NaCl进行洗脱发现,随着NaCl浓度的升高,硫酸基团质量分数从6.96%上升至22.78%,岩藻糖质量分数也升高了11.20%,纯化的褐藻糖胶抗肿瘤活性也随岩藻糖和硫酸基团含量的增加而增强[30]。
研究表明,不同采集时间也会影响褐藻糖胶的含量及结构。7~9月采集新西兰马尔伯勒海湾贻贝养殖场的裙带菜中提取褐藻糖胶,发现其产量在叶部和孢子叶中存在差异,孢子叶含量始终最高且其产量从7月(25.4%~26.3%)到9月(57.3%~69.9%)显著提高;提取的褐藻糖胶硫酸基团含量在同一时期增加了1倍以上,这或许与褐藻的成熟度密切相关[31]。来自英国阿伯里斯特威斯海域的齿缘墨角藻Fucus serratus、墨角藻和泡叶藻在长达1年的时间里进行逐月采集样本,发现在秋季褐藻糖胶的含量最高,春季最低;与夏季相比,冬季提取的褐藻糖胶具有更高比例的硫酸基团[32],因此秋冬季节是采样的最佳季节。了解不同季节对其产量和性质的影响,有助于明确样本采集的最佳时间,同时也可以保证样品的一致性。
癌症是威胁生命的主要疾病之一。目前,治疗癌症的药物种类繁多。化疗虽然能一定程度上控制肿瘤生长、延长患者生存周期。然而,化疗药物具有严重的不良反应。因此,亟需研制安全、高效的抗肿瘤药物,天然产物是其重要来源之一。褐藻糖胶是一种从褐藻中提取的天然硫酸化多糖,具有很好的抗肿瘤作用。(表1)
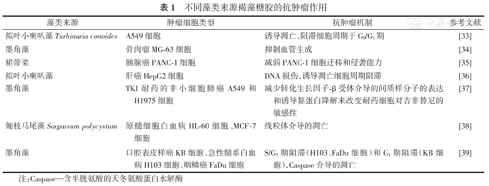
不同藻类来源褐藻糖胶的抗肿瘤作用
不同藻类来源褐藻糖胶的抗肿瘤作用
| 藻类来源 | 肿瘤细胞类型 | 抗肿瘤机制 | 参考文献 |
|---|---|---|---|
| 拟叶小喇叭藻Turbinaria conoides | A549细胞 | 诱导凋亡,阻滞细胞周期于G0/G1期 | [33] |
| 墨角藻 | 骨肉瘤MG-63细胞 | 抑制血管生成 | [34] |
| 裙带菜 | 胰腺癌PANC-1细胞 | 减弱PANC-1细胞迁移和侵袭能力 | [35] |
| 拟叶小喇叭藻 | 肝癌HepG2细胞 | DNA损伤,诱导凋亡细胞周期阻滞 | [36] |
| 墨角藻 | TKI耐药的非小细胞肺癌A549和H1975细胞 | 减少转化生长因子-β受体介导的间质样分子的表达和诱导黏蛋白降解来改变耐药细胞对吉非替尼的敏感性 | [37] |
| 匍枝马尾藻Sargassum polycystum | 原髓细胞白血病HL-60细胞、MCF-7细胞 | 线粒体介导的凋亡 | [38] |
| 墨角藻 | 口腔表皮样癌KB细胞、急性髓系白血病H103细胞、咽鳞癌FaDu细胞 | S/G2期阻滞(H103、FaDu细胞)和G1期阻滞(KB细胞),Caspase介导的凋亡 | [39] |
注:Caspase—含半胱氨酸的天冬氨酸蛋白水解酶
褐藻糖胶主要通过死亡受体与线粒体途径激活Caspase信号通路来诱导肿瘤细胞的凋亡,它主要上调B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)家族中Bcl-2蛋白相关X蛋白(Bcl-2-associated X,Bax)、Bcl-2同源拮抗剂(Bcl-2 homologous antagonist,Bak)、BH3结构域凋亡诱导蛋白(BH3 interacting domain death agonist,Bid)以及下调Bcl-2、Bcl-xL、髓系细胞白血病序列-1水平,导致线粒体的去极化使其释放细胞色素C而激活Caspase-9;褐藻糖胶与死亡受体结合激活Caspase-8,从而激活Caspase-3,诱导凋亡的发生[40]。Chen等[41]发现褐藻糖胶通过增加Bax/Bcl-2值促进非小细胞肺癌的凋亡。另外,除了通过2条经典途径诱导肿瘤细胞凋亡外,褐藻糖胶还通过Toll样受体4(Toll-like receptor 4,TLR4)调节活性氧促进内质网应激介导肺癌细胞凋亡[42]。
细胞周期控制着细胞的增殖与分裂,从而维持机体的生长与发育,在此过程中,异常的细胞增殖常与细胞周期相关蛋白(Cyclin)、细胞周期蛋白依赖性激酶(cyclin-dependent kinases,CDKs)以及一些癌基因的表达有关。而细胞周期的调控异常通常与肿瘤的发生发展密不可分。拟小叶喇叭藻中的褐藻糖胶浓度相关性地抑制HepG2的增殖与迁移[36],将细胞周期阻滞在G0/G1期[33]。褐藻糖胶呈浓度相关性地下调Cyclin D1/E和CDKs的表达,并抑制视网膜母细胞瘤蛋白(retinoblastoma protein,pRB)的磷酸化,促进pRB与转录因子E2F家族的结合而导致人膀胱癌EJ细胞周期阻滞在G1期[43]。Cho等[44]还发现褐藻糖胶除了调控周期相关蛋白的表达水平,还上调G1到S期相变检查点的负调节因子p21 WAF1,将细胞周期阻滞在G1期。
肿瘤的转移与侵袭是由原发肿瘤脱离,浸润周围间质,再通过血管或淋巴管扩散,间充质向上皮转换形成继发性肿瘤[45],其中血管形成是肿瘤转移的前提和基础,抑制肿瘤血管生成可以控制肿瘤转移[46]。Wang等[34]采用共培养体系评估了墨角藻褐藻糖胶对血管结构形成的影响,发现其通过降低血管内皮生长因子和基质细胞衍生因子-1蛋白的表达抑制血管生成。还有研究表明褐藻糖胶通过阻断膀胱癌5637细胞核因子-κB(nuclear factor kappa-B,NF-κB)和激活蛋白-1(activator protein-1,AP-1)的活化,抑制基质金属蛋白酶-9(matrix metalloprotein-9,MMP-9)的表达,从而抑制肿瘤细胞的浸润与迁移[44]。高度硫酸化的海带褐藻糖胶以剂量相关性的方式抑制血管的形成,且在100 μg/ml时使毛细血管网络完全破裂,而其脱硫酸化衍生物几乎没有抗血管生成活性,这暗示了褐藻糖胶抑制血管生成很可能与其取代度密切相关[26]。
褐藻糖胶通过调节多种信号通路发挥抗肿瘤作用,因此大量研究报导了其与多种药物协同能更有效地控制肿瘤生长。海带中的褐藻糖胶通过TLR4/C/EBP同源蛋白(C/EBP-homologous protein,CHOP)介导的Caspase-3的激活和聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)的降解以增强顺铂的抗肿瘤作用,将其抑制率提高到75%~85%[47]。新西兰裙带菜中的小分子褐藻糖胶即使在低浓度下也能以剂量相关性的方式增强核仁素抑制剂GroA对前列腺癌PC-3和DU-145细胞的抑制作用[48]。褐藻糖胶与拉帕替尼联合治疗黑色素瘤,进一步抑制酪氨酸激酶受体下游通路蛋白激酶B(protein kinase B,Akt)和NF-κB的激活,使拉帕替尼的细胞杀伤力提高了1倍,不仅增强了抑制肿瘤细胞生长的作用,还缓解了长期服用拉帕替尼所带来的不良反应[49]。
除了对肿瘤直接的杀伤作用,褐藻糖胶还能通过激活免疫系统对肿瘤进行间接清除。褐藻糖胶发挥免疫调节作用主要是通过激活促进DC成熟、刺激巨噬细胞、促进自然杀伤细胞活化等来实现的。
DC是功能最强的抗原提呈细胞,能捕获、加工抗原并将其提呈给初始T细胞,从而产生抗原特异性免疫应答。从墨角藻提取的褐藻糖胶通过上调DC细胞凋亡抑制蛋白-1(cellular inhibitor of apoptosis protein-1,cIAP-1)、cIAP-2和Bcl-xL的表达量,从而缓解5-氟尿嘧啶对DC的免疫抑制作用,同时增强DC同种异体T细胞的增殖能力[13]。巨藻Macrocystis pyrifera中的褐藻糖胶可诱导脾脏中DC成熟,且显著增加CD4+和CD8+ T细胞数量,以及IFN-γ和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的分泌[50]。墨角藻中的褐藻糖胶通过上调HLA-DR、CD80和CD86的表达,促进人外周血单核细胞来源DC(monocyte-derived DC,mo-DC)的成熟,降低mo-DC吞噬能力,并提高白细胞介素-12(interleukin-12,IL-12)和IFN-γ的分泌,从而诱导Th1型免疫反应[51]。进一步研究表明,泡叶藻孢子叶中的褐藻糖胶通过髓样分化因子88信号通路促进DC成熟及IL-12的表达,增强体内Th1及细胞毒T淋巴细胞(cytotoxic T lymphocyte,CTL)反应[16]。
巨噬细胞作为单核吞噬细胞,一旦被外界刺激激活,就会通过向周围区域释放趋化因子、细胞因子和生长因子来启动炎症反应。一氧化氮(nitric oxide,NO)的分泌是巨噬细胞活化的标志及其发挥作用的关键因子[52]。新西兰裙带菜中低相对分子质量褐藻糖胶以时间和浓度相关性的方式诱导巨噬RAW264.7细胞产生NO,促进IL-6和TNF-α的分泌[53]。褐藻Nizamuddinia zanardinii和狭叶马尾藻Sargassum angustifolium中的褐藻糖胶不仅可以刺激RAW264.7细胞分泌NO,同时也可以刺激其分泌TNF-α、IL-1β、IL-6和IL-12[54]。Tabarsa等[12]进一步研究发现,褐藻糖胶通过丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和NF-κB激活巨噬细胞并释放效应因子。
自然杀伤细胞是一群独特的天然免疫细胞,其通过类似于T细胞配体与受体相互识别的方式杀伤病毒感染的细胞或转化的细胞;自然杀伤细胞通过穿孔素/颗粒酶B的胞外释放或活化TNF受体信号等多种机制介导其细胞杀伤功能[55]。厚叶解曼藻Kjellmaniella crassifolia和裙带菜中的褐藻糖胶与黄芪多糖、党参多糖制成的复合剂,在体内外均可提高自然杀伤细胞活性和巨噬细胞吞噬指数,从而增强特异性和非特异性免疫反应[56]。50 mg/kg墨角藻褐藻糖胶可显著提高小鼠脾脏中CD3-与NK1.1+细胞的数量及比例,且显著上调细胞凝集素样受体亚家族G成员1(killer cell lectin-like receptor subfamily G member 1,KLRG1)的表达[50]。
除了对上述免疫细胞的作用以外,裙带菜中提纯的褐藻糖胶可以延缓人中性粒细胞的自发性凋亡并诱导其激活,同时还通过激活磷脂酰肌醇-3-激酶(phosphatidylinositol-3-hydroxykinase,PI3K)/Akt信号通路,促进IL-6、IL-8、TNF-α等促炎因子的释放[57]。墨角藻褐藻糖胶和支气管败血波杆菌联合与单独处理相比,可以进一步提高脾细胞的活力;小鼠体内实验发现,与单独抗原处理相比,褐藻糖胶的加入可显著促进猪肺炎分枝杆菌特异性抗体的产生[58]。Jin等[15]发现墨角藻褐藻糖胶与卵清白蛋白(ovalbumin,OVA)共同免疫小鼠,发现褐藻糖胶作为佐剂增强了体内OVA特异性抗体的产生,并激发OVA特异性的Th1和CTL反应,抑制小鼠黑色素瘤B16-OVA细胞的生长,结果表明褐藻糖胶具有作为肿瘤疫苗佐剂的潜力。
褐藻糖胶在体内外的研究中均表现出良好的抗肿瘤及免疫调节活性,其安全性对于进一步临床应用显得至关重要。初步研究表明,高相对分子质量冈村枝管藻Cladosiphon okamuranus褐藻糖胶可通过大鼠肠上皮细胞吸收,并在肝巨噬细胞蓄积,血和尿中含量较低[59]。Zhang等[60]采用FITC标记的褐藻糖胶在体内研究褐藻糖胶肠道吸收机制,结果发现空肠和回肠是褐藻糖胶主要的吸收部位,吸收峰值发生在给药后120 min。日本冲绳县居民为志愿者的实验结果表明,冈村枝管藻在人体内被消化,其中所含的褐藻糖胶被人体吸收,并且证实了其在人胃肠道转化吸收的可能性[61]。Zheng等[62]对褐藻糖胶进行首次人体评价,放射性标记的褐藻糖胶作为显像剂用于血栓成像,评估了其在健康志愿者体内的生物分布和安全性,研究显示受试者对褐藻糖胶耐受性良好,无任何药物相关不良反应。尽管这些结果都显示褐藻糖胶在体内能被较好的吸收以及具有一定的安全性,但是要进一步应用于临床,仍需深入研究褐藻糖胶体内药动学并进行毒理学评价。
不论是作为辅助性抗癌药物提高生存率,减少药物不良反应,还是作为一种新型免疫增强剂,褐藻糖胶都是一种非常有应用前景的天然来源多糖。尽管大量研究表明褐藻糖胶具有多种生物学功能,并且显示出较好的安全性,但关于褐藻糖胶在体内完整的吸收代谢路径及毒理学评价仍有待深入研究。此外,影响褐藻糖胶结构与功能的因素众多,应当系统地针对特定种属的褐藻进行研究,包括生长环境、采集样本季节、分离纯化方法、功能与结构关系等,建立标准的质量控制体系。
所有作者均声明不存在利益冲突



























