
研究CD47纳米药物联合抗程序性死亡-配体1单抗(αPD-L1)的抗肿瘤免疫治疗效果。
采用BALB/c小鼠构建4T1乳腺癌荷瘤小鼠肿瘤模型,将CD47纳米药物与αPD-L1联用,考察联合治疗对4T1乳腺癌荷瘤小鼠局部肿瘤复发肿瘤的生长体积、生存时间以及肺转移的影响,并评价其诱导的体内免疫记忆效应,包括小鼠血清中细胞因子及小鼠脾脏中效应记忆T细胞表达。
CD47纳米药物与αPD-L1联合治疗,可以有效抑制荷瘤小鼠局部肿瘤的复发,显著延长荷瘤小鼠生存时间(P<0.001)。同αPD-L1组相比,CD47纳米药物与αPD-L1联合治疗能明显提高小鼠血清中细胞因子肿瘤坏死因子-α(TNF-α)和干扰素-γ(IFN-γ)表达(均P<0.05),并明显增加小鼠脾脏中效应记忆T细胞的表达(P<0.001)。此外,4T1-Luc乳腺肿瘤荷瘤小鼠肺转移模型实验结果表明,CD47纳米药物与αPD-L1联合治疗可有效抑制肿瘤肺转移。
CD47纳米药物与αPD-L1联用可通过肿瘤杀伤、CD47免疫检查点阻断和αPD-L1免疫检查点阻断的协同作用,进一步增强免疫检查点阻断的抗肿瘤免疫治疗效果。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来,肿瘤免疫疗法越来越成为治疗恶性肿瘤的一项新策略和研究热点,尤其是免疫检查点阻断治疗(immune checkpoint block,ICB)相关的免疫治疗技术,已经在临床上取得了重大突破[1,2,3,4]。其中,免疫检查点CD47/信号调节蛋白α(signal regulatory protein α,SIRPα)和程序性死亡受体-1(programmed death receptor-1,PD-1)/程序性死亡-配体1(programmed death-ligand 1,PD-L1)分别是肿瘤细胞逃避固有免疫监视和获得性免疫监视的2个关键检查点[5,6,7,8]。同时阻断CD47/SIRPα和PD-1/PD-L1,可同时激活固有免疫和获得性免疫,实现CD47阻断和PD-L1阻断抗肿瘤免疫效应的叠加和协同,从而最大限度地利用机体自身的免疫系统抑制肿瘤生长[9,10]。
本课题组前期研究成功构建了一种基于肿瘤微环境刺激响应性的抗CD47抗体活性蛋白纳米药物,可将光敏剂药物IR820和CD47免疫检查点阻断剂共递送到肿瘤部位[11]。一方面,利用光杀伤作用引起肿瘤细胞免疫原性死亡,形成"原位肿瘤疫苗",启动机体抗肿瘤免疫应答;另一方面,通过阻断CD47介导的免疫检查点信号通路,激活抗原提呈细胞,进而将活化信号呈递给T细胞,使直接杀伤肿瘤作用和免疫检查点阻断作用有效结合,实现不同抗肿瘤效应之间的叠加与协同。在此基础上,本研究将进一步开展基于CD47纳米药物和抗程序性死亡-配体1单抗(anti-PD-L1 monoclonal antibody,αPD-L1)的抗肿瘤免疫治疗效果,期望进一步改善和提高ICB的抗肿瘤效果。
CD47纳米药物由本课题组制备,αPD-L1(美国BioXcell公司),流式抗体CD3e、CD8a、CD62L和CD4(美国eBioscience公司),肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和干扰素-γ(interferon-γ,IFN-γ)酶联免疫吸附测定(enzyme linked immune sorbent assay,ELISA)检测试剂盒(美国eBioscience公司),P1043(美国Promega公司);小鼠乳腺癌4T1、4T1-Luc细胞(国家生物医学实验细胞资源库);雌性BALB/c小鼠,6~8周,购自北京华阜康生物科技股份有限公司,许可证号为SCXK(京)2014-0004。本研究所有动物实验均遵循中国医学科学院动物实验伦理保护章程(批号RM-DWLL-2021038)。
WG153303-808nm激光器(北京能源激光),EG1150H石蜡切片机(德国Leica公司),CKX31显微镜(日本Olympus公司),Centrige 5810R多功能台式离心机(德国Eppendorf公司),BD FACSCalibur流式细胞仪(美国BD公司),2.0 T 250生物发光成像系统(美国Caliper Life Sciences公司)。
4T1细胞消化后用生理盐水重悬至2×107个/ml,选取6~8周雌性BALB/c小鼠,脱毛后在每只小鼠的后背靠右侧皮下注射50 μl肿瘤细胞悬液。当肿瘤体积达到大约50 mm3时,将小鼠随机分为4组,每组5只,分别为磷酸盐缓冲液(phosphate buffered solution,PBS)组、αPD-L1组、CD47纳米药物+激光照射组、CD47纳米药物+激光照射+αPD-L1组。PBS组小鼠尾静脉注射PBS 100 μl;αPD-L1组小鼠腹腔注射αPD-L1 200 μg,1次/3 d,共给药3次;CD47纳米药物+激光照射组小鼠尾静脉注射CD47纳米药物2.5 mg/kg,1次/4 d,共给药3次,给药后18 h,对小鼠肿瘤部位进行强度1 W/cm2,时长1 min的第1次激光照射;给药后28 h,对小鼠肿瘤部位进行强度1 W/cm2,时长5 min的第2次激光照射;CD47纳米药物+激光照射+αPD-L1组小鼠在CD47纳米药物+激光照射组的基础上腹腔注射αPD-L1 200 μg,1次/3 d,共给药3次。
第1次激光照射治疗的同时,手术切除各组荷瘤小鼠大约90%的肿瘤,切口缝合消毒。每2天测量1次小鼠的肿瘤体积,观测其复发情况,并记录小鼠的生存时间。
首次治疗30 d后,对各组荷瘤小鼠进行眼静脉取血,然后将其处死,取出脾脏并研磨过筛制成单细胞悬液,用不同荧光素标记的CD3、CD8、CD62L和CD44抗体进行染色,通过流式细胞术分析效应记忆T细胞(effective memory T cell,Tem)的比例。用ELISA检测血清中细胞因子TNF-α和IFN-γ的表达。
首次治疗30 d后,小鼠尾静脉注射4T1-Luc细胞(5×105个/只)。15 d后,各组小鼠腹腔注射生物发光成像相关底物(P1043,3 mg/只),并在注射底物15 min后脱颈处死小鼠,取出各组小鼠的肺组织进行生物发光成像,发光面积越大、发光强度越高,就说明肿瘤的肺转移越多。并对肺组织表面的白色肿瘤结节进行手动计数,之后将各组小鼠的肺组织脱水进行石蜡切片和苏木精-伊红染色(hematoxylin-eosin staining,HE),于显微镜下进一步观察各组小鼠肺部的肿瘤转移情况。
采用GraphPad Prism 5.0软件处理数据,所有实验结果均以均数±标准差( ±s)表示,组间比较采用one-way ANOVA方差分析后再采用Tukey’s多重比较分析方法,以P<0.05为差异有统计学意义。
±s)表示,组间比较采用one-way ANOVA方差分析后再采用Tukey’s多重比较分析方法,以P<0.05为差异有统计学意义。
如图1A所示,PBS组和αPD-L1组荷瘤小鼠的平均肿瘤生长体积均快速增加;尤其是PBS组在治疗30 d后,2只荷瘤小鼠的肿瘤生长体积已经超过了2 000 mm3;而CD47纳米药物+激光照射组和CD47纳米药物+激光照射+αPD-L1组在实验期间未观察到肿瘤复发情况。如图1B所示,PBS组小鼠在治疗后的第38天全部死亡,αPD-L1组小鼠在治疗后的第44天全部死亡;CD47纳米药物+激光照射组在治疗后第74天,只有1只小鼠死亡;CD47纳米药物+激光照射+αPD-L1小鼠在整个治疗期间全部存活(P<0.001)。上述结果表明,CD47纳米药物联合αPD-L1治疗可以有效抑制荷瘤小鼠局部肿瘤的复发并有效延长荷瘤小鼠的生存时间。
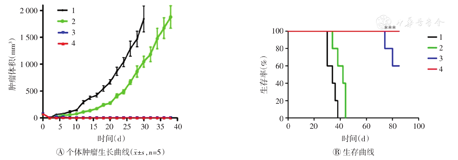

1—PBS;2—αPD-L1;3—CD47纳米药物+激光照射;4—CD47纳米药物+激光照射+αPD-L1。***P<0.001
如图2所示,与PBS组比较,αPD-L1、CD47纳米药物+激光照射和CD47纳米药物+激光照射+αPD-L1组小鼠血清中TNF-α和IFN-γ的表达水平明显升高(均P<0.05);与αPD-L1和CD47纳米药物+激光照射组比较,CD47纳米药物+激光照射+αPD-L1组血清中TNF-α和IFN-γ的表达水平明显升高(均P<0.05)。如图3所示,与PBS组和αPD-L1组比较,CD47纳米药物+激光照射+αPD-L1组小鼠脾脏中Tem细胞比例明显升高(均P<0.05)。上述结果表明CD47纳米药物联合αPD-L1治疗可有效诱导荷瘤小鼠体内的长期免疫记忆效应。
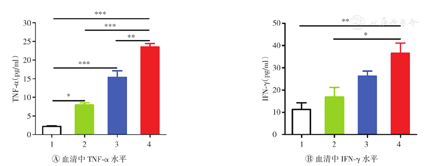
 ±s,n=3)
±s,n=3)
1—PBS;2—αPD-L1;3—CD47纳米药物+激光照射;4—CD47纳米药物+激光照射+αPD-L1。*P<0.05,**P<0.01,***P<0.001
 ±s,n=3)
±s,n=3)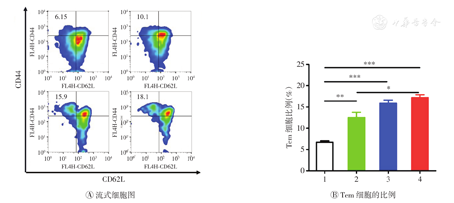

1—PBS;2—αPD-L1;3—CD47纳米药物+激光照射;4—CD47纳米药物+激光照射+αPD-L1。*P<0.05,**P<0.01,***P<0.001
如图4A所示,PBS组小鼠的肺组织几乎全部被转移的肿瘤组织占据,而CD47纳米药物+激光照射+αPD-L1组的小鼠肺组织只出现极少数转移肿瘤。如图4B所示,与PBS组比较,CD47纳米药物+激光照射+αPD-L1组小鼠肺部的肿瘤结节数量均明显减少(P<0.001);与αPD-L1组相比,CD47纳米药物+激光照射组、CD47纳米药物+激光照射+αPD-L1组小鼠肺部组织肿瘤结节数量均明显降低(均P<0.01)。HE染色结果进一步证实CD47纳米药物+激光照射+αPD-L1联合治疗有效抑制了肿瘤的肺转移(图4C)。上述结果表明CD47纳米药物联合αPD-L1治疗可有效抑制荷瘤小鼠肿瘤肺转移。
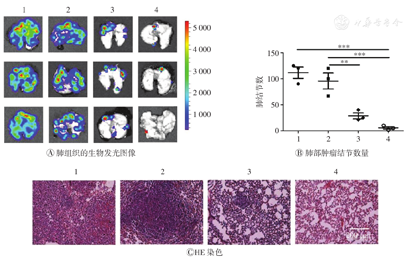

1—PBS;2—αPD-L1;3—CD47纳米药物+激光照射;4—CD47纳米药物+激光照射+αPD-L1。**P<0.01,***P<0.001
为避免由于免疫检查点抑制剂的肿瘤脱靶毒性而引起的全身性免疫不良反应等问题,保证免疫检查点抑制剂在肿瘤病灶部位的高效递送是增强免疫检查点阻断抗肿瘤疗效的关键前提之一。如通过全身给药的抗CD47抗体会引发严重的不良反应,如贫血和血小板减少,因为CD47也在红细胞表面高表达,CD47抗体的靶向而非肿瘤效应仍然限制了其临床应用[6,12]。促进ICB疗效的同时避免严重的不良反应已成为肿瘤免疫治疗领域的研究热点。纳米递药系统在免疫检查点阻断剂递送方面具有明显优势,通过构建智能响应型纳米药物载体,可有效提高免疫检查点阻断剂药物在肿瘤组织的靶向蓄积,改善药物生物利用度,避免由于免疫检查点阻断剂的肿瘤脱靶释放引起的全身性免疫相关不良反应[13,14]。
本研究利用本课题组构建的一种基于肿瘤微环境刺激响应性的抗CD47抗体活性蛋白纳米药物和αPD-L1联用,可有效抑制荷瘤小鼠局部肿瘤的复发,延长小鼠生存时间,在提高小鼠血清中细胞因子TNF-α和INF-γ表达水平的同时,可协同增强小鼠脾脏中Tem细胞的比例,进一步增强了ICB的抗肿瘤治疗疗效。
综上所述,本研究考察了CD47纳米药物和αPD-L1联用在4T1乳腺癌荷瘤小鼠肿瘤模型中抗肿瘤免疫治疗疗效,接下来将选择其他肿瘤细胞荷瘤小鼠模型,进一步考察CD47纳米药物联合αPD-L1抗肿瘤的有效性。
所有作者均声明不存在利益冲突



























