
探讨3种骨移植材料治疗牙周再生术后牙周炎的中长期临床疗效。
纳入2017年7月至2018年11月天津市口腔医院行牙周再生术的牙周炎患者16例,根据骨移植材料不同随机分为3组:脱蛋白牛骨矿物基质(Bio-Oss)组(n=6)、同种异体骨修复材料(Bio-Gene)组(n=5)和胶原基骨修复材料(Bone3)组(n=5)。比较术前、术后6个月及术后4年3组患者的临床指标及影像学指标的变化。
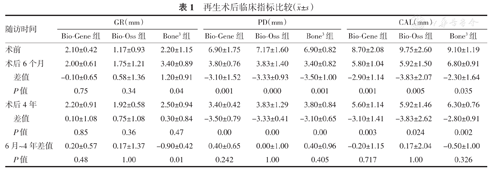
术后6个月、4年,3组患者的探诊深度(PD)和临床附着丧失(CAL)较术前均明显降低(均P<0.05),PD的变化(ΔPD)和CAL的变化(ΔCAL)组间比较差异均无统计学意义(均P>0.05);术后6个月、4年,3组患者的牙龈退缩(GR)较术前差异均无统计学意义(均P>0.05),GR的变化(ΔGR)组间比较差异均无统计学意义(均P>0.05)。术后6个月~4年,ΔGR、ΔPD及ΔCAL组间比较差异均无统计学意义(均P>0.05)。术后6个月、4年,3组患者的剩余牙槽骨高度(RBH%)较术前均明显升高(均P<0.05),其变化组间比较差异均无统计学意义(均P>0.05);术后6个月~4年,RBH%变化组间比较差异均无统计学意义(均P>0.05)。
3种骨移植材料治疗牙周再生术后牙周炎的临床疗效显著,可为临床再生材料的选择提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
牙周炎是与微生物相关的炎症性疾病,临床表现主要是牙龈的炎症及牙周附着丧失,最终引起牙齿的松动甚至脱落。牙周炎也是一种十分常见的口腔疾病,我国第四次口腔流行病学报告提示我国牙周健康状况不容乐观,35~74岁成年人牙周炎患病率可达33%~74%[1],是困扰成年人牙齿健康、造成其咀嚼效率降低的首要因素。牙周炎亦是一个全球性的健康问题,重度牙周炎占全球范围内成年人群的10%,并已成为全球第6大高发的疾病[2]。对于牙周疾病的预防与治疗,一直是牙科医生努力的方向。目前,牙周治疗的目的不仅在于消除炎症、阻止牙槽骨进一步吸收,保存天然牙列,提高患者的咀嚼效率,同时修复和再生被破坏的牙周支持组织,甚至恢复其原有的形态和功能,也是牙周治疗追求的目标。
伴有垂直骨吸收和深牙周袋患牙的再生治疗一直是一个临床挑战。1982年Nyman等[3]第1次使用屏障膜维持牙周组织再生的空间以促进成骨干细胞、成牙骨质干细胞和成牙周膜干细胞的长入,在组织学方面证实了引导组织再生术(guided tissue regeneration,GTR)的有效性,随后GTR技术广泛应用于临床。但使用胶原膜作为屏障膜时,胶原膜常向组织缺损区塌陷,影响牙周组织再生的效果。此时,在骨缺损区植入骨移植材料同时联合使用屏障膜,可以更好地维持牙周组织再生空间,获得更好的临床效果[4,5,6]。骨移植材料根据来源不同,有多种成品可供临床使用。各种材料在使用时表现出不同的特点,如愈合方式不同等,这种结果的出现可能与材料的理化性能有很大关系[7]。
脱蛋白牛骨矿物基质(Bio-Oss)与可吸收生物膜(Bio-Gide)胶原膜是GTR联合牙周植骨术常采用的骨移植和屏障膜材料。随着材料的发展,我国自主研发的同种异体骨修复材料(Bio-Gene)和胶原基骨修复材料(Bone3)骨移植材料已广泛用于骨引导组织再生。Bio-Gene是一种脱细胞异体骨修复材料,Bone3是含有I型胶原的羟基磷灰石复合支架植材料。本研究主要评价3种不同来源的骨移植材料Bio-Gene、Bone3和Bio-Oss治疗牙周再生术后牙周炎的中长期临床效果,为临床骨移植材料的选择提供更多的可能性。
选取2017年7月至2018年11月天津市口腔医院行牙周再生术的牙周炎患者18例,男性10例,女性8例,年龄(39.8±8.7)岁。所有患者和家属均知情并签署同意书。根据骨移植材料不同随机分为3组:同种异体骨修复材料(Bio-Gene)组(n=5)、脱蛋白牛骨矿物基质(Bio-Oss)组(n=8)和胶原基骨修复材料(Bone3)组(n=5)。牙周手术采用局麻下沟内切口,进行翻瓣清创,术中对于牙槽骨缺失的类型再评估,只有2壁及3壁骨袋,同时骨袋深度≥3 mm的牙齿纳入试验。术中植入相应的骨材料后,覆盖Bio-Gide胶原膜,缝合。术后2周拆线。Bio-Oss组有2名患者因全身情况和更换居住地无法复诊而失访。最终共有16名患者纳入4年的长期随访研究。每名患者选取1颗牙作为研究对象,采取双盲的原则,完成手术治疗,并做好牙周清洁,维护口腔卫生,术后6个月、4年进行随访。Bio-Gene组纳入前牙1颗,前磨牙2颗,磨牙2颗,Bio-Oss组纳入前牙1颗,前磨牙2颗,磨牙3颗,Bone3组纳入前牙1颗,前磨牙2颗,磨牙2颗;3组纳入的骨缺损类型均为2壁或3壁骨袋,且位于牙齿的邻面;Bio-Gene组、Bio-Oss组、Bone3组的平均骨缺损深度分别为(5.4±2.30)、(4.0±0.63)、(4.8±0.84)mm,差异无统计学意义,具有可比性。
术后6个月及4年复诊,进行牙周临床指标包括探诊深度(probing depth,PD)、临床附着丧失(clinical attachment loss,CAL)和牙龈退缩(gingival recession,GR)检查。具体测量方法与本课题组前期研究中方法相同[8]。
影像学检查采取数字化根尖片的方式,测量目标牙位的剩余牙槽骨高度(residual alveolar bone height,RBH%),即近中(或远中)牙槽嵴顶到根尖点的距离占牙根长度的比值。RBH%的测量方法参考文献[9]中方法。
观察3组患者不良反应的情况。
采用SPSS 21.0统计学软件处理数据,符合正态分布的计量资料以均数±标准差( ±s)表示,组内比较采用配对t检验,组间比较采用方差分析,组间差异比较采用秩和检验,以P<0.05为差异有统计学意义。
±s)表示,组内比较采用配对t检验,组间比较采用方差分析,组间差异比较采用秩和检验,以P<0.05为差异有统计学意义。
术后6个月、4年,3组患者的PD和CAL较术前均明显降低(均P<0.05),PD的变化(ΔPD)和CAL的变化(ΔCAL)组间比较差异均无统计学意义(均P>0.05);术后6个月、4年,3组患者的GR较术前差异均无统计学意义(均P>0.05),GR的变化(ΔGR)组间比较差异均无统计学意义(均P>0.05)。术后6个月~4年,ΔGR、ΔPD及ΔCAL组间比较差异均无统计学意义(均P>0.05)。(表1)
再生术后临床指标比较( ±s)
±s)
再生术后临床指标比较( ±s)
±s)
| 随访时间 | GR(mm) | PD(mm) | CAL(mm) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Bio-Gene组 | Bio-Oss组 | Bone3组 | Bio-Gene组 | Bio-Oss组 | Bone3组 | Bio-Gene组 | Bio-Oss组 | Bone3组 | |
| 术前 | 2.10±0.42 | 1.17±0.93 | 2.20±1.15 | 6.90±1.75 | 7.17±1.60 | 6.90±0.82 | 8.70±2.08 | 9.75±2.60 | 9.10±1.19 |
| 术后6个月 | 2.00±0.61 | 1.75±1.21 | 3.40±0.89 | 3.80±0.76 | 3.83±1.40 | 3.40±0.82 | 5.80±1.04 | 5.92±1.50 | 6.80±0.91 |
| 差值 | -0.10±0.65 | 0.58±1.36 | 1.20±0.91 | -3.10±1.52 | -3.33±0.93 | -3.50±1.00 | -2.90±1.14 | -3.83±2.07 | -2.30±1.64 |
| P值 | 0.75 | 0.34 | 0.04 | 0.001 | 0.000 | 0.001 | 0.001 | 0.005 | 0.035 |
| 术后4年 | 2.20±0.91 | 1.92±0.58 | 2.50±0.94 | 3.40±0.42 | 3.83±1.29 | 3.80±0.84 | 5.60±1.14 | 5.92±1.46 | 6.30±0.76 |
| 差值 | 0.10±1.08 | 0.75±1.08 | 0.30±0.84 | -3.50±0.79 | -3.33±0.41 | -3.10±0.65 | -3.10±1.41 | -3.83±2.62 | -2.80±0.91 |
| P值 | 0.85 | 0.36 | 0.47 | 0.00 | 0.00 | 0.00 | 0.003 | 0.024 | 0.002 |
| 6月~4年差值 | 0.20±0.57 | 0.17±1.37 | -0.90±0.42 | 0.40±0.65 | 0.00±1.00 | 0.40±0.96 | -0.20±1.15 | 0.17±2.04 | -0.50±1.00 |
| P值 | 0.48 | 1.00 | 0.01 | 0.242 | 1.00 | 0.405 | 0.717 | 1.00 | 0.326 |
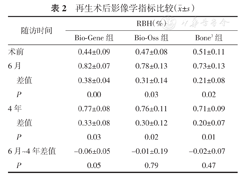
如表2所示,术后6个月、4年,3组患者的RBH%较术前均明显升高(均P<0.05),其变化组间比较差异均无统计学意义(均P>0.05);术后6个月~4年,RBH%变化组间比较差异均无统计学意义(均P>0.05)。图1显示,术后6个月、4年,3组患者骨缺损区均可见新骨形成,且可在4年时维持稳定。
再生术后影像学指标比较( ±s)
±s)
再生术后影像学指标比较( ±s)
±s)
| 随访时间 | RBH(%) | ||
|---|---|---|---|
| Bio-Gene组 | Bio-Oss组 | Bone3组 | |
| 术前 | 0.44±0.09 | 0.47±0.08 | 0.51±0.11 |
| 6月 | 0.82±0.07 | 0.78±0.13 | 0.73±0.13 |
| 差值 | 0.38±0.04 | 0.31±0.14 | 0.21±0.08 |
| P | 0.00 | 0.03 | 0.02 |
| 4年 | 0.77±0.08 | 0.76±0.11 | 0.71±0.09 |
| 差值 | 0.33±0.08 | 0.30±0.12 | 0.20±0.07 |
| P | 0.03 | 0.02 | 0.01 |
| 6月~4年差值 | -0.06±0.05 | -0.01±0.19 | -0.02±0.07 |
| P | 0.05 | 0.79 | 0.47 |
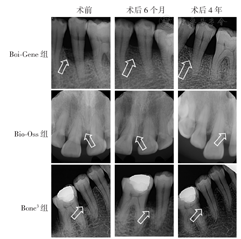

箭头指示纳入研究骨缺损区域
术后应用3种骨移植材料伤口愈合良好,无感染及伤口开裂,术后肿胀及疼痛情况均可耐受,无明显的不良反应。
牙周治疗后持续存在的深牙周袋显著增加了后期患牙脱落的风险[10]。通过手术治疗能够更好地改善牙周袋深度、附着丧失水平及牙槽骨的吸收,能够显著改善患牙的预后[11]。手术中对于骨下袋牙周缺损部位,牙周再生手术是骨下袋牙周缺损的首选治疗方案。牙周组织再生的研究中,虽然近些年的热点依然在组织工程方向[12,13],但其临床应用现阶段仍未实现。因此,为拟行再生治疗方案的牙齿选择一种合适的再生材料以达到理想的再生效果,依然是临床医师关注的问题[14]。
本研究主要评价了牙周再生术中植入不同骨移植材料Bio-Oss、Bio-Gene和Bone3后长期随访的临床疗效,观察牙周的临床指标及影像学指标变化,为临床治疗提供更多选择。结果发现:3种植骨材料在牙周再生术后,PD减少3.00~3.33 mm,CAL改善2.80~3.83mm,GR的改变在0.1~0.75,表明3种骨移植材料对于牙周垂直骨缺损均有良好的长期效果。
Bio-Oss作为一种成熟的骨移植材料,具有骨引导作用,其来源为小牛骨。Bio-Oss联合Bio-Gide为目前临床较常用的再生方式[15],且常作为一个标准来评价新型骨材料的再生效果。本研究中,4年后,应用Bio-Oss组,GR增加(0.75±1.08)mm,PD减小(3.33±0.41)mm,CAL减少(3.83±2.62)mm,剩余牙槽骨高度RBH%增加(0.30±0.12)%,且与6个月比较差异无统计学意义,表明其具有良好的远期稳定性。临床研究显示,在慢性牙周炎患者治疗中,使用小牛骨进行牙周骨缺损再生术后5~7年,牙周PD及CAL得到明显改善[16,17]。Górski等[18]研究了15名侵袭性牙周炎患者的30个1~3壁骨袋的牙周缺损位点的再生手术效果。采用Bio-Oss与Bio-Gide进行牙周植骨术联合引导组织再生术后3~5年PD减少(3.9±1.2)mm,CAL增加(4.8±1.7)mm,获得了明显的临床效果。
脱矿冻干骨(demineralized freeze dried bone allografts,DFDBA)是一种经过冷冻、干燥并脱钙处理的同种异体骨[19]。Bio-Gene是一种商品化的国产脱细胞异体骨修复材料,研究表明DFDBA是一种优良的骨移植材料[20,21]。Katuri等[22]的一项临床对照研究表明,与生物活性玻璃相比,DFDBA可获得更好的再生疗效。Kumar等[23]发现,在牙周垂直骨缺损区域,植入DFDBA与小牛骨相比,2种骨移植材料均可明显改善临床指标,影像学上也可观察到显著的骨再生。本研究结果显示,术后4年时Bio-Gene组的PD、CAL及RBH%的变化与Bio-Oss组相比差异无统计学意义,表明Bio-Gene是一种可靠的再生骨材料,可获得稳定的远期效果。对于DFDBA使用过程中是否加入血小板浓缩物,各类报道结果不一[24,25,26],并没有明确定论。
Bone3是含有Ⅰ型胶原的羟基磷灰石复合支架植材料,具有无细胞、无免疫原性和无菌无毒的特点。牙周再生术后4年,Bone3组的PD、CAL及RBH%均有明显改善,与Bio-Gene组和Bio-Oss组差异无统计学意义。虽然成品化羟基磷灰石表现出了良好的成骨性能,但其成分单一、降解效率低,仍有很大的改进空间。近些年,人们通过对纯相羟基磷灰石进行化学合成,如碳酸化[27]等,或与其他材料组合,如聚乳酸-羟基乙酸共聚物[28]、壳聚糖[29]等来提高材料的成骨性能。但是复合材料应用于临床治疗,依然有很多的问题需要解决,如其安全性能等。
在植骨材料中加入生长因子,如成纤维生长因子-2(fibroblast growth factor-2,FGF-2)[30]、骨形态发生蛋白-2(bone morphogenetic protein-2,BMP-2)[31]等,或将再生材料与种子细胞[32,33]相结合来促进牙周组织再生,依然是研究的热点及重点,但由于生长因子的释放及干细胞体内应用的生物安全性仍没有解决,限制了临床应用。
综上所述,在现有的技术及条件下,3种来源的骨移植材料在术后4年均可获得稳定的牙周临床效果,可为今后临床医师再生材料的选择提供一定的参考。现阶段国产材料的大样本临床研究数据缺乏,该研究虽然样本数量较少,但随访4年的数据也可为今后大样本的临床研究奠定基础。将继续对现有病例进行更加长远的追踪观察比较,为材料的使用及选择提供更多的临床循证实践依据。
所有作者均声明不存在利益冲突



























