
原发性肝癌是全球第6大常见癌症和第3大癌症死亡原因,以肝细胞癌为主要发病类型。肝细胞癌发病隐匿,早期无特异性症状,当患者出现临床相关症状时,往往已处于癌症中晚期。因此,大部分患者在确诊时就已经错失了根治性治疗的机会,导致复发率和转移率高、预后效果差。目前肝癌的治疗方法越来越多,光热疗法作为一种新兴的肿瘤治疗方式,因其微创、成本低、效率高、不良反应少和靶向性强等受到人们广泛关注。主要对光热疗法及其协同疗法治疗肝细胞癌的研究进展进行综述,旨在探索肝细胞癌治疗的新思路和策略。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
原发性肝癌是全球第6大常见癌症和第3大癌症死亡原因,约有90.6万新发病例和83万例死亡病例,而肝细胞癌占病例的75%~85%[1]。肝癌的传统治疗方式包括手术切除、消融和化疗靶向免疫等,但并发症多、不良反应严重,不能显著改善患者的生存质量,且5年生存率仅为18%左右[2],因此迫切需要适用范围广、不良反应小的治疗方式。
光热疗法是一种基于纳米医学的新兴肿瘤治疗方式,因其微创、效率高、不良反应少、靶向性强和可重复治疗等优点进入人们视野。其基本原理是将光热转换剂(photothermal agent,PTA)运输到肿瘤组织内部,通过近红外激光(near-infrared,NIR)辐射,将光能转变为热能,使肿瘤组织内局部升温,从而特异性杀死肿瘤细胞。PTA在NIR照射下吸收光子的能量,从基态单重态活化为激发单重态,随后经历一种非辐射形式的衰变-振动弛豫,通过PTA与周围分子之间的碰撞又返回基态,动能的增加使周围微环境升温产生热效应[3]。温度增量的强度和持续时间决定温度诱导的细胞损伤水平,不同温度还能对肿瘤细胞产生不同影响[4]。当组织温度升至41 ℃,细胞的跨膜扩散速率提高,血流速度加快,机体会产生热休克蛋白,来抵抗轻微热损伤;温度升至42 ℃时,组织会发生不可逆损伤;温度在42~46 ℃维持10 min就可导致细胞坏死;若温度继续升高至46~52 ℃,形成的微血管血栓会造成组织缺血,使细胞迅速死亡;当组织温度>60 ℃,细胞几乎瞬间死亡[3]。
PTA主要有3个特性要求:一要有良好的光热转换效率,二要有高生物相容性,三须有易功能化特性,可以在其表面修饰药物、光敏剂等。目前PTA已发展了4代,第1代是以Au、Ag、Pt为代表的贵金属纳米颗粒,其具有很高的光热转换效率和成像能力,但价格昂贵;第2代是以石墨烯、碳纳米棒为代表的碳类材料,其光热转换面积较大,但近红外区吸收能力差;第3代是以CuS、ZnS为代表的金属与非金属化合物,具有光热性能高、成本低和制备方便等特点,但其通常为非荧光且缺乏肿瘤靶向消融能力;第4代是以吲哚菁绿、普鲁士蓝和半导体催眠素等为代表的有机及无机纳米材料,其中第3代和第4代均为目前研究的热点[5,6]。
光热疗法分为传统光热疗法(≥ 45 ℃)和温和光热疗法(mild photothermal therapy,MPTT),此2种方法各有利弊,近年来MPTT应用愈加广泛。光热疗法对肿瘤热消融的效率高,但由于PTA在体内的全身分布以及激光治疗过程中暴露不精确,可能会对正常组织造成严重损害。MPTT可以避免对正常组织、脉管系统和宿主抗肿瘤免疫的非特异性损伤,但其本身的抗肿瘤作用有限,通常需与其他疗法联合应用,以达到治疗肿瘤的目的[7]。目前多将光热疗法作为一种调控机制来参与肝癌的多学科综合治疗。常见光热疗法及其协同疗法见图1。
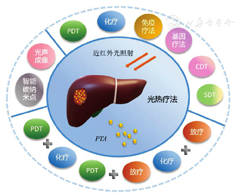

SDT—声动力学疗法;CDT—化学动力学治疗;PDT—光动力疗法;PTA—光热转换剂
光动力疗法(photodynamic therapy,PDT)需要光敏剂、分子氧和光3种组分参与,机制是肿瘤内光敏剂的局部激活,产生活性氧诱导细胞毒性作用及化学损伤,从而导致肿瘤细胞死亡[3]。光热疗法和PDT的联合应用不仅可以提高PDT光热增强的效率,还可以诱导协同作用来加速肿瘤内血液的流动,导致更多的氧气进入肿瘤,从而提高活性氧杀伤肿瘤细胞的效率[8]。
Li等[9]采用吲哚菁绿(indocyanine green,ICG)、姜黄素(curcumin,Cur)和二硫化钼(molybdenum-disulfide,MoS2)成功合成ICG&Cur@MoS2纳米颗粒,P-糖蛋白在肝癌细胞中高度表达,是肿瘤治疗的障碍之一,Cur对P-糖蛋白有抑制作用,实验表明ICG@MoS2+NIR组肿瘤明显小于MoS2+NIR组,ICG&Cur@MoS2+NIR组细胞活力显著低于ICG@MoS2+NIR组,ICG&Cur@MoS2纳米颗粒不仅能实现光热疗法/PDT,仅有较低毒性,还能有效抑制P-糖蛋白,增强PDT效应,在肝癌的治疗中具有巨大的潜力。
Li等[10]采用聚(丙烯酰胺-co-丙烯腈)[poly(acrylamide-co-acrylonitrile,P(AAm-co-AN)]、金纳米棒(gold nanorods,AuNRs)、二氧化铈(cerium dioxide,CeO2)、二氢卟吩e6(chlorin e6,Ce6)和脱镁叶绿酸a(pheophorbide A,PA)制备出新型纳米颗粒P(AAm-co-AN)-AuNRs@CeO2-Ce6(PA/Ce6),AuNRs使纳米颗粒具有高效的光热转换能力来实现光热疗法,温度变化可控制释放Ce6,Ce6在660 nm激光照射下产生单线态氧来实现PDT,Ce2在NIR照射下可分解过氧化氢来缓解肿瘤的厌氧微环境。体外600、880 nm NIR同时照射肝癌HepG2细胞后,细胞活力和迁移能力下降,动物实验表明PA/Ce6有优异的肿瘤抑制作用且无急性生理毒性。这些结果表明PA/Ce6在肝细胞癌治疗中具有良好的应用前景。
光热疗法联合化疗可以通过光热效应产生多种协同治疗效果,如增加药物在肿瘤部位的蓄积和在肿瘤组织中的渗透、促进药物在靶点的释放及增强药物的细胞毒性作用等[11]。廉爽等[12]通过水热法制备的纳米MoS2具有良好的光热转换性能、高阿霉素(doxorubicin,DOX)负载率及pH感应性药物控释能力。负载DOX后的MoS2-DOX纳米复合物在近红外光照射下对肝癌HuH-7细胞的抑制率高达92.09%,抑制效果明显高于单一光热疗法或化疗。
Gong等[13]将三甲酰胆酸(thyrocalcitonin,TCA)和叶酸(folic acid,FA)接枝在Fe3O4修饰的氧化石墨烯(graphene oxide,MGO)上,制备出一种新型杂化纳米材料MGO-TCA-FA,并成功地负载了DOX,载药量为1 040 mg/g,形成MGO-TCA-FA@DOX复合纳米材料。体内外实验证明,该纳米药物载体能特异性靶向肝癌细胞,具有显著的杀伤作用,而且光热疗法/化疗协同治疗抑瘤率约为85%,显著高于单一疗法。MGO-TCA-FA@DOX纳米材料具有多种肝癌靶向性、多因素触发释药、高载药率、优益的光热转化性能和良好的生物相容性,为光热疗法/化疗协同治疗肝癌提供了良好的平台。
光热疗法使大量肿瘤细胞死亡,其裂解释放的细胞碎片和肿瘤相关抗原触发免疫反应,抑制了肿瘤的生长和转移[14]。然而,许多研究表明仅由光热疗法诱导的免疫刺激是不够的,可以联合应用免疫佐剂和/或免疫抑制剂。加载有免疫佐剂的光热转化剂可以显著改善肿瘤中免疫细胞的浸润与成熟,并成倍增加外周血中免疫相关细胞因子。而免疫抑制剂可以阻断抗肿瘤免疫负调节信号,提高光热疗法的治疗效果。
Cheng等[15]采用安丝菌素P3(ansamitocin P3,AP3)、AuNCs和抗程序性死亡-配体1(anti-programmed cell death 1-ligand 1,anti-PD-L1)研究开发了治疗肝细胞癌的多功能金纳米囊纳米载体AP3-AuNCs-anti-PD-L1。这种基于AuNCs的纳米载体以anti-PD-L1为平台,产生肿瘤相关抗原并控制AP3的释放来刺激树突状细胞成熟,从而导致T细胞的活化和肿瘤细胞的特异性靶向,最终产生免疫原性肿瘤微环境,加强了免疫效应。Lu等[16]设计了一种基于pH敏感型负载小干扰RNA(small interfering RNA,siRNA)的层状双氢氧化物多功能纳米平台。激光照射后层状双氢氧化物产生的热效应改变了"冷"肿瘤微环境,增强了核受体亚族2,F组第6号成员(nuclear receptor subfamily 2, group F, member 6,NR2F6)-siRNA和抗PD-L1协同的免疫疗法。结果表明,这种多功能纳米平台显著抑制照射原发肿瘤和非照射远处肿瘤的生长,由局部治疗刺激的免疫反应还可以使整个身体建立长期免疫记忆,从而抑制肿瘤转移。这种NR2F6基因消融/光热疗法介导的抗PD-L1免疫增强方法能将免疫治疗的益处扩展更大,且该研究被认为是靶向表面和细胞内免疫检查点的概念验证,补充了现有的肝癌免疫疗法。
基因治疗是通过修饰或操纵基因的表达从而改变活细胞的生物学特性以达到治疗目的。但核酸易被生物酶降解,在进入靶细胞时面临诸多障碍,基因载体可以保护治疗核酸不被酶降解,并将其运送至靶细胞内[17]。修饰后的PTA可以作为基因载体,被细胞内化后在NIR照射下产生热量,使核内体迅速破裂,不仅可以杀伤肿瘤细胞,还能够提升基因转染效果。
Yan等[18]采用金纳米团簇(gold nanoclusters,AuNCs)、聚乙烯亚胺(polyethylenimine,PEI)、微小核糖核酸(microRNA,miRNA)和透明质酸(hyaluronic acid,HA)通过层层自组装技术成功构建了一种新型AuNCs/PEI/miRNA/HA复合物,通过HA受体介导的内吞作用实现miRNA的靶细胞内传递。此复合物不仅有效提高了基因传递效率,在miRNA被干扰的情况下还能调节基因表达。与单一疗法相比,激光照射复合物能对肝细胞癌产生更好的治疗效果。Liu等[19]采用半乳糖(galactosemia,GAL)、金纳米棒(gold nanorods,GNR)和siGPC-3基因首次研究开发了一种新的多功能纳米结构GAL-GNR-siGPC-3。体外实验证实GAL-GNR-siGPC-3可以有效地将siRNA传递到肝细胞癌细胞中,诱导GPC-3基因沉默,并起到抑制肿瘤细胞增殖、生长、侵袭和转移的作用。此外,在NIR照射下GAL-GNR表现出强大的杀伤肿瘤细胞能力。研究表明GAL-GNR-siGPC-3同时诱导靶向GPC-3基因沉默和光热效应,对肝癌的治疗具有协同效应,其作为一种新型试剂在临床上有极大潜力。
化学动力学疗法(chemodynamic therapy,CDT)是一种新的癌症治疗策略,用金属纳米颗粒催化内源性过氧化氢,在弱酸性的肿瘤微环境下引发肿瘤细胞芬顿或类芬顿反应,产生羟基自由基等来杀死肿瘤细胞[20]。但CDT主要受限于在体内应用时芬顿反应的效率不高,而光热疗法可以使局部升温来提高肿瘤微环境的温度,两者协同治疗不仅可以补偿光穿透不足导致的光热疗法效率的限制,还能提高芬顿反应的效率[21]。
Dang等[22]采用水凝胶(hydrogel,Gel)、海藻酸钠(sodium alginate,SA)和氧化铜(CuO)开发了3D打印水凝胶支架Gel-SA-CuO,CuO纳米颗粒可以作为储层,在酸性条件下释放Cu2+,通过类芬顿反应产生细胞内活性氧,CuO还可作为光热剂产生热量,进一步提高类芬顿反应效率。此外,释放出的Cu2+导致谷胱甘肽耗竭和谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)失活,进而诱导铁死亡,来杀伤癌细胞。在切除部位植入该水凝胶支架可抑制肝癌术后复发,为消除癌症术后复发提供了新的见解。
Yang等[23]采用新型钒(V)、氧化铁[Iron(III) oxide,ION]和纳米颗粒(VIO)合成了V-ION-VIO,其负载索拉非尼(sorafenib,SF)构成VIO/SF,并在VIO/SF上偶联转铁蛋白(transferrin,TF)形成TVIO/SFD纳米制剂。VO基纳米制剂对肝癌细胞有显著的抑制作用,可诱导类芬顿反应使细胞凋亡及铁死亡,还具有高光热转换效率,NIR激活的TVIO在小鼠肝癌肿瘤模型中表现出显著肿瘤清除效果。在实验中VIO不仅显示出抗血管生成的潜能,还可作为性能优异的MRI探针,获得高分辨率的诊断图像。这种VIO纳米平台结合了CDT、光热和诊断能力,是治疗和诊断肝癌的潜在候选药物。
声动力疗法(sonodynamic therapy,SDT)是由PDT发展而来,但其组织穿透性更强,作用机制是由低频超声激发聚集在肿瘤内的声敏剂而产生的活性氧来杀死肿瘤细胞[24]。肝细胞癌的高抗氧化性使SDT的效率减弱,在高热条件下肿瘤细胞可能会改变SDT的敏感性。Li等[25]研制了一种pH敏感型的基于croconaine染料(CR)的自组装glypican 3(GPC3)结合肽(GBP)染料即CR-PEG-GBP,其可在第二近红外(NIR-II,1 000~1 700 nm)成像和光声成像引导下进行肝癌的光热疗法/SDT协同光声消融治疗。CR-PEG-GBP分子在肝细胞癌中主动靶向定位后,由于酸性肿瘤微环境引发的亲水-疏水转化,该分子在原位自组装成大尺寸纳米颗粒,这极大提高了肿瘤内粒子的保留率,并增强了治疗肝癌的光声消融效率。该研究为肝癌治疗提供了一种简单而有效的解决方案,且CR-PEG-GBP探针的合成过程简单、临床应用潜力巨大。
除了上述双协同疗法外,光热疗法三模协同疗法也有最新的研究进展,其可凭借更多疗法互补协同增强抗肿瘤疗效。Wang等[26]采用叶酸(folicacid,FA)、金纳米三角片(gold nanotriangle,GT)、介孔二氧化硅颗粒(mesoporous silica nanoparticles,MSNs)和替拉扎明(tirapazamine,TPZ)研制出Janus结构的FA-GT-MSNs@TPZ纳米颗粒,FA受体靶向配体增强肝癌细胞内化Janus纳米平台,具有辐射敏感性和光热毒性,pH敏感释放其负载的低氧激活前体药物替拉扎明,协同增强抗肿瘤作用。实验证实Janus纳米平台在体内外均有体外放射增敏、局部光热治疗和低氧特异性化疗联合抗肿瘤作用,且不良反应低,有望用于肝癌的低氧激活放疗、化疗及光热疗法协同治疗。
Liu等[27]采用天冬氨酸(aspartic acid,RGD)、聚乙二醇(polyethylene glycol,PEG)、聚丙烯酸(polyacrylic acid,PAA)、甲硝唑(metronidazole,MN)和液态金属(liquid metal,LM)研究制备出RGD-PEG-PAA-MN@LM纳米颗粒,这些复合纳米颗粒在体内外均可在酸性条件下降解,具有高生物相容性。MN可以增强对缺氧肿瘤组织的辐射敏感性,在近红外和X射线连续辐射下,复合纳米颗粒产生更多的活性氧,能更显著地杀死肿瘤细胞。在荷瘤小鼠的体内实验中,2次近红外和X射线处理14 d后RGD-PEG-PAA-MN@LM的肿瘤抑制结果明显优于液态金属颗粒组,表明此复合纳米颗粒的协同效应显著,可以为光热疗法、PDT和放疗联合治疗肝癌提供一种独特的方法。
Yu等[28]设计合成了牛血清白蛋白(bovine serum albumin,BSA)包覆的锌酞菁(zinc phthalocyanine,ZnPc)和索拉非尼(sorafenib,SFb)纳米粒子ZnPc/SFb@BSA,ZnPc在近红外区域呈现强吸收带可进行光热疗法/PDT治疗,SFB能显著抑制肝细胞癌的转移。结果表明,ZnPc和SFB的比例为4:1时可能提高三联疗法的疗效,减少SFB的不良反应。经730 nm激光照射后,ZnPc/SFB@BSA在体外可显著抑制肝癌细胞的增殖和转移,促进细胞凋亡,而静脉注射ZnPc/SFB@BSA显著减少了裸鼠原位异种移植肝癌模型中的肿瘤生长。此纳米粒子还具有低毒和良好的血液相容性,为肝癌的治疗提供了一种协同的PDT/光热疗法/化疗系统。
碳纳米点具有高效近红外吸收/发光特性的,Zhang等[29]采用柠檬酸和双氰胺一锅水热法制备了一种具有pH感应特性的智能碳纳米点,其可以区分肿瘤细胞与正常细胞,被用于选择性光热治疗。将智能碳纳米点与细胞一起培养,它们能高度内化在细胞溶酶体中。在酸性(pH 4.7)条件下,表面质子化产生静电吸引易使智能碳纳米点(约5 nm)聚集成团(约20 nm甚至更大);pH值相对较低的肝癌细胞,会使智能碳纳米点聚集更剧烈。聚集的智能碳纳米点会在较长的波长(450~900 nm)下形成强吸收,并具有更高的光热转换率(42.13%)。在这些智能纳米材料的辅助下,强光热消融(8 min、509.6 mW/cm2)能致癌细胞的死亡率达82%,而对正常细胞的损伤则只有6.35%。智能碳纳米点还可以通过更大的捕光效应来提高肿瘤的光热效应。该研究提供了一种基于智能碳纳米点的分辨肿瘤与正常细胞的选择性光热疗法策略,极大提高了光热疗法的安全性。
光声成像在NIR-II窗口具有高的时空分辨率和光学分子灵敏度,与传统的光学成像方法相比,其在获取生物组织的微米级、功能和代谢信息方面更有优势。南方医科大学和香港城市大学联合研究的双模态NIR-II PAI/T2-MRI性能优异的多功能靶向纳米平台,将NIR-II PAI与T2-MRI结合。PAI与传统的MRI结合而成的双模式成像可以克服各自的局限性,发挥协同优势,实现卓越的光学对比度、较高的时空分辨率和软组织分辨率的互补优势,尤其对早期肝癌的精确诊断和影像学引导下的光热疗法有价值[30]。其研制的多功能靶向有机-无机杂化纳米探针GPC-3具有更好的肝细胞癌特异性、可靠的稳定性和生物相容性,在NIR-II PAI和T2-MRI中具有较高的成像对比度,可被合成为一种敏感且高效的肝细胞癌特异性造影剂。
光热疗法及其协同疗法治疗肝癌已经显示出杀伤肿瘤细胞的高效性、协同互补能力及良好的生物相容性等优点,是很有应用前景的新模式。但光热疗法及其协同疗法的效果与纳米材料的性质相关,在纳米颗粒上仍有一些亟需解决的问题,如纳米载体化疗药物时,由于载体材料的限制,存在载药量低、药物比例不可调、疗效单一和耐药等缺点,有时还会出现光热破坏化疗药物等问题;纳米粒子在血液中易出现免疫清除、沉降等现象;系统的靶向性及安全性仍需提高。虽然目前纳米材料及不同的光热协同治疗策略不太完善,但不可否认这些光热疗法的新模式具有巨大的潜力,可以成为传统肝癌治疗策略的重要补充。
所有作者均声明不存在利益冲突



























