
建立铁蛋白-普鲁士蓝纳米材料(ferritin-PB NPs)的制备方法,并探究其光热转换性能和对肿瘤细胞的光热杀伤效果。
首先通过沉淀法制备普鲁士蓝纳米材料(PB NPs),随后负载于铁蛋白空腔结构中,构建得到ferritin-PB NPs。采用红外光谱和紫外可见分光光谱测试ferritin-PB NPs中的成分组成,采用动态光散射仪和透射电子显微镜测试ferritin-PB NPs的尺寸及形貌,通过热成像仪测试ferritin-PB NPs的光热升温效果及光热稳定性效果,通过激光共聚焦显微镜观察ferritin-PB NPs在HeLa细胞和HepG2细胞中的摄取效果,并通过MTT实验测试ferritin-PB NPs对HeLa细胞的光热杀伤效果。
ferritin-PB NPs的形貌为铁蛋白内部包覆PB NPs的复合结构,可响应730 nm激光辐照迅速将光能转化为热能,导致测试溶液温度明显升高。ferritin-PB NPs能迅速被HeLa细胞和HepG2细胞摄取,并且在730 nm光照条件下抑制HeLa细胞的增殖。
通过简便的方法制备了ferritin-PB NPs,具有良好的生物相容性和光热细胞毒性效果,后期有望用于体内肿瘤治疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
光热疗法通过将光转化为热,改变癌细胞的环境,从而导致细胞死亡,由于其微创性和高效性,近年来在癌症治疗中引起了广泛关注[1,2,3]。理想的光热剂应在近红外区(650~950 nm)具有强吸收、低毒且表面易于修饰靶向基团。据报道,许多无机纳米材料如金纳米颗粒[4,5,6]、金属(Cu、W、Mo)硫化物[7]及碳纳米材料[8]可高效吸收近红外区光并显示出良好的光热治疗效果。然而,这些光热剂在临床应用中面临诸多缺点,如合成条件苛刻、制备原料非常昂贵,尤其是生物相容性低。其他光热剂,包括小分子有机光热剂(卟啉、酞菁和IR780)[9,10]、共轭聚合物(聚吡咯和聚多巴胺)[11,12]也得到了广泛的研究。但此类材料面临着严重的光漂白、合成过程复杂和血液循环时间短等其他问题。最近普鲁士蓝纳米粒子作为新一代光热剂引起了广泛关注。基于普鲁士蓝的材料可以通过在酸性条件下将[Fe(CN)6]−与Fe3+溶液混合而非常容易制备且成本非常低[13]。普鲁士蓝材料由于具有与阳离子紧密结合的能力,使其成为解决某些重金属阳离子中毒的有效解毒剂。目前,普鲁士蓝已经获美国食品药品监督管理局批准作为用于治疗铊或放射性铯中毒患者的药物,这无疑证明了普鲁士蓝具有出色的生物相容性和生物安全性[14,15,16]。普鲁士蓝纳米材料在近红外区域显示出非常高的摩尔消光系数,仅略低于金纳米材料和远高于碳纳米材料[17,18]。然而普鲁士蓝纳米材料难以用靶向配体进行修饰,这会导致材料的非特异性结合并降低治疗效果[19,20]。因此,现阶段迫切需要开发将普鲁士蓝纳米材料靶向递送至癌细胞的方法。
铁蛋白是广泛存在于多种生物体中的一种相对分子质量为450 000的铁储存蛋白,包含24个多肽亚基组成,由重(H)链和轻(L)链组成,其对应相对分子质量分别为21 000、19 000[21]。铁蛋白本身为内、外腔直径约8、12 nm的球形结构。铁蛋白的空腔在生理条件下可负载多达4 500个铁原子,并可以充当合成无机纳米粒子的纳米反应器。据报道,铁蛋白可以通过转铁蛋白受体1与人体细胞结合。而转铁蛋白受体1在许多肿瘤细胞中过表达,因此该受体可以被用作癌症治疗或诊断的靶向位点。当pH值降低到3.0左右时,铁蛋白的球形结构会分解,而当pH值回到7.0左右时蛋白质会重新形成球形结构[22]。铁蛋白的这种特性使其已被用作合成纳米颗粒的模板,目前,金纳米颗粒、稀土上转换纳米颗粒和量子点等多种材料均可通过铁蛋白模板法制备,并且具有良好的生物兼容性[23,24,25]。本研究开发了一种铁蛋白-普鲁士蓝纳米材料(ferritin-Prussian blue nanocomposites,ferritin-PB NPs)的制备方法,ferritin-PB NPs可用于靶向光热疗法,表现出很好的光热稳定性和光热转换性能,在近红外激光照射下对癌细胞具有很强的靶向杀伤能力。
肝癌HepG2细胞和宫颈癌HeLa细胞(中科院生物化学与细胞生物学研究所),FeCl3·6H2O(上海皓鸿生物医药科技有限公司),柠檬酸(上海麦克林试剂有限公司),K4[Fe(CN)6](上海麦克林试剂有限公司),马脾铁蛋白(Sigma-Aldrich试剂有限公司),异硫氰酸酯-罗丹明B(上海源叶生物科技有限公司);Optima 5300DV电感耦合等离子体原子发射光谱仪(美国Pekin-Elmer公司),INVENIO傅立叶变换红外光谱仪(瑞士Bruker公司),UV-1800紫外可见分光光度计(日本岛津公司),Zetasizer-Nano动态光散射粒径分析仪(英国Malvern公司),TiX650热成像分析仪(美国Fluke公司),JEM-1400透射电子显微镜(日本电子株式会社),LSM 900激光共聚焦显微镜(德国Zeiss公司)。
将FeCl3·6H2O(5.4 mg,1 mmol)溶解在20 ml水中,然后在溶液中加入柠檬酸(98 mg,0.5 mmol)。然后在溶液中加入K4[Fe(CN)6](8.4 mg,1 mmol)和柠檬酸(98 mg,0.5 mmol)。将混合物在60 ℃搅拌约30 min,然后让混合物冷却至室温。将等体积的丙酮加入混合物中后,离心反应混合物以除去沉淀,用丙酮洗涤3次,得到PB NPs。然后将其分散在水溶液中以保持稳定性,因为干燥的PB NPs将很难再次分散在水中。通过电感耦合等离子体原子发射光谱仪测定PB NPs在水溶液中的浓度。
将马脾铁蛋白溶液(50 μl,50 mg/ml)加入到氯化钠水溶液(5 ml,0.15 mol/L)中,随后加入K4[Fe(CN)6](2 ml,0.5 mmol/L)。然后加入稀盐酸(2 mol/L),将溶液的pH值调至3.0~3.2,溶液逐渐变浑浊。继续搅拌反应混合物30 min后,加入Na2CO3溶液(2 mol/L)将pH值缓慢调回6.5,溶液又变清。透析提纯反应混合物(截留相对分子质量为3 000)。混合物以5 000 r/min离心10 min(离心半径47.7 mm,温度25 ℃),然后除去沉淀,收集上清液并保存在4 ℃避光环境中。采用红外光谱和紫外可见分光光谱测试ferritin-PB NPs中的成分组成,采用动态光散射仪和透射电子显微镜测试ferritin-PB NPs的尺寸及形貌。
铁蛋白溶液中逐滴加入Na2CO3溶液(2 mol/L),将体系pH值调至8.5。然后将异硫氰酸酯-罗丹明B溶解在无水N,N-二甲基甲酰胺中,质量浓度为10 mg/ml,并以10∶1的质量比将异硫氰酸酯-罗丹明B与铁蛋白混合,避光搅拌过夜。反应结束后,透析提纯反应粗产物得到罗丹明B标记的铁蛋白。随后PB NPs的包封过程与未经罗丹明B标记材料的制备方法相同。
首先制备PB NPs和ferritin-PB NPs溶液(普鲁士蓝等效质量浓度10 mg/ml),用730 nm激光(功率1.5 W/cm2)照射,并用热成像仪记录溶液的温度变化。纳米材料能够实现有效的光热治疗的另一关键性决定因素是材料本身的光热稳定性,评价实验为通过用730 nm激光(功率1.5 W/cm2)照射样品溶液500 s后关闭,冷却500 s,共重复4个循环周期,并用热成像仪记录溶液的温度变化。
罗丹明B标记的ferritin-PB NPs在肿瘤细胞中的摄取实验通过激光共聚焦显微镜进行观察。取生长对数期的HepG2细胞和HeLa细胞分别重悬成细胞悬液(2×105/ml),并分别接种于玻底共聚焦显微镜测试培养皿中,孵育过夜使细胞贴壁后,将培养基替换为含罗丹明B标记的ferritin-PB NPs (普鲁士蓝等效质量浓度为35 mg/L)的完全培养基,孵育6 h后,置于激光共聚焦显微镜下观察罗丹明B标记的ferritin-PB NPs在不同肿瘤细胞中的摄取情况。
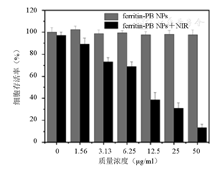
ferritin-PB NPs的细胞毒性通过MTT实验评价。无光照条件下的细胞毒性实验操作为:将对数生长期的HeLa细胞制备成细胞悬液(5×104 /ml),并将细胞悬液转移至96孔板中,每孔100 μl,将96孔板放入培养箱内孵育过夜使细胞贴壁。然后,弃去旧细胞培养液,加入含有梯度质量浓度(0、1.56、3.13、6.25、12.5、25.00、50.00 μg/ml)ferritin-PB NPs的细胞培养液。继续孵育24 h后,每孔加入20 μl MTT溶液(5 mg/ml),继续孵育4 h后,取出96孔板,弃去培养液,每孔加入200 μl二甲基亚砜,测定每孔在570 nm处的吸光度(A)值,计算细胞存活率。光照条件下的细胞毒性实验操作为:加入含有梯度浓度ferritin-PB NPs的细胞培养液6 h后,将96孔板置于730 nm激光(功率1.5 W/cm2)下辐照10 min,然后继续孵育至24 h后测定细胞存活率。
如图1所示,ferritin-PB NPs的制备是基于铁蛋白本身的pH-响应的解构重组特性,在pH 3.1环境下铁蛋白结构解体并与普鲁士蓝纳米颗粒结合,并在pH 6.2条件下重组形成纳米颗粒。
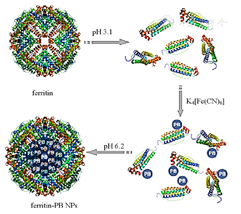

ferritin—铁蛋白;ferritin-PB NPs—铁蛋白-普鲁士蓝纳米材料
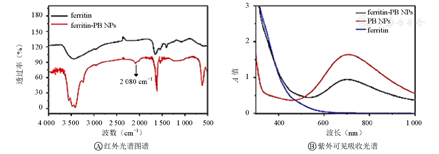
如图2A所示,相比于铁蛋白,ferritin-PB NPs的红外光谱图谱在2 080 cm−1处出现1个新的吸收峰,归属于Fe-C-N-Fe的特征结构。如图2B所示,在ferritin-PB NPs的紫外可见吸收光谱中同时出现属于铁蛋白和PB NPs的特征吸收。红外光谱和紫外可见吸收光谱结果均证实所制备得到的材料中包含铁蛋白和PB NPs 2个关键组分。

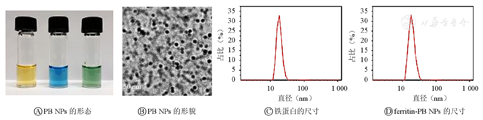
如图3A所示,铁蛋白溶解在水中为黄色透明溶液,PB NPs的溶液呈蓝色,制备得到的ferritin-PB NPs溶液表现为深绿色。透射电子显微镜图像(图3B)表明,ferritin-PB NPs表现出PB NPs被包裹在铁蛋白腔中的形貌结构。动态光散射仪检测结果表明铁蛋白和ferritin-PB NPs的直径分别约为16、18 nm(图3C、图3D),进一步证实ferritin-PB NPs可形成并单分散,大小与铁蛋白相似的纳米结构。

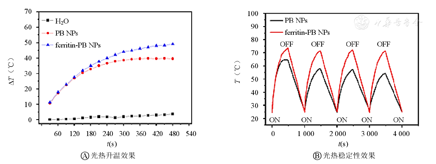
如图4A所示,光照下溶剂水没有表现出明显的光热效果,说明没有光热剂存在下,单独照射溶剂引起的升温效果几乎可以忽略。而含有普鲁士蓝组分的PB NPs、ferritin-PB NPs均表现出明显的升温趋势,PB NPs在10 mg/L下经光照后温度可升高到64 ℃,ferritin-PB NPs在相同质量浓度下光照后温度可以达到74 ℃,结果表明,ferritin-PB NPs可在730 nm激光照射下有效地产生热能,并且比PB NPs具有更好的光热转换能力。如图4B所示,ferritin-PB NPs在辐照-自然冷却4个循环周期中,温度曲线的趋势几乎不变,最高温度差变化在2 ℃以内。而PB NPs在4个循环周期中的最高升温温度出现了逐渐下降的趋势,这可能是由于PB NPs包含在铁蛋白腔中时受到铁蛋白外壳的保护而减少与环境中水分子相互作用的可能性,抑制了材料的水解过程,因此可实现多个循环光照周期内稳定的光热转换效果。

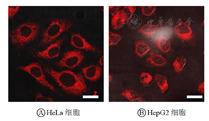
罗丹明B标记的ferritin-PB NPs与HeLa细胞和HepG2细胞共孵育后可观察到细胞质内有明显的罗丹明标记的荧光信号(图5)。如图6所示,在无光照条件下所有测试浓度的ferritin-PB NPs与HeLa细胞共孵育24 h后,细胞存活率都在90%以上,表明ferritin-PB NPs材料本身的生物安全性好,对细胞没有明显的潜在毒性。然而在光照后,所有测试组的细胞存活率均出现了下降,而且下降程度与材料浓度之间有明显的正相关性,进一步表明所制备的ferritin-PB NPs可以作为高效的肿瘤光热剂。


本研究利用铁蛋白pH响应的特殊性质,成功地设计和制备了ferritin-PB NPs用作肿瘤光热剂。相比于未经修饰的PB NPs,ferritin-PB NPs表现出更好的光热转换效果,且在肿瘤细胞中有明显的细胞摄取效果。在不施加外部光照的条件下,ferritin-PB NPs的细胞毒性可忽略不计,在经近红外光照射后,ferritin-PB NPs可以表现明显的肿瘤细胞杀伤效果。ferritin-PB NPs的成功构建提供了一种简便制备肿瘤光热剂的方法,可为开发安全高效的肿瘤光热疗法提供思路,后期有望应用于体内肿瘤治疗。
近年来,肿瘤光热疗法逐渐受到关注。其发挥作用的前提是寻找一种优秀的光热剂,尤其是有选择性地富集在肿瘤区域,并且可以快速温升以杀死癌细胞。本研究利用铁蛋白pH响应的特殊性质,通过将铁蛋白与多孔性黑素粒子普鲁士蓝纳米颗粒结合,构建出了一种新型的肿瘤靶向光热剂ferritin-PB NPs。其中,铁蛋白是一种在体内普遍存在的蛋白质,且在肿瘤组织中表达量较高。普鲁士蓝组分则是一种可以转换光能为热能的材料,具有良好的光热效应。通过这种设计,ferritin-PB NPs可以实现肿瘤细胞中的有选择性富集。而且,在未经光照的情况下,ferritin-PB NPs的细胞毒性可忽略不计,更加安全。然而,在接受近红外光照射的情况下,ferritin-PB NPs会受到光的激发而释放出热能,从而快速升温。实验证明,在与未经修饰的PB NPs相比较时,ferritin-PB NPs表现出更好的光热转换效果,可更快速地将光能转化为热能。且在肿瘤细胞中,ferritin-PB NPs的细胞摄取量高,说明其在肿瘤治疗中具有良好的潜力。
所有作者均声明不存在利益冲突



























