
制备负载中药三七的壳聚糖/明胶水凝胶复合止血材料(PN/CMC/GMs),并对其性能进行评价。
利用冷冻干燥法制备PN/CMC/GMs,利用扫描电镜观察其形态,流变仪观察其流变学性能,溶胀测试其吸水膨胀率,细胞毒性实验检测其生物相容性,并利用SD大鼠肝脏出血模型检测其快速止血效果。
制备了PN/CMC/GMs,呈网格状结构,具有一定的孔隙率。随着三七粉含量的增加,PN/CMC/GMs的模量也相应的增加,机械强度增加。PN/CMC/GMs具有较好的吸水膨胀功能,可形成压迫止血和浓缩血液实现快速止血,且具有良好的生物相容性。止血实验表明,PN/CMC/GMs对大鼠肝脏损伤的止血时间和止血效果均优于空白对照组。
PN/CMC/GMs具有良好的止血效果和生物相容性,具有进一步研究的价值和临床应用前景。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
出血是人们日常生活或诊疗中可能发生的严重事件,其可由外伤、手术、先天性疾病或药物等引起。据统计,约30%的死亡是由于身体严重受伤时失血过多造成的[1]。研究表明,过量失血是创伤患者死亡的首要因素,是导致外伤患者死亡、致残和致畸的主要原因,并给社会带来巨大经济负担[2,3]。因此,有效止血是挽救生命的重要举措之一。
止血材料作为一类能快速处理各类出血的敷料,越来越受到临床医生的重视,高效的止血材料对于挽救患者生命具有重要意义[4,5,6]。止血敷料的研究与应用仍是当前世界各国研究的重要课题[7]。水凝胶是一类能够吸收大量水分而保持完整形态的物质,其易经过修饰而实现功能化[8,9],可见水凝胶在止血领域具有明显优势。明胶是作为美国食品药品监督管理局批准的安全材料,有良好的生物相容性、降解性和可修饰性,并且廉价实用,常被用于作为水凝胶类止血材料的组织工程支架[10]。
目前,已有多种天然材料联合明胶用于止血材料研发,其中壳聚糖由于其特有的正电性可以促进血红细胞和血小板的黏附进而加速凝血,常被用于止血敷料中[11]。研究表明壳聚糖-明胶可作为药物的载体控制药物释放[12],并具有一定的止血效果。Huang等[13]制备的明胶/羧甲基壳聚糖水凝胶敷料具有止血作用,也具有促进肉芽组织形成和促进伤口愈合的效果。然而,壳聚糖和明胶仍有一定应用局限性,如壳聚糖的止血效率偏低等,不能完全满足所有急救情况的需求。因此,探索并研制性能更加优良的新型快速止血材料仍是当前临床的迫切需求。三七作为我国特产的传统中药具有多种活血止血成分,已被广泛用于临床外科止血[14,15,16],但是其直接应用存在不易附着、易被冲散的缺点。因此,本研究将三七粉载于壳聚糖-明胶复合水凝胶,制备成一种新型止血材料即中药三七的壳聚糖/明胶水凝胶复合止血材料(chitosan/gelatin hydrogel composite hemostatic materials loaded with Panax notoginseng,PN/CMC/GMs),其不仅能吸水膨胀压迫止血、增加血液黏稠度促进血液凝固,还能发挥三七粉的止血功能,实现高效止血。
成纤维3T3细胞购自中国科学院细胞库,吸收性可溶止血材料购自青岛中惠圣熙生物工程有限公司,明胶(上海源叶生物科技有限公司),壳聚糖、醋酸(上海麦克林科技有限公司),三七细粉(云南白药),细胞增值-毒性检测试剂盒(cell counting Kit-8,CCK-8,货号CA1210)、活死细胞染色试剂盒(货号CA1630)、胎牛血清、DMEM、磷酸盐缓冲液(phosphate buffered solution,PBS)、双抗(青链霉素混合液100×)均购自Solarbio公司。
冷冻干燥机(宁波新芝生物科技股份有限公司),场发射扫描电子显微镜(德国Carl Zeiss公司),HAAKE MARS60型流变仪(德国HAAKETechnik公司),Spectra MAX M2多功能酶标仪(美国Molecular Devices公司),TCS-SP8激光共聚焦显微镜(德国Leica公司)。
40只8周雄性Sprague-Dawley(SD)大鼠,体质量200~220 g,由北京维通利华实验动物技术有限公司提供,实验动物生产许可证号SCXK(京)2022-0006,实验动物质量合格证号SCXK(京)2021-0011。动物实验由北京大学人民医院动物伦理委员会批准(批准号2021PHE067)。
称取100 mg壳聚糖,溶解在10 ml含有1%醋酸水溶液中。搅拌12 h,待壳聚糖完全溶解。然后加入1 g明胶,于60 ℃水浴中搅拌12 h,形成水溶液。冷却至室温溶液不在流动形成水凝胶。然后在溶液中加入100 mg三七粉,使其溶解在水凝胶的前驱体溶液中,常温下制备成含1%三七粉的混合溶液。通过以上步骤分别溶解成含3%、5%三七粉的混合溶液。将混合溶液倒入塑料皿中先在−80 ℃条件下低温冻存,经过冷冻干燥后获得PN/CMC/GMs。
称取100 mg水凝胶前驱体水溶液,冷却至室温形成水凝胶。将水凝胶放于冷冻干燥72 h。取出水凝胶粘贴在托盘上喷金,于扫描电镜中观察形貌。分别测量含1%、3%、5%三七粉的水凝胶,并分析其孔隙率。
放于相应的模具制备流变样品,在流变仪(直径25 mm)上进行水凝胶的流变学测试,测量全部样品,2个板的缝隙固定在1 000 µm;在1%应变下,以0.1~100 rad/s进行频率扫描表征。在频率为6.283 rad/s时,测定应变0.1%~125%的模量变化。
将制备好的1.00 g水凝胶放入表面皿中,加入5.00 g去离子水,每5 min取出水并称重,然后再加入新鲜的去离子水,直到水凝胶吸收水分破裂。按以下公式计算水凝胶的膨胀率。
膨胀率(%)=(Wi-Wd)/Wd×100%
其中Wi是位移时间i处的水凝胶重量,Wd是水凝胶的原始重量。
通过CCK-8试剂来检测三七粉的细胞存活率从而判定细胞毒性。首先制备不同含量三七粉的样品溶液。将成纤维3T3细胞以1.0×104个/孔的密度接种到96孔培养板中,置于37 ℃、5% CO2的培养箱中分别培养24、48 h,更换培养基,并加入CCK-8染色试剂,孵育4 h后用酶标仪在450 nm波长下测量每个孔的吸光度(A)值,以PBS作为阴性对比,重复3次,每次6个样品,按以下公式计算细胞存活率。
细胞存活率(%)=(As-Ab)/(Ac-Ab)×100%
其中As为具有细胞、CCK-8液和水凝胶的A值;Ab为具有CCK-8液而没有细胞的A值;Ac为具有细胞、CCK-8液而没有水凝胶的A值。
将水凝胶制备于细胞培养皿中心,在室温下冷却。灭菌后,将3T3细胞接种于形成的水凝胶表面(4×104个)。使用Calcein-AM/PI双染色试剂盒评估细胞活力、黏附和细胞形态。第1、4、7天,观察前分别用PI染色(死细胞,红色荧光)和Calcein-AM染色(活细胞,绿色荧光)进行共聚焦观察并记录。
本实验将SD大鼠随机分为6组:空白对照组及0%、1%、3%、5% PN/CMC/GMs组和阳性组(吸收性可溶止血材料),每组10只。麻醉方式为3%异氟烷吸入麻醉(500 ml/min,麻醉5 min)。大鼠麻醉后仰卧位固定于手术台上,腹部备皮消毒后,逐层切开皮肤和皮下组织,在大鼠左侧肋缘部,垂直于腹中线作1个长1.5 cm的切口,充分暴露肝左叶,用手术刀在肝右叶下部作一个长约1 cm,深约0.5 cm的切口。将除空白对照组外,其余各组敷料充分贴敷于肝创面处,记录渗血完全停止时间并用敷料称重法计算出血量。
采用SPSS 20.0统计学软件处理数据,所有数据均采用均数±标准差( ±s)表示,应用非配对样本t检验分析,以P<0.05为差异有统计学意义。
±s)表示,应用非配对样本t检验分析,以P<0.05为差异有统计学意义。
如图1所示,因为三七粉分散在水中为黄色的,随着三七粉含量的增加,PN/CMC/GMs的颜色逐渐加深。上层为PN/CMC/GMs形成的前驱体溶液,将小瓶斜放,小瓶中的液体为倾斜的,而放于室温下半小时后再将小瓶斜放,液体不流动,变为固体,说明形成了PN/CMC/GMs。


a、b、c、d分别表示0%、1%、3%、5% PN/CMC/GMs;PN/CMC/GMs—三七的壳聚糖/明胶水凝胶复合止血材料
从图2可以看出,PN/CMC/GMs呈相互交通连接的网格状结构,具有一定的孔隙率。不含三七粉的PN/CMC/GMs孔洞没有规整性,而当加入三七粉后,PN/CMC/GMs的孔洞结构明显,形成了具有一定规则的小孔。随着三七粉含量的增加,PN/CMC/GMs的孔隙率减小。


a、b、c、d分别表示0%、1%、3%、5% PN/CMC/GMs;PN/CMC/GMs—三七的壳聚糖/明胶水凝胶复合止血材料
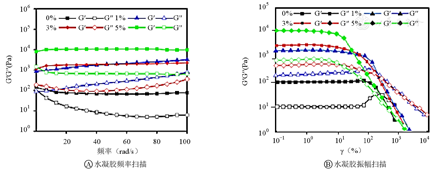
如图3A所示,PN/CMC/GMs在频率扫描下,G′>G′′,表明其为固体状态,而随着三七粉含量的增加,PN/CMC/GMs的模量也相应的增加,当含5%三七粉时,PN/CMC/GMs的模量为9 890 Pa,表明三七粉的加入增加了水凝胶的机械强度,水凝胶增强。如图3B所示,当PN/CMC/GMs的G′降低到低于G′′时,表明水凝胶破裂。而当三七粉含量增加时,PN/CMC/GMs的最大形变量也随之增加,表明三七粉的加入使得水凝胶的韧性增加,机械强度增加。

如图4所示,不含三七粉的PN/CMC/GMs可膨胀近10倍(图4a),而在PN/CMC/GMs中添加1%的三七粉时,其膨胀率达到了(3 288±247)%(图4b),而当三七粉的含量增加时,其吸水率降低,含3%三七粉时,PN/CMC/GMs的膨胀率为(2 172±161)%(图4c),而含5%三七粉时,PN/CMC/GMs的吸水率为(1 247±97)%(图4d)。
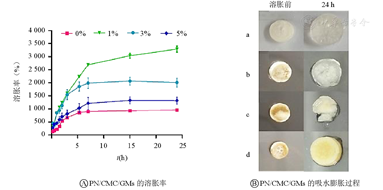

a、b、c、d分别表示0%、1%、3%、5% PN/CMC/GMs;PN/CMC/GMs—三七的壳聚糖/明胶水凝胶复合止血材料
如图5A所示,含不同三七粉的PN/CMC/GMs在24、48 h时细胞存活率均高于80%。综合动物体内实验,含3%三七粉的PN/CMC/GMs在发挥高效止血功能的基础上,所用三七粉最低。因此,本实验通过细胞染色观察了细胞在含3%三七粉的PN/CMC/GMs中的活性,如图5B所示,细胞在含3%三七粉的PN/CMC/GMs中也没有显示出明显毒性。表明PN/CMC/GMs具有较好的生物相容性。


1—阴性对照组;2—1 000 μg/ml PN/CMC/GMs组;3—500 μg/ml PN/CMC/GMs组;4—250 μg/ml PN/CMC/GMs组;5—125 μg/ml PN/CMC/GMs组;6—62.5 μg/ml PN/CMC/GMs组;7—31.75 μg/ml PN/CMC/GMs组;PN/CMC/GMs—三七的壳聚糖/明胶水凝胶复合止血材料
由图6可知,无论在止血时间还是在出血量上,所有敷料组均小于空白对照组,差异均有统计学意义(均P<0.001),说明0% PN/CMC/GMs组体系本身具有一定止血效果。而1%、3%、5% PN/CMC/GMs组的止血时间和出血量均小于0% PN/CMC/GMs组(均P<0.001),说明除了物理吸收水分,压迫止血和浓缩血液外,三七粉也发挥了重要作用。3%、5% PN/CMC/GMs组的止血时间和出血量组均小于0%、1% PN/CMC/GMs组(均P<0.001),但3%与5% PN/CMC/GMs组间差异无统计学意义(P>0.05),且与阳性组相比差异无均统计学意义(均P>0.05)。
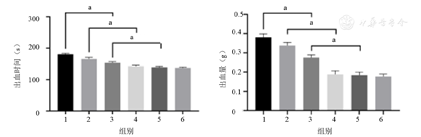

1—空白对照组;2—0% PN/CMC/GMs组;3—1% PN/CMC/GMs组;4—3% PN/CMC/GMs组;5—5% PN/CMC/GMs组;6—阳性组;PN/CMC/GMs—三七的壳聚糖/明胶水凝胶复合止血材料。aP<0.001
当前临床上应用的止血材料的止血性能远未达到创伤救治的理想需要,开发新型复合止血材料至关重要。增加血液黏稠度,促进血小板、凝血因子等聚集,是实现血液凝固的有效手段之一。敷料发挥这种方式的快速止血得益于其亲水性和吸水能力,这属于材料的物理性能之一。当伤口发生出血时,用材料填塞或按压时,吸水性较强的敷料,一方面吸水膨胀,压迫出血或渗血点,减少出血;另一方面吸收血液中的水分,使血小板、凝血因子等物理距离拉近,血液黏度增加,进一步加快血液凝固。
通过扫描电镜图像可以观察到复合水凝胶呈相互交通连接的网格状结构,该结构具有一定的孔隙率,而孔隙率是材料吸水膨胀的重要原因之一,其在接触血液时可以吸收血浆,浓缩血液,帮助红细胞、血小板和凝血因子等聚集,增强止血效果[12,13]。随着三七粉含量的增加,水凝胶的孔隙率减小,而孔洞结构增大,从而可以使得水凝胶对三七粉进行负载,同样说明三七粉的存在占据了一定空间使得水凝胶的孔洞结构增大。这也就可以解释当PN/CMC/GMs中添加1%三七粉时较无添加水凝胶敷料具有更好的吸水膨胀性,但随着三七粉含量的增加,吸水膨胀性却减小。这是因为少量三七粉分散在水凝胶可以事水凝胶形成规则稳定的空洞结构,利于吸纳液体,而当三七粉含量多时,其过多的占据了水凝胶的孔洞,导致水凝胶的吸水率降低。另一方面,当加入少量三七粉时又可以增加水凝胶的强度,增加水凝胶对水的吸附力度。
然而水凝胶的最大形变也是一个评估柔韧性的重要特征,水凝胶的最大形变量决定了其在特定条件下的应用。为了进一步评估PN/CMC/GMs G′和G′′的形变量,以6.28 rad/s为固定频率,测量PN/CMC/GMs在0.1%~125%的形变。结果表明,随着三七粉含量的增加,PN/CMC/GMs的模量也相应的增加,机械强度增加。
图4说明三七粉不同配比的材料具不同的吸水膨胀性,添加1%三七粉较无添加的PN/CMC/GMs具有更好的吸水膨胀性,随着三七粉含量的增加,吸水膨胀性却减小,说明在敷料中添加三七粉后,敷料的吸水率提高,这可能是因为三七粉不溶于水,当水凝胶中加入三七粉后使其分布在壳聚糖/明胶分子链之间,增强了水凝胶链之间的缠接,使水凝胶吸水率上升,但是当加三七粉量增多时,三七粉会阻碍水凝胶分子链的运动,导致水凝胶的吸水率下降。
由图6可知,无论在止血时间还是在出血量上,所有敷料组均小于空白对照组,差异均有统计学意义(均P<0.001),说明0% PN/CMC/GMs组体系本身具有一定止血效果。而1%、3%、5% PN/CMC/GMs组的止血时间和出血量均小于0% PN/CMC/GMs组(均P<0.001),说明除了物理吸收水分,压迫止血和浓缩血液外,三七粉也发挥了重要作用。三七粉是目前已应用于临床的、具有较好止血效果的中药成分[19]。另外,本研究发现在止血时间和出血量上,虽然3%、5% PN/CMC/GMs组的止血时间和出血量组均小于0%、1% PN/CMC/GMs组(均P<0.001),但3%与5% PN/CMC/GMs组比较差异无统计学意义(P>0.05),且与阳性组相比差异无均统计学意义(均P>0.05)。本实验采用SD大鼠肝损伤出血模型观察PN/CMC/GMs在体内的止血情况。4组PN/CMC/GMs在肝出血部位迅速吸收血液膨胀,压迫出血点并增加血液黏稠度,实现快速止血,这主要与材料的网格状结构和孔隙率有关[17,18]。由此可见,当加入不同含量三七粉后,止血效果升高后达到一个平台,这可能是因为孔隙率引起的吸水性导致的压迫和浓缩止血效果和三七粉的止血效果达到一个平衡点,也就是本实验所得到的最佳复合材料。此材料保证了止血效能的同时最大程度地降低了细胞毒性和原材料应用。
综上所述,本研究采用冷冻干燥法制备了PN/CMC/GMs,并利用扫描电镜、溶胀测试、流变仪、细胞毒性实验和SD大鼠肝脏出血模型测试了PN/CMC/GMs的微观形貌、流变性能、生物安全性和止血性能,结果表明,向壳聚糖/明胶中加入3%的三七粉止血效果最好并且毒性最低。PN/CMC/GMs具有进一步研究的价值和应用前景,有望成为优良的医用止血敷料。
所有作者均声明不存在利益冲突



























