
利用细胞膜包覆纳米颗粒的仿生策略不仅能保留纳米颗粒的物理化学性质,而且表现源细胞膜的生物学特性,可进一步增强纳米药物在肿瘤治疗中的作用。杂化细胞膜是将2种或2种以上不同类型的细胞膜融合在一起。与单型细胞膜相比,杂化细胞膜使纳米颗粒衍生出多种源细胞的生物功能,为多功能仿生纳米药物递送体系的广泛研究提供了基础,有望拓宽仿生纳米技术在药物递送体系的应用。综述了近年来用于构建纳米药物递送体系的杂化细胞膜类型,制备和表征方法以及用于肿瘤治疗的研究进展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
基于纳米颗粒载体的药物递送系统(nano-drug delivery system,NDDS)能够优化治疗药物在体内的分布,通过增强渗透滞留效应和血管渗透优先聚集在肿瘤部位,提高传统药物的治疗效率。然而,大多数纳米载体材料由于"外来"成分,易被免疫系统迅速清除,因此在肿瘤部位的整体积累率较低[1,2,3]。以细胞膜作为纳米载体材料来源,具有毒副作用低、生物相容性高、特别是保留源细胞膜活性及与特定配体的相互作用等特点。利用细胞膜包覆纳米载体的仿生策略增强了纳米载体的功能,如红细胞膜和血小板膜能够增强药物在体内的循环时间和免疫逃逸[4,5],癌细胞膜具有同型靶向的能力[6],白细胞膜具有炎症部位靶向性[7,8]等,根据源细胞的特性和疾病治疗的要求灵活选择细胞膜,因此细胞膜仿生技术在肿瘤的早期诊断、靶向和精准治疗方面优势愈加凸显。
仿生NDDS弥补了传统NDDS的不足,使纳米载体具有长循环和免疫逃逸等特性,增强了纳米载体在肿瘤部位的积累,然而单一类型细胞膜构建的仿生纳米载体功能也较为单一,逐渐不能满足生物医学的不同需求。杂化细胞膜可以将不同的细胞膜生物功能集合成一体化的仿生纳米平台,使其表现出2种或多种类型细胞膜的交叉特征,显著增强仿生纳米载体的功能,扩大仿生载体的可供选择数量,也为肿瘤的个性化治疗提供更多的选择性[9,10]。因此,本文对近年来以杂化细胞膜构建的仿生纳米药物递送体系的制备、表征以及不同类型杂化细胞膜在肿瘤治疗中应用的研究进展进行综述。
杂化细胞膜主要来源于无核细胞和真核细胞2种细胞类型,需根据细胞类型选用特定的方法来分离和提取细胞膜。对于无核细胞,如红细胞和血小板,首先将全血进行离心收集细胞,之后采用低渗或反复冻融的方式裂解,离心纯化收集细胞膜。大部分的真核细胞则需要从组织提取分离或培养后富集,采用反复冻融、低渗或超声的方式裂解细胞膜,通过差速离心法将细胞膜从细胞器中分离出来。将不同来源的细胞膜以一定的比例混合,通过水浴超声使膜碎片转化为细胞膜囊泡,若要获得大小均匀的膜囊泡,可在超声后结合挤压法,通过聚碳酸酯膜反复挤压[11,12,13]。
杂化细胞膜仿生纳米载体是将不同细胞膜杂化后包覆在纳米载体表面(图1A),主要有物理挤压法[14,15]、超声法[16,17,18]或超声法与物理挤压法联用[19,20]以及微流控系统[21,22,23]。物理挤压法(图1B)是通过挤压产生的机械强度使细胞膜包裹纳米内核,该方法能够获得大小均匀的纳米颗粒,并且膜蛋白保存完整,由于操作较为复杂不适用于大规模制备。超声法可使细胞膜囊泡和纳米内核在超声波作用下自发地形成核壳结构,操作简单且节约原材料,适用于批量制备,但膜涂层容易不均匀导致大小不均一。微流控技术(图1C)是将纳米内核和杂化细胞膜囊泡分别通过2个入口注入系统,通过"S"型通道进行混合,在电穿孔区施加电脉冲促使纳米内核进入杂化细胞膜囊泡,最后从出口获得杂化细胞膜仿生纳米载体,制备方法复杂但具有高通量的优点。
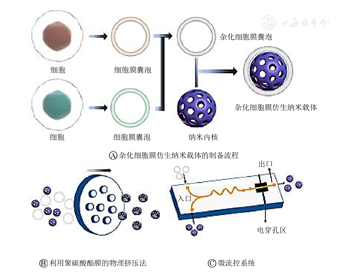

证实杂化细胞膜仿生纳米载体构建成功通常从以下3个方面进行表征。(1)荧光定位:使用不同颜色的荧光染料(如DiI红色染料和DID绿色染料)在融合前分别标记2种细胞膜,通过荧光共聚焦显微镜观察纳米载体表面荧光分布,证明细胞膜是否融合成功。(2)形态结构特征观察:醋酸铀酰阴性染色后,透射电子显微镜观察纳米载体是否具有核-壳结构;动态光散射测量尺寸与内核相比是否增加,以及表面Zeta电位的变化。(3)生物活性检测:十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析比较仿生纳米载体表面全蛋白和原始细胞膜蛋白;Western Blot或Elisa等方法分析特异性蛋白标记物,验证细胞膜特异性膜蛋白是否被保留。
目前已经有多种类型的细胞膜用于构建仿生纳米药物递送体系,如来源于血液的无核细胞红细胞[24]和血小板[25],因其细胞器较少,膜的提取方法简单,应用最为广泛;部分白细胞如自然杀伤细胞[26]和中性粒细胞[27],基于白细胞膜的NDDS血管渗透性增强,较易穿过生理屏障[7,28];抗原呈递细胞如巨噬细胞[29],使NDDS具有更强的免疫激活能力;以及具有同源黏附特性的癌细胞[30]。由于不同的源细胞具有不同的生物功能,细胞膜的选择要根据源细胞的特性和疾病治疗的要求,来实现药物的长期循环和肿瘤靶向治疗。
血液来源的红细胞与血小板是最早应用于细胞膜仿生技术的细胞类型[12,13]。红细胞膜上的免疫抑制蛋白可以抑制巨噬细胞吞噬,从而实现长期循环的能力。血小板表面的P-选择素能够识别并与肿瘤细胞相互作用,具有良好的免疫相容性以及肿瘤靶向性。Dehaini等[16]首次将红细胞膜与血小板膜融合并包覆聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]纳米粒,为了验证仿生纳米载体的功能,在体外实验中利用巨噬细胞样THP-1细胞进行了摄取研究,与PLGA核相比仿生纳米载体表现出较低的摄取率,与高转移性的人乳腺癌细胞孵育表现较高的结合率。在体内实验中,对仿生纳米载体的靶向性,血液清除率和生物分布进行测定,结果表明仿生纳米载体兼具红细胞和血小板的特性,有良好的靶向性和较长的半衰期。
白细胞包括淋巴细胞和单核细胞粒细胞等,在防御宿主的病原体入侵、癌症和寄生虫感染等方面起着重要作用[31]。白细胞膜上表达的淋巴细胞功能相关抗原-1(lymphocyte function-associated antigen-1,LFA-1),其特异性配体细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)通常在肿瘤相关血管中高表达,在仿生策略中显示出对肿瘤的高度亲和性,使肿瘤血管的通透性增加[32,33]。Zhang等[14]制备的淋巴细胞/血小板杂化细胞膜仿生纳米药物在三阴性乳腺癌治疗中表现了双靶向能力,即依赖于LFA-1/ICAM-1通路的肿瘤血管靶向和穿透能力,以及P-选择素/CD44结合介导的肿瘤细胞靶向能力。以上研究均证实了杂化细胞膜在功能水平上表现2种类型细胞的性质,成功地将不同的细胞膜功能整合到单一的纳米载体,为构建具有不同混合功能的仿生纳米药物打开了大门。
癌细胞膜具有同型靶向性,能够无限增殖,易于体外大规模培养,是用来包覆纳米载体进行抗肿瘤治疗的理想细胞膜类型[34]。将癌细胞膜与红细胞或血小板膜杂化,能够使NDDS兼具免疫逃逸、长循环和肿瘤靶向等特性。将红细胞膜与黑色素瘤B16-F10细胞膜融合,包裹负载阿霉素(doxorubicin,DOX)的空心硫化铜纳米粒(CuS-DOX),用于黑色素瘤的光热和化疗联合治疗。包裹杂化细胞膜后的CuS-DOX对B16-F10细胞表现出高度的自我识别特性,循环半衰期大约是CuS的9倍,在肿瘤中的积累也明显高于CuS,证实该仿生纳米粒同时具有红细胞膜的长循环特征和B16-F10细胞的同型靶向性[17]。大量研究表明,以卵巢癌、乳腺癌和神经胶质瘤等为来源的癌细胞膜与红细胞或血小板膜杂化[35,36,37,38,39],均表现出免疫逃逸、长循环和肿瘤同源靶向等特性因此可根据不同癌症治疗需求来选择癌细胞膜,大大提高了仿生纳米药物的可供选择数量。
抗原呈递细胞包括树突状细胞,单核巨噬细胞等,其中树突状细胞能够识别肿瘤细胞表达的肿瘤抗原,随后启动不同的抗原特异性T细胞亚群,以杀死同源肿瘤细胞。Liu等[40]将骨髓源性树突状细胞和小鼠乳腺癌4T1细胞的膜融合在一起,结果证实了该杂化细胞膜可以有效地表达整个癌细胞表面抗原和树突状细胞表面的免疫共刺激分子,不仅具有肿瘤的自我靶向特性,还能够刺激树突状细胞成熟从而诱导免疫激活,产生强烈的免疫反应,有效抑制原发肿瘤增殖反弹。此外,由于树突状细胞的能特异性识别癌细胞,容易获得不同的类型的杂化细胞膜,因此该纳米递药系统可以扩展到多种肿瘤类型。
巨噬细胞是先天免疫的重要细胞,能够响应炎症细胞释放的细胞因子信号从而在炎症部位积累,如癌症、痛风和动脉粥样硬化等。肿瘤相关巨噬细胞在肿瘤中有高度的浸润,可以与肿瘤组织特异性结合,因此巨噬细胞膜也被进一步开发用于癌症治疗[41,42]。Rao等[43]报告了一种由血小板、M1巨噬细胞和过度表达高亲和性信号调节蛋白α(signal regulatory proteinα,SIRPα)变体的癌细胞膜组分制备的杂化细胞膜,可以有效地积累在手术伤口部位,与血液中循环肿瘤细胞相互作用,使肿瘤浸润巨噬细胞向M1表型复极化,并阻断CD47-SIRPα相互作用,从而增强巨噬细胞对癌细胞的吞噬作用,增强抗肿瘤T细胞免疫。该杂化细胞膜可以增强巨噬细胞对术后癌症复发和转移的反应。
近年来在肿瘤治疗中基于癌细胞膜的杂化细胞膜仿生NDDS见表1。
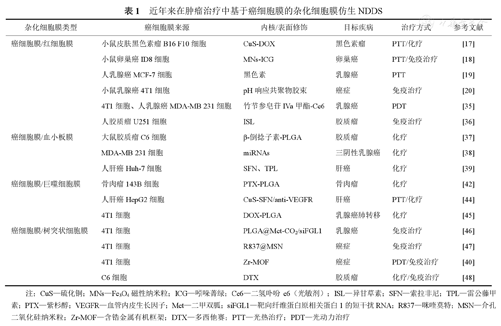
近年来在肿瘤治疗中基于癌细胞膜的杂化细胞膜仿生NDDS
近年来在肿瘤治疗中基于癌细胞膜的杂化细胞膜仿生NDDS
| 杂化细胞膜类型 | 癌细胞膜来源 | 内核/表面修饰 | 目标疾病 | 治疗方式 | 参考文献 |
|---|---|---|---|---|---|
| 癌细胞膜/红细胞膜 | 小鼠皮肤黑色素瘤B16 F10细胞 | CuS-DOX | 黑色素瘤 | PTT/化疗 | [17] |
| 小鼠卵巢癌ID8细胞 | MNs-ICG | 卵巢癌 | PTT/免疫治疗 | [18] | |
| 人乳腺癌MCF-7细胞 | 黑色素 | 乳腺癌 | PTT | [19] | |
| 小鼠乳腺癌4T1细胞 | pH响应共聚物胶束 | 癌症 | 免疫治疗 | [20] | |
| 4T1细胞、人乳腺癌MDA-MB 231细胞 | 竹节参皂苷IVa甲酯-Ce6 | 乳腺癌 | PDT | [35] | |
| 人胶质瘤U251细胞 | ISL | 胶质瘤 | 免疫治疗 | [36] | |
| 癌细胞膜/血小板膜 | 大鼠胶质瘤C6细胞 | β-倒捻子素-PLGA | 胶质瘤 | 化疗 | [37] |
| MDA-MB 231细胞 | miRNAs | 三阴性乳腺癌 | 化疗 | [38] | |
| 人肝癌Huh-7细胞 | SFN、TPL | 肝癌 | 化疗 | [39] | |
| 癌细胞膜/巨噬细胞膜 | 骨肉瘤143B细胞 | PTX-PLGA | 骨肉瘤 | 化疗 | [42] |
| 人肝癌HepG2细胞 | CuS-SFN/anti-VEGFR | 肝癌 | PTT/化疗 | [44] | |
| 4T1细胞 | DOX-PLGA | 乳腺癌肺转移 | 化疗 | [45] | |
| 癌细胞膜/树突状细胞膜 | 4T1细胞 | PLGA@Met-CO2/siFGL1 | 乳腺癌 | 免疫治疗 | [46] |
| 4T1细胞 | R837@MSN | 癌症 | 免疫治疗 | [47] | |
| 4T1细胞 | Zr-MOF | 癌症 | PDT/免疫治疗 | [40] | |
| C6细胞 | DTX | 胶质瘤 | 化疗/免疫治疗 | [48] |
注:CuS—硫化铜;MNs—Fe3O4磁性纳米粒;ICG—吲哚菁绿;Ce6—二氢卟吩e6(光敏剂);ISL—异甘草素;SFN—索拉非尼;TPL—雷公藤甲素;PTX—紫杉醇;VEGFR—血管内皮生长因子;Met—二甲双胍;siFGL1—靶向纤维蛋白原相关蛋白1的短干扰RNA;R837—咪喹莫特;MSN—介孔二氧化硅纳米粒;Zr-MOF—含锆金属有机框架;DTX—多西他赛;PTT—光热治疗;PDT—光动力治疗
细菌外膜囊泡含有许多细菌抗原,在肿瘤组织中积聚时,可诱导产生抗肿瘤细胞因子,引发抗肿瘤免疫反应,能刺激未成熟的树突状细胞进入成熟状态,并可能诱导免疫治疗的后续免疫反应[49,50]。Wang等[51]报道了一种由细菌外膜囊泡和B16-F10细胞膜组成杂化细胞膜,并将其包裹在中空聚多巴胺纳米粒上。结果显示仿生纳米粒能特异性地积累在黑色素瘤区域,快速刺激淋巴结树突状细胞成熟并激活免疫应答,协同PTT根除黑色素瘤,证实该杂化细胞膜具有细菌外膜囊泡的免疫激活特性以及癌细胞膜的归巢能力。将黑色素瘤细胞膜囊泡和沙门氏菌外膜囊泡融合在一起,设计真核-原核囊泡纳米制剂,体内试验表明,该纳米制剂可作为一种预防疫苗,刺激免疫系统,触发抗肿瘤免疫反应,预防肿瘤发生[52]。
近年来,杂化细胞膜仿生技术取得了显著进展,与传统的表面修饰的纳米颗粒和单型细胞膜包覆的纳米颗粒相比,该方法显著提高了药物靶向能力和血液循环时间,表现源细胞免疫逃逸和肿瘤靶向等生物学特性。将不同类型的细胞膜与癌细胞膜融合来逃避免疫系统识别和清除,是一种有效的肿瘤治疗策略。然而杂化细胞膜仿生NDDS在临床应用中仍面临一定的困难。(1)杂化细胞膜仿生NDDS的活性:杂化细胞膜的制备过程较为复杂,难以保证细胞膜上的生物活性成分(包括离子通道、酶和受体)的完整性,从而影响仿生NDDS的有效功能。(2)杂化细胞膜仿生NDDS的安全性:一些不必要的细胞膜活性组分可能会引起免疫排斥等安全隐患。
随着细胞膜仿生技术不断研究和临床探索应用,根据疾病类型选择细胞膜来源,确定膜蛋白组分和功能以及不同细胞膜的投料比例,并对其生物安全性和有效性进行充分的评估,基于杂化细胞膜的仿生NDDS将在肿瘤治疗以及精准个性化医疗领域发挥更大的潜能。
所有作者均声明不存在利益冲突



























