
动脉粥样硬化通常为心血管疾病的基础病因,目前随着饮食习惯和生活环境的改变,已然成为全球范围内日益严重的健康问题,对公共卫生构成巨大的挑战。小檗碱具有清热解毒的作用,是异喹啉类季铵型生物碱,小檗碱及其衍生物具有抗菌、抗炎、抗病毒、抗氧化、降糖、调血脂及预防动脉粥样硬化等作用。从调脂作用、抑制氧化应激与炎症反应、改善血管内皮功能障碍、调节肠道微生物群等角度综述小檗碱及其衍生物预防动脉粥样硬化作用机制的研究进展,以期为减少动脉粥样硬化的发生,改善患者的临床症状,以及小檗碱类药物的深度开发提供理论依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
动脉粥样硬化通常为心血管疾病的基础病因,是一种称为"斑块"的脂肪沉积于血管内皮的疾病,随着斑块体积的增大,血管变窄,通常会导致血液无法正常通过,进而引起冠状动脉、脑动脉、外周动脉和主动脉的病变。动脉粥样硬化的发生发展过程涉及多种作用机制和危险因素,具体包括血脂异常代谢、局部或全身炎症反应、氧化应激和血管内皮功能障碍等发病机制,以及糖尿病、高血压、肥胖症和吸烟等传统因素[1,2]。如今动脉粥样硬化症是西方发达国家的主要死亡原因之一,而伴随着发展中国家饮食习惯和生活环境的改变,该病导致的死亡人数亦日益增多,带来沉重的医疗负担和巨大的社会风险[3]。
小檗碱又称黄连素,是从传统中草药黄连中提取分离得到的一种异喹啉类季铵型生物碱,其化学结构中独特的四环骨架是由2个异喹啉环稠合而成[4],且在C-2和C-3位存在一个亚甲基双氧桥环状结构。小檗碱主要以盐酸盐形式存在,为黄色结晶性粉末,其在水中的溶解度较小,而易溶于沸水。由于受到植物资源的限制,目前化学全合成的方法逐渐成为制备小檗碱的主要方式[5]。小檗碱的C-8、9、12、13位可以发生烷基化或酰基化的取代反应,从而连接不同的化学基团,如烷基链、唑类化合物、萜烯基以及氮杂环等,形成各种结构相近的小檗碱衍生物(图1)。小檗碱主要用于治疗胃肠炎、细菌性痢疾等肠道感染,也被国家药品监督管理局批准作为调血脂新药开展临床研究,取得了很好的效果。现代药理学研究表明小檗碱及其衍生物具有抗肿瘤、抗病毒、抗氧化、抑菌抗炎、抗心律失常、调节血糖和脂质代谢以及抗动脉粥样硬化等药理活性[6,7,8]。构效关系研究发现小檗碱C-2、3位的亚甲氧基,C-7位带正电的季铵离子以及C-9、10位的甲氧基是小檗碱发挥抑菌抗炎、抗病毒、抗肿瘤以及降糖作用的药效团[6,9,10,11]。近年来,多项基础研究和临床实践的结果显示小檗碱及其衍生物在预防动脉粥样硬化领域具有潜在的应用价值,引起了国内外学者的广泛关注。本文从调脂作用、抑制氧化应激与炎症反应、改善内皮功能障碍和调节肠道微生物群4个方面阐述了小檗碱在预防动脉粥样硬化作用机制研究中的最新进展,为动脉粥样硬化症的临床防治及药物开发提供新思路。
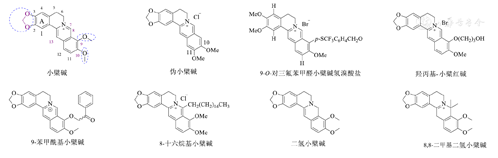

调脂作用是指降低血液中胆固醇的含量,用以防止高血脂所引起的冠心病、缺血性中风和动脉粥样硬化等疾病。常规调脂药物的作用机制是通过影响体内胆固醇代谢、抑制胆固醇和低密度脂蛋白(low-density lipoprotein,LDL)的合成和吸收,从而降低血浆中LDL或增加高密度脂蛋白(high-density lipoprotein,HDL)的含量。近年来,研究发现小檗碱及其衍生物主要通过调控LDL受体(LDL receptor,LDLR)、激活单磷酸腺苷(adenosine 5′-monophosphate,AMP)依赖蛋白激酶(AMP-activated protein kinase,AMPK)和调节磷脂酰肌醇-3-激酶(phosphatidylinositol- 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路等途径,降低血液中的胆固醇含量,从而预防动脉粥样硬化的发生发展。
LDLR广泛分布于肝和动脉壁细胞等全身各组织的细胞膜表面,它可以调控LDL的胞吞作用,将细胞外的胆固醇摄取到细胞内,减少血浆中的LDL胆固醇(LDL cholesterol,LDL-C),从而避免血管内皮发生脂质沉积所导致的动脉粥样硬化。小檗碱作为新型的调脂类药物,可通过诱导肝脏LDLR的表达来增加LDL的摄取,从而降低胆固醇水平,防止脂质积累。此外,研究发现小檗碱还能够激活细胞外信号调节激酶(extracellular signal-regulated kinase,ERK),上调LDLR mRNA的表达,从而增加肝脏中的LDLR,其活性位点位于LDLR mRNA 3’非翻译区的5’近端部分[12]。
Li等[13]使用高血脂症大鼠模型评价伪小檗碱对实验动物LDLR表达的影响,发现与小檗碱相比,伪小檗碱明显增加LDLR的表达,其调脂活性的药效基团包括C-2、3位的亚甲氧基、C-7位的季铵基团和平面结构,但在C-7或13位引入给电子基团会降低活性。前蛋白转化酶枯草溶菌素9型(monoclonal antibody to proprotein convertase subtilisin/kexin type 9,PCSK9)是调脂作用机制的主要靶点,它可以直接与LDLR的表皮生长因子前体同源结构域A结合,并通过溶酶体途径降解血浆中的LDLR,进而升高LDLC的水平。小檗碱作为一种天然来源的PCSK9抑制剂,可以抑制血浆中PCSK9和LDLR的结合,而再循环到肝细胞表面的LDLR增多,从而降低血浆LDL-C水平,起到调脂作用。2021年,Ma等[14]研究表明小檗碱可以显著减轻高脂饮食的ApoE-/-小鼠的脂质紊乱,减少主动脉斑块的形成,并缓解肝脏脂质积累,机制与通过ERK1/2途径促进细胞内胆固醇外流,上调LDLR的表达,下调PCSK9的表达有关。NAD-依赖性去乙酰化酶sirtuin1是调控能量代谢的关键分子,它可以抑制脂肪细胞的分化,在肝脏糖脂质代谢中发挥有益的作用。2018年,Zhu等[15]研究显示小檗碱可以上调sirtuin1的表达,当它与sirtuin1激活剂白藜芦醇联用时,可以显著上调肝癌HepG2细胞中LDLR的表达,降低血清中的总胆固醇,比单用白藜芦醇效果提升1倍。Fan等[16]发现9-O-对三氟苯甲醛小檗碱氢溴酸盐较小檗碱具有更强PCSK9表达抑制活性,可以显著减少HepG2细胞中PCSK9蛋白的含量,上调LDLR的表达和促进LDL-C的清除。Cao等[17]发现C-9位取代的小檗碱衍生物羟丙基-小檗红碱可以通过抑制ERK,调节肝脏中LDLR和PCSK9的表达,发挥比小檗碱更强的调脂作用。
AMPK是调节生物能量代谢的关键分子,其通过AMP的诱导作用抑制3-羟基-3-甲基戊二酸单酰辅酶A还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMG-CoA)和乙酰辅酶A羧化酶(acetyl-coenzyme A carboxylase,ACC)丙二酰基转移酶,参与胆固醇和脂肪酸的生物合成。Brusq等[18]在研究中证实小檗碱能激活AMPK,将AMPK转化为磷酸化的ACC,导致脂肪酸合成减少,抑制胆固醇和三酰甘油的合成,从而起到调脂作用。2018年,Zhou等[19]研究也表明小檗碱可激活AMPK,通过神经生长因子诱导的基因B促进肝脏成纤维细胞生长因子21的表达,从而促进肝脏脂肪酸氧化和抑制脂肪生成。Chi等[20]发现小檗碱通过AMPK-沉默信息调节因子1(silent information regulator 1,SIRT1)-过氧化酶活化增生受体-γ(proliferator-activated receptor-γ,PPAR-γ)途径,减少氧化型LDL(oxidized LDL,ox-LDL)的摄取,从而抑制泡沫细胞的形成。Kim等[21]研究显示小檗碱不仅可以通过激活外周AMPK,还可以通过中枢神经系统的神经信号传导,促进脂肪酸氧化,降低肝脏和血浆中三酰甘油和胆固醇的含量。Cao等[22]分离合成了一个小檗碱衍生物9-苯甲酰基小檗碱,与小檗碱比较,其对AMPK的亲和力更强,可以显著上调磷酸化-thr172 AMPK α亚基的水平,降低三酰甘油,调节高脂血症。
PI3K/Akt/mTOR通路是细胞内最重要的信号通路之一,其在细胞增殖、生长、蛋白合成和脂肪代谢中起重要作用,它既可以激活胆固醇调节元素结合蛋白,促进胆固醇的摄取与合成,又能通过调节极低LDL分泌、脂肪酸氧化和糖异生作用,起到调脂作用[23]。Song等[24]发现小檗碱可以通过调节PI3K/ Akt/mTOR通路,调节自噬、促进细胞增殖和抑制细胞凋亡,调节血脂水平,改善内膜增生和颈动脉粥样硬化。朱昌国等[25]报道小檗碱能通过调控PI3K/ Akt/mTOR信号通路,抑制动脉平滑肌细胞增殖,降低实验动物的血糖水平,预防糖尿病动脉粥样硬化。
小檗碱的调脂作用机制见图2。
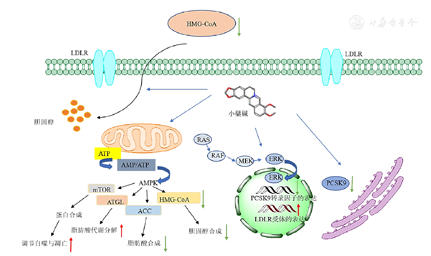

HMG-CoA—3-羟基-3-甲基戊二酸单酰辅酶A还原酶;LDLR—低密度脂蛋白受体;ATP—三磷酸腺苷;AMP—单磷酸腺苷;AMPK—AMP依赖蛋白激酶;mTOR—哺乳动物雷帕霉素靶蛋白;ATGL—脂肪三酰甘油脂肪酶;ACC—乙酰辅酶A羧化酶;RAS—鼠肉瘤病毒基因;RAF—丝氨酸/苏氨酸蛋白激酶;MEK—丝裂原活化蛋白激酶;PCSK9—前蛋白转化酶枯草溶菌素9型;红色箭头表示上调,绿色箭头表示下调
目前,多数学者认为氧化应激与炎症反应引起的血管内皮细胞功能损伤和血管性病变是形成动脉粥样硬化的主要原因之一。氧化应激和炎症反应密切相关,两者均参与了动脉粥样硬化斑块的形成和进展。正常人血管内膜是完整的,血液中流动着适量的炎性细胞。当内皮功能受损时,炎性细胞被激活,黏附于受损的血管内皮细胞,导致血管内膜局部炎症反应。血液中的炎性细胞浸润到血管内皮下,吞噬脂质并沉积到内膜下形成斑块,即动脉粥样硬化斑块。此外,血浆HDL是公认的动脉粥样硬化防御因素,氧化应激与炎症可引起HDL病理性修饰,导致HDL从抗动脉粥样硬化向致动脉粥样硬化转变[26]。因此,抑制氧化应激与炎症反应是预防动脉粥样硬化的一个重要途径。近几年来,许多研究报道指出小檗碱及其衍生物可以通过抑制氧化应激和炎症反应,减少动脉粥样硬化斑块的形成。
Cheng等[27]研究证明小檗碱可以抑制循环内皮微粒(endothelialmicroparticles,EMP)介导的血管内皮氧化应激,上调细胞内还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(reduced nicotinamide adenine dinucleotide phosphate oxidoreductase 4,NOX4)蛋白的表达,减少一氧化氮(nitric oxide,NO)的合成,增加活性氧(reactive oxygen species,ROS)的产生。Liu等[28]研究表明小檗碱可以抑制内质网应激(endoplasmic reticulum stress,ERS),下调自发性高血压大鼠颈动脉中环氧合酶-2(cyclooxygenase-2,COX-2)的表达,保护实验动物的血管功能。Li等[29]报道了小檗碱可以抑制内皮细胞氧化应激,通过刺激PPAR-γ提高同型半胱氨酸血症小鼠动脉粥样硬化斑块的稳定性。此外,Zhang等[30]指出小檗碱还可以通过激活核因子相关因子-2/血红素氧化酶-1信号通路缓解氧化应激反应引起的内皮细胞凋亡。
小檗碱干预动脉粥样硬化涉及的炎症通路较多,包括Toll样受体4(Toll-like receptor 4,TLR4)信号通路、核因子-κB(nuclear factor-κB,NF-κB)信号通路、ERK信号通路、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)信号通路、AMPK信号通路、mTOR信号通路、Akt信号通路和干扰素调节因子3(interferon regulatory factor 3,IRF3)信号通路等。Huang等[31]研究表明小檗碱可以抑制TLR4/髓样分化因子88(myeloiddifferentiationfactor 88,MyD88)/ NF-κB信号通路,下调白细胞介素-1β(interleukin-1β,IL-1β)和NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor protein 3,NLRP3)的表达,缓解动脉粥样硬化中的慢性炎症反应。Guo等[32]研究显示小檗碱可以通过ERK1/2信号通路和JNK信号通路,抑制COX-2的表达,抑制炎症反应和动脉粥样硬化的进展。Fan等[33]报道了小檗碱可以激活AMPK/mTOR信号通路,下调炎症因子巨噬细胞炎性蛋白-1α(macrophage inflammatory protein-1α,MIP-1α)和调节T细胞正常表达和分泌的活化因子(reduced upon activation,normal T cell expressed and secreted,RANTES)的表达,诱导巨噬细胞自噬,减轻ox-LDL引起的炎症反应。Lv等[34]发现小檗碱抑制Akt/IRF3信号通路,显著下调人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)中血管细胞黏附因子-1(vascular cell adhesion molecule-1,VCAM-1)和细胞间黏附因子-1(intercellular cell adhesion molecule-1,ICAM-1)的表达,从而减轻血管内皮的炎症反应和阻止动脉粥样硬化的进展。Wang等[35]指出小檗碱可以通过激活AMPK信号通路,上调依赖性解偶联蛋白2的表达,减少氧化应激和血管炎症,抑制动脉粥样硬化的形成。Pei等[36]研究揭示出小檗碱通过抑制NF-κB/AMPK信号通路,下调半乳糖凝集素-3的表达,减轻ox-LDL诱导的巨噬细胞活化。
部分小檗碱衍生物也可通过抑制炎症反应发挥预防动脉粥样硬化的作用,且效果明显优于小檗碱。Feng等[37]研究表明8-十六烷基小檗碱可以有效下调ICAM-1、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和IL-6的mRNA水平,抑制NF-κB向细胞核的易位,显著降低动脉粥样硬化小鼠主动脉中IL-1β和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的血清水平和动脉粥样硬化斑块面积,其有效剂量仅为小檗碱的1/10。Chen等[38]证明了2个小檗碱衍生物二氢小檗碱和8,8-二甲基二氢小檗碱可以显著下调细胞外基质金属蛋白酶诱导因子、细胞浆糖蛋白CD68和NF-κB p65的表达,其中8,8-二甲基二氢小檗碱还能有效下调主动脉斑块中基质金属蛋白酶-9、ICAM-1和VCAM-1的表达,2个小檗碱衍生物在抑制炎症反应、减少斑块大小和脆弱性方面效果优于小檗碱。
血管内皮功能障碍是动脉粥样硬化的早期事件。高氧化应激和NO可用性降低是导致内皮功能障碍的主要原因。血管内皮是血液与血管壁之间的屏障,其可以调节血管舒张和收缩、生长抑制和促进,以及抗炎和促炎的平衡,维持血管的张力和结构,控制血小板功能和炎症反应。血管内皮受到损伤后,血管内的血脂沉积到血管内皮下,引起炎症反应,导致纤维组织增生,血管内斑块形成,从而引起动脉粥样硬化。近年来,许多专家学者指出小檗碱及其衍生物可以通过调节ROS水平、促进NO生成和减少钙内流来改善内皮功能障碍,进而防止动脉粥样硬化的形成。小檗碱改善内皮功能障碍的作用机制见图3。
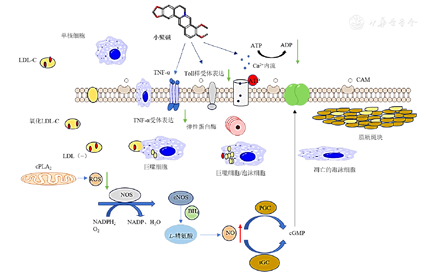

ATP—三磷酸腺苷;ADP—腺苷二磷酸;LDL—低密度脂蛋白;LDL-C—LDL胆固醇;TNF-α—肿瘤坏死因子-α;cPLA2—胞浆型磷脂酶A2;ROS—活性氧;NOS—一氧化氮合酶;eNOS—内皮型一氧化氮合成酶;NADP—烟酰胺腺嘌呤二核苷酸磷酸;NADPH—还原型烟酰胺腺嘌呤二核苷酸磷酸;PGC—鸟苷酸环化酶;cGMP—环磷酸鸟苷;sGC—可溶性鸟苷酸环化酶;NO—一氧化氮
在生理情况下,线粒体ROS参与血管稳态维持及血管功能调节,而在病理情况下,过量的ROS产生会使天然的抗氧化防御系统失衡,从而造成ROS积累和内皮细胞损伤[8]。Wu等[39]研究结果表明小檗碱可以通过调节心肌细胞内ROS的水平,显著改善阿霉素诱导的氧化应激和线粒体损伤。Caliceti等[40]研究显示小檗碱能降低人脐静脉内皮细胞内的ROS水平,激活Akt信号通路,抑制血凝素样氧化LDL受体-1(lectin-like oxidized low-density lipoprotein receptor-1,LOX-1)的表达和氧化应激,改善内皮功能障碍。
NO是脉管系统中一个重要的保护性分子,主要由血管内皮细胞中的一氧化氮合成酶(nitric oxide synthase,eNOS)产生。四氢生物碟呤(tetrahydrobiodisc,BH4)是NO合成和内皮功能调节的重要辅助因子,它可以调控eNOS将L-精氨酸氧化为L-瓜氨酸和NO。BH4缺乏会导致eNOS解偶联,NO合成减少,ROS产生增多,从而损伤血管内皮功能;而补充外源性或内源性BH4,能提高eNOS的活性,促进NO的产生,进而改善eNOS解偶联所致的内皮功能障碍[41]。Kang等[42]研究表明小檗碱通过抑制血管紧张素转化酶,增加血管组织中NO和环磷酸鸟苷的产生。王春梅等[43]研究显示小檗碱可以上调eNOS的表达,促进NO生成,保护软脂酸引起的血管内皮细胞损伤。Zhang等[44]报道了小檗碱通过上调eNOS的表达和下调NOX4表达,促进NO生成,减少ROS产生,改善榈酸诱导的人脐静脉内皮细胞的功能障碍。
钙离子是心肌和血管平滑肌电兴奋和机械收缩的重要物质,其可通过细胞膜上的钙通道进入细胞,增强心肌收缩力,加速心率和升高血压。钙离子拮抗剂是重要的预防动脉粥样硬化药物之一,其既能通过减少钙内流,减轻钙离子超载所致的动脉壁损害,又能抑制脂质过氧化,保护内皮细胞。Dai等[45]研究表明小檗碱可以减少钙内流,抑制内皮炎症小体NLRP3,在炎症性血管损伤中表现出潜在的特异性治疗价值。
肠道微生物群的组成变化对于动脉粥样硬化的发生和发展有重要的影响,肠道微生物紊乱不仅可通过直接影响机体的胆碱代谢、诱发氧化应激和炎症反应等机制直接引起动脉粥样硬化的发生发展,而且可通过影响动脉粥样硬化的危险因素间接促进动脉粥样硬化的进展。Sun等[46]研究表明小檗碱可以抑制肠道微生物群中的胆盐水解酶活性,显著增加肠道中的牛磺胆酸,激活肠道法尼醇X受体信号通路,减少肝脏中长链脂肪酸的摄取。Shi等[47]研究显示经小檗碱治疗与未经小檗碱治疗的高脂饮食ApoE−/−小鼠的肠道微生物特征显著不同,说明小檗碱可以通过调节肠道微生物群的组成,预防动脉粥样硬化。Zhu等[48]报道了小檗碱可以下调肠道中促炎细胞因子和趋化因子的表达,上调肠道中紧密连接蛋白的表达,增加结肠黏液层的厚度和Akkermansia spp.的丰度,进而恢复肠道屏障完整性,预防动脉粥样硬化。Wu等[49]发现小檗碱可以显著改变肠道微生物群的群落组成结构,增加Roseburia、Blautia、Allobaculum、Alistipes和Turicibacter属的丰度,减轻高脂饮食诱导的动脉粥样硬化。Li等[50]研究揭示出小檗碱可以通过肠道微生物群重塑,抑制共生微生物三甲胺(trimethylamine,TMA)/三甲胺N-氧化物(trimethylamine N-oxide,TMAO)的产生,改变肠道微生物群组成和微生物群功能,起到预防动脉粥样硬化的作用。
小檗碱作为一个天然来源的抗感染药物,因其具有多种生物学活性,近年来受到了国内外医药学者的广泛关注。除传统的抗痢疾杆菌活性外,小檗碱在治疗肿瘤、糖尿病、心律失常、高脂血症和动脉粥样硬化等方面的作用亦逐渐被发现和阐明。随着老药新用研究的不断深入,小檗碱预防动脉粥样硬化的作用机制研究成为心血管疾病治疗领域所关注的问题之一。大量研究证据表明小檗碱可以通过调脂作用、抑制氧化应激与炎症反应、改善内皮功能障碍和调节肠道微生物群等途径,防治动脉粥样硬化。基于此,小檗碱的直接作用靶点陆续被发现,但其同时调节多种信号通路和整个分子生物学网路的作用机制尚未完全阐明,导致绝大多数应用研究仅停留在实验室阶段,严重制约了其临床研究的开展。虽然一些小檗碱衍生物在改善实验性动脉粥样硬化方面表现出明显优于小檗碱的效果,但是它们的化学结构大多只是在小檗碱及其代谢产物二氢小檗碱的基础上进行简单的取代反应,构效关系研究相对较少。相信随着现代科学技术的发展,在现代中医药理论指导下,充分运用网络药理学、生物信息学、转录组学、蛋白质组学、微生物组学和代谢组学等先进技术,小檗碱及其衍生物多靶向作用机制的科学内涵必将得到进一步阐释,为预防动脉粥样硬化提供新的临床解决方案。
所有作者均声明不存在利益冲突



























