
探讨细胞质脆性X智力低下蛋白1结合蛋白2(CYFIP2)过表达对膀胱癌T24细胞的生物学功能和Wnt/β-连环蛋白(β-catenin)信号通路的影响。
对照组为转染pcDNA3空载体的T24细胞,过表达组为转染CYFIP2过表达载体的T24细胞。采用逆转录酶定量聚合酶链式反应和Western Blot检测CYFIP2 mRNA和蛋白的表达,CCK-8检测CYFIP2过表达对T24细胞增殖的影响,Transwell检测CYFIP2过表达对T24细胞迁移和侵袭的影响,并通过Western Blot检测CYFIP2过表达对T24细胞Wnt/β-catenin信号通路的影响。
与对照组相比,过表达组CYFIP2 mRNA和蛋白的表达水平均升高(均P<0.001),细胞增殖、迁移和侵袭能力均减弱(均P<0.01)。CYFIP2过表达的T24细胞中β-catenin、c-Myc和细胞周期蛋白D1(Cyclin D1)的蛋白表达均下调(均P<0.05),而p-β-catenin的蛋白水平增加(P<0.05)。
CYFIP2过表达能够抑制T24细胞增殖、迁移和侵袭,其可能的分子机制与Wnt/β-catenin信号通路受到抑制有关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
膀胱癌属于泌尿系统恶性肿瘤,是全球发病率和死亡率最高的常见恶性肿瘤之一。根据2020年全球癌症统计数据,约有573 000、213 000例新发病例和死亡病例[1,2]。目前,手术、放疗、化疗和免疫治疗是治疗膀胱癌的主要策略,但对一些容易复发以及转移的患者治疗效果较差,尤其是膀胱癌患者的术后生活质量也较差[3,4]。因此,发现早期诊断膀胱癌的标志物以及新的有效治疗靶点成为该领域的研究热点。
目前,膀胱癌中众多基因存在异常表达,并且大部分基因的功能与分子机制尚不清楚。细胞质脆性X智力低下蛋白1结合蛋白2(cytoplasmic fragile X mental retardation protein 1 binding protein 2,CYFIP2)编码细胞质脆性X智力低下蛋白(fragile X mental retardation protein,FMRP),最初在神经发育中发挥重要作用[5,6]。研究发现,CYFIP2与肿瘤的发生发展密切相关。CYFIP2又称p53诱导蛋白121,是一种功能域和结构基序未知的一种新型p53介导的促凋亡蛋白[7,8]。CYFIP2在结直肠癌、胃癌、宫颈癌和肾透明细胞癌中具有明显的抑制作用[8,9,10,11]。但CYFIP2在膀胱癌中的作用和机制均不清楚。本研究通过生物信息学方法预测CYFIP2在膀胱癌组织中的表达水平,以及CYFIP2表达高低与膀胱癌患者生存期之间的关系。以人膀胱癌T24细胞为研究对象,转染CYFIP2过表达质粒,研究CYFIP2过表达对T24细胞增殖、迁移和侵袭的细胞生物学功能的影响,同时探讨CYFIP2对Wnt/β-catenin信号通路潜在的调节机制,并为进一步探索膀胱癌新的诊疗靶点提供新的见解。
T24细胞(武汉普诺赛生命科技有限公司),胎牛血清(以色列Biological Industries公司),胰蛋白酶-乙二胺四乙酸消化液(0.25%)含酚红、RPMI 1640培养基、青霉素-链霉素混合溶液(100×)、高效RIPA裂解液和BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司),聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜和脂质体3000(美国Invitrogen公司),Trizol试剂(上海生工生物工程技术服务有限公司),细胞周期蛋白D1(Cyclin D1)抗体(60186-1-Ig)、c-Myc抗体(10828-1-AP)和β-Tubulin抗体(10094-1-AP,武汉三鹰生物技术有限公司),CYFIP2抗体(货号ab95969,英国Abcam公司),p-β-catenin抗体(货号9561)、β-catenin抗体(货号8480)(美国CST公司),羊抗兔二抗(武汉爱博泰克生物科技有限公司),CCK-8试剂盒、逆转录试剂盒、荧光定量PCR试剂盒(Biosharp,北京兰杰柯科技有限公司)。
Transwell小室(美国密理博Millipore公司),BioTek Epoch全波长酶标仪(美国BioTek公司)、凝胶成像分析仪(上海天能公司),细胞培养板、细胞培养瓶(无锡耐思生命科技股份有限公司),力康HF90恒温CO2培养箱(力康生物医疗科技控股有限公司),荧光定量聚合酶链反应(polymerase chain reaction,PCR)分析仪(美国Thermo Fisher公司),倒置显微镜(日本Nikon公司)。
T24细胞培养需要RPMI 1640培养基,其中含10%胎牛血清和1%青霉素-链霉素双抗(青霉素100 U/ml;链霉素100 μg/ml),培养条件为含有5% CO2和恒温37 ℃ CO2培养箱。实验分为对照组和过表达组,对照组为转染pcDNA3空载体的T24细胞,过表达组为转染CYFIP2过表达载体的T24细胞,委托通用生物(安徽)股份有限公司构建载体。处于对数生长期的T24细胞,经胰蛋白酶消化后接种至6孔板(1.2×106/孔),置含有5% CO2和恒温37 ℃ CO2培养箱培养18~24 h。待细胞密度达60%左右时,采用脂质体3 000进行瞬时转染,转染后6 h后更换新鲜培养液并继续在细胞培养箱中培养48 h。
T24细胞转染pcDNA3空载体和CYFIP2过表达载体36 h后,采用Trizol法分别提取总的RNA,然后采用逆转录试剂盒合成单链cDNA。20 μl PCR反应体系配制如下:2×SYBR Green qPCR Mix 10.0 μl,分别添加0.5 μl正反向引物(10 μmol/L),cDNA模板分别加1.0、8 μl无菌双蒸馏水。PCR反应条件:95 ℃预变性处理2 min,95 ℃变性处理5 s,60 ℃退火30 s,72 ℃延伸30 s,反应循环数40个。样品扩增计算采用比较Ct值法来获取CYFIP2 mRNA在各组细胞中的相对表达量(2−ΔΔCt),以GAPDH为内参。PCR引物由通用生物(安徽)股份有限公司合成,实时荧光定量PCR(real-time quantitative-PCR,RT-qPCR)引物序列如表1所示,且每组实验重复操作3次。

引物序列
引物序列
| 引物名称 | 序列(5’-3’) | 长度(nt) |
|---|---|---|
| CYFIP2 | 正向引物:CAACGTGGACCTGCTTGAAGA | 21 |
| 反向引物:AGTTTGTGTCAAAGTTAGCCTGG | 23 | |
| GAPDH | 正向引物:CTGGGCTACACTGAGCACC | 19 |
| 反向引物:AAGTGGTCGTTGAGGGCAATG | 21 |
注:CYFIP2—细胞质脆性X智力低下蛋白1结合蛋白2;GAPDH—甘油醛-3-磷酸脱氢酶
采用Western Blot法检测蛋白表达。T24细胞转染pcDNA3空载体和CYFIP2过表达载体48 h后,使用预冷的1×PBS洗涤细胞3次,然后加入含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA高效裂解液,4 ℃裂解细胞30 min提取总蛋白,并经过超声进一步裂解。用BCA法测定蛋白浓度,将所有样本调整至相同浓度,按照比例加入5×十二烷基硫酸钠(sodium dodecyl sulfate,SDS)上样缓冲液,然后在100 ℃条件下变性处理10 min。先根据蛋白的相对分子质量不同选择合适浓度的蛋白胶,进行SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)垂直电泳,然后将蛋白水平转印至PVDF膜上。根据蛋白预染Marker的大小裁剪对应相对分子质量大小的PVDF膜,在含有5%脱脂奶粉的封闭液中室温封闭1 h,然后用1×TBST洗掉PVDF膜上的脱脂奶粉,加入至一抗稀释液中,4 ℃孵育过夜。一抗浓度稀释如下:Cyclin D1抗体(1∶5 000)、c-Myc抗体(1∶5 000)和β-Tubulin(1∶5 000),CYFIP2抗体(1∶1 000),p-β-catenin抗体(1∶1 000)、β-catenin抗体(1∶1 000)。翌日,用1×TBST洗掉PVDF膜上多余的一抗,加入羊抗兔二抗(1∶5 000)室温孵育2 h,再用1×TBST洗掉PVDF膜上多余的二抗。采用用电化学发光法进行曝光以及用Image J图像处理软件进行灰度分析。然后根据结果进行量化,用目的蛋白灰度值/内参的灰度值进行量化矫正,以每个蛋白对照组的相对表达量为1,把过表达组灰度值/对照组灰度值所得到的数值指标定义为蛋白变化倍数。
细胞增殖实验采用CCK-8法进行检测。用胰蛋白酶消化处理细胞转染pcDNA3空载体和CYFIP2过表达载体的对照组和过表达组细胞,吹打均匀至单细胞悬液,离心收集细胞并进行计数,按照每孔2 000个细胞的数量接种至96孔细胞板(100 μl/孔),每组设置3个复孔。置含有5% CO2和恒温37 ℃CO2培养箱培养,分别在培养0、24、48、72 h加入10 μl CCK-8试剂后孵育2 h,各组细胞的增殖情况在450 nm的波长下使用酶标仪检测吸光度(A)值。每组实验重复3次。
采用Transwell法检测各组细胞迁移和侵袭能力。T24细胞转染24 h后,首先用胰蛋白酶消化对照组和过表达组细胞,离心收集细胞,然后在无血清的RIPM 1640培养基中重新悬浮,制备单细胞悬液并进行计数。对于细胞迁移实验,取Transwell小室置于24孔板中,在上层小室中加入200 μl细胞悬液,细胞总数为密度为1.0×105个。在对应的24孔细胞培养板中加入700 μl含有20%胎牛血清的RPIM 1640完全培基,置含有5% CO2和恒温37 ℃ CO2培养箱培养48 h。然后取出Transwell小室,用4%多聚甲醛固定细胞20 min,然后用0.1%结晶紫染色5 min,最后用蒸馏水把结晶紫冲洗干净,于显微镜下拍照并用Image J图像处理软件对迁移细胞进行计数。对于细胞侵袭实验,Transwell小室需要提前1 d覆盖Matrigel基质胶并在4 ℃过夜。第2天,先将加入Transwell小室的24孔板取出,在37 ℃孵育1 h,然后在上层小室中加入200 μl细胞悬液,细胞总数为密度为5.0×105个。在对应的24孔细胞培养板中加入700 μl含有20%胎牛血清的RPIM 1640完全培基,置含有5% CO2和恒温37 ℃ CO2培养箱培养48 h。取出Transwell小室,处理与计数方法与细胞迁移实验相同。
采用SPSS 22.0和GraphPad Prism 8统计软件包进行数据分析,数据采用均数±标准差( ±s)表示,所有实验重复3次。两组间比较采用Student独立t检验和进行分析。以P<0.05为差异有统计学意义。
±s)表示,所有实验重复3次。两组间比较采用Student独立t检验和进行分析。以P<0.05为差异有统计学意义。
由于CYFIP2在膀胱癌组织中的表达水平尚不清楚,首先通过在线生物信息学网站TNMplot(https://tnmplot.com/analysis/)进行预测[12],发现CYFIP2在膀胱癌组织中的转录水平明显低于正常膀胱癌组织(P=0.007 45);然后,通过Kaplan Meier plotter(http://kmplot.com/analysis/)在线分析工具对生存曲线进行分析[13],发现以CYFIP2高表达为特征的膀胱癌患者的10年总生存率明显高于CYFIP2低表达的膀胱癌患者(P=0.035)。(图1)
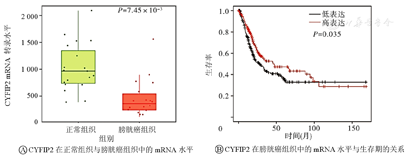

CYFIP2—细胞质脆性X智力低下蛋白1结合蛋白2
与对照组相比,CYFIP2过表达组T24细胞中CYFIP2 mRNA水平明显增加(P<0.001),进一步Western Blot结果表明CYFIP2的蛋白表达水平也增加。(图2)
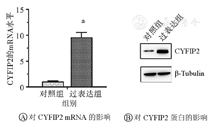
 ±s,n=3)
±s,n=3)
CYFIP2—细胞质脆性X智力低下蛋白1结合蛋白2;β-Tubulin—β-微管蛋白。与对照组相比,aP<0.001
 ±s,n=3)
±s,n=3)CCK-8结果显示,与对照组相比,CYFIP2过表达组T24细胞在转染48 h后的增殖能力降低(P<0.01);转染72 h后的增殖能力也降低(P<0.001)。(图3)
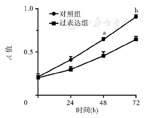
 ±s,n=3)
±s,n=3)
CYFIP2—细胞质脆性X智力低下蛋白1结合蛋白2。与对照组相比,aP<0.01,bP<0.001
 ±s,n=3)
±s,n=3)Transwell迁移实验结果显示,与对照组相比,CYFIP2过表达组穿膜相对细胞数明显减少(P<0.01);同样地,Transwell侵袭实验结果显示,CYFIP2过表达组穿膜相对细胞数也明显减少(P<0.001)。说明CYFIP2过表达可以抑制T24细胞迁移和侵袭的能力。(图4)
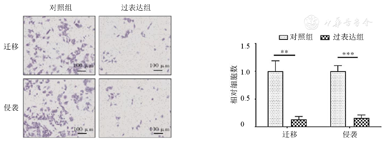

CYFIP2—细胞质脆性X智力低下蛋白1结合蛋白2。与对照组相比,aP<0.01;bP<0.001
Western Blot结果显示,与对照组相比,CYFIP2过表达组Wnt/β-catenin信号通路的关键蛋白β-catenin的蛋白水平降低,而p-β-catenin的蛋白水平增加。以上结果表明,过表达CYFIP2可以通过增加β-catenin的蛋白磷酸化水平促进β-catenin的降解,进而达到抑制Wnt/β-catenin信号通路的作用。进一步实验结果显示,Wnt/β-catenin下游靶基因c-Myc和Cyclin D1的蛋白表达均显著下调。(图5)
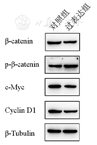

CYFIP2—细胞质脆性X智力低下蛋白1结合蛋白2;β-catenin—β-连环蛋白;p-β-catenin—磷酸化β-连环蛋白;c-Myc—原癌基因;Cyclin D1—周期性调控因子D1;β-Tubulin—β-微管蛋白
CYFIP基因家族有2个高度保守的成员CYFIP1和CYFIP2,它们是相对分子质量约145 000的蛋白,氨基酸序列同源性高(95%相似)。CYFIP2常被用于神经疾病的研究,并与神经元功能相关[14]。CYFIP2被认为是智力残疾和自闭症的候选基因[15],同时也被认为是治疗阿尔茨海默病的潜在靶点[16]。另外,CYFIP2在癌症发生进展中也发挥关键作用。
全外显子组测序研究显示台湾人群中CYFIP2与突变动力学、遗传变异、异常DNA修复、肿瘤细胞周期控制和凋亡通路相关[17]。与非癌组织相比,胃癌组织中CYFIP2 mRNA表达明显降低,敲低CYFIP2可促进细胞增殖和集落形成,抑制细胞凋亡[9]。此外,研究表明,过表达CYFIP2能促进结直肠癌细胞的凋亡样死亡[18]。在宫颈癌中,SNF1/AMP激酶相关激酶2沉默能够通过上调CYFIP2表达进而抑制宫颈癌细胞的增殖、迁移和上皮间质转化[10]。目前,CYFIP2是否与膀胱癌的发生发展有关尚不清楚。首先,本研究通过生物信息学分析方法预测了CYFIP2在膀胱癌中表达水平是显著下调的,并且高表达CYFIP2的膀胱癌患者生存期显著延长。然后,转染CYFIP2过表达载体后,通过RT-qPCR等实验证实了T24细胞中的CYFIP2基因表达水平显著增加;同时T24细胞的增殖活性、迁移和侵袭能力明显受到抑制,初步证明了CYFIP2在膀胱癌中的抑癌作用。
Wnt/β-catenin信号通路是一种典型的信号通路,当Wnt/β-catenin信号通路异常激活时,会影响膀胱癌的发生发展[19]。β-catenin高表达可激活Wnt/ β-catenin信号通路,而β-catenin磷酸化后降解可抑制Wnt/β-catenin信号通路的激活[20]。研究表明,胰岛素样生长因子Ⅱ mRNA结合蛋白1促进结肠癌细胞增殖和生存的分子机制是通抑制β-catenin/T细胞因子下游的促凋亡蛋白CYFIP2在调节K-Ras表达中发挥重要作用[18]。此外,在胃癌中,抑制CYFIP2可显著增加磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt)蛋白水平,从而通过激活磷脂酰肌醇三羟基激酶(phosphoinositide-3 kinase,PI3K)/Akt信号通路促进胃癌细胞增殖和5-氟尿嘧啶的化疗耐药性[9]。众所周知,PI3K/Akt信号通路能通过直接或者间接的方式激活Wnt/β-catenin信号通路[21]。本研究发现,T24细胞中过表达CYFIP2后,Wnt/β-catenin信号通路受到显著抑制,初步证明其机制可能与调控Wnt/β-catenin信号通路活性相关。
综上所述,本研究通过生物信息学方法预测CYFIP2膀胱癌患者肿瘤组织中的表达水平低于癌旁正常组织,CYFIP2高表达的患者具有高的生存率,提示CYFIP2在膀胱癌发生、发展过程中可能起重要作用。CYFIP2过表达可抑制膀胱癌细胞增殖、迁移和侵袭的能力,并初步证明其分子机制可能与Wnt/β-catenin信号通路的抑制有关。因此,本研究为初步了解CYFIP2与膀胱癌相关的分子机制提供了实验基础,可能对膀胱癌的分子诊断和靶向治疗提供有用的帮助。
所有作者均声明不存在利益冲突































