
研究胰岛素腹腔注射配合饮食干预对自发性2型糖尿病KKAy小鼠血糖调控的效果。
建立2型糖尿病动物模型,选取健康C57BL/6J小鼠作为正常对照组,健康KKAy小鼠作为未发病组,将建模成功的KKAy小鼠随机分为皮下胰岛素治疗组、腹腔胰岛素治疗组和发病不治疗组。未发病组给予维持饲料,其他组全部采用高脂高糖饲料。每日喂养时间为08:00至20:00,间隔4 h喂养1次,共4次。皮下和腹腔胰岛素治疗组在喂养前分别进行胰岛素皮下和腹腔注射,第1次喂养前注射重组甘精胰岛素注射液(皮下组:0.125 IU/g;腹腔组:0.250 IU/g),间隔0.5 h后注射生物合成人胰岛素注射液(皮下组:0.075 IU/g;腹腔组:0.125 IU/g);其余3次喂养前,注射生物合成人胰岛素注射液(皮下组:0.075 IU/g;腹腔组:0.125 IU/g),共给药4周。定期检测各组小鼠饮食量、体质量及空腹血糖、餐后1、2 h血糖,并进行口服葡萄糖耐受实验。
腹腔胰岛素治疗组小鼠的总饮食量低于皮下胰岛素治疗组;与初始体质量相比,第4周皮下和腹腔胰岛素治疗组体质量分别下降5.05、3.59 g;皮下和腹腔胰岛素治疗组空腹血糖变化分别为5.4~9.4、5.4~6.4 mmol/L;餐后1 h血糖变化分别为4.6~12.3、5.7~8.9 mmol/L;餐后2 h血糖变化分别为2.5~9.8、3.8~7.1 mmol/L。针对糖耐受指标,腹腔胰岛素治疗组在各时间点均有提高,皮下胰岛素治疗组除0、60 min外,其他时间点呈现下降。
配合饮食干预,胰岛素腹腔注射相比胰岛素皮下注射,对自发性2型糖尿病KKAy小鼠血糖的控制效果更佳,且对糖耐受具有明显改善作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2型糖尿病是由于胰岛β细胞分泌胰岛素不足或胰岛素敏感性下降而导致的代谢性疾病[1]。在研究2型糖尿病发病机制和治疗方案过程中,KKAy小鼠作为一种自发性2型糖尿病动物模型,伴有高血糖、胰岛素抵抗以及肥胖等特征[2]。对于2型糖尿病,胰岛素抵抗和肥胖问题将不利于血糖的稳定,且二者之间存在相互促进的作用[3,4]。同时胰岛素抵抗与糖耐量变化存在关联,研究发现我国人群糖耐量从正常到异常过程中,存在胰岛素分泌功能衰退和胰岛素抵抗[5]。研究表明胰岛素腹腔注射可以减小KK小鼠血糖波动,且降低低血糖发生概率[6]。此外,对2型糖尿病肥胖患者进行标准化饮食护理干预,结果证明可改善患者体质量和血糖[7]。因此,本研究参考KKAy小鼠肥胖和胰岛素抵抗明显等情况,对比胰岛素皮下注射,观察胰岛素腹腔注射配合饮食干预对自发性2型糖尿病KKAy小鼠血糖调控和改善糖耐受的效果。
SPF级5周龄雄性KKAy小鼠21只,动物生产许可证号SCXK(京)2014-0004(北京华阜康生物科技股份有限公司),清洁级5周龄雄性C57BL/6J小鼠6只,动物生产许可证号SCXK(蒙)2015-0001(内蒙古医科大学实验动物中心),所有小鼠饲养于清洁级环境中,室温20~25 ℃,自由饮水;高脂高糖饲料(主要成分包括玉米、豆粕、小麦麸、小麦次粉和蔗糖等,其中约含脂肪、碳水化合物和蛋白质分别为45.65%、37.89%、16.46%,总热量约为17.78 kJ/g,北京华阜康生物科技股份有限公司),维持饲料(主要成分包括粗蛋白、粗脂肪和粗纤维等,其中约含脂肪、蛋白质和碳水化合物分别为12.0%、20.6%、67.4%,总热量约为14.77 kJ/g,江苏省协同医药生物工程有限责任公司);GA-3型血糖仪及试纸(三诺生物传感股份有限公司),生物合成人胰岛素注射液[诺和诺德(中国)制药有限公司,笔芯,300 IU/3 ml],重组甘精胰岛素注射液(甘李药业股份有限公司,笔芯,300 IU/3 ml),葡萄糖注射液(湖北科伦药业有限公司,20 ml∶10 g)。
2型糖尿病动物模型建立:喂养KKAy小鼠高脂高糖饲料,当出现毛发油腻、多饮多尿、随机血糖值≥13.9 mmol/L时表明建模完成[2]。
动物分组:选取健康C57BL/6J小鼠作为正常对照组(n=6),健康KKAy小鼠作为未发病组(n=6),将建模成功的KKAy小鼠随机分为皮下胰岛素治疗组(n=6)、腹腔胰岛素治疗组(n=6)和发病不治疗组(n=3)。
饮食干预方案:未发病组给予维持饲料,其他组全部采用高脂高糖饲料。每日喂养时间为08:00至20:00,间隔4 h喂养1次,共4次。
胰岛素注射治疗方案:皮下和腹腔胰岛素治疗组在喂养前分别进行胰岛素皮下和腹腔注射,第1次喂养前注射重组甘精胰岛素注射液(皮下组:0.125 IU/g;腹腔组:0.250 IU/g),间隔0.5 h后注射生物合成人胰岛素注射液(皮下组:0.075 IU/g;腹腔组:0.125 IU/g);其余3次喂养前,注射生物合成人胰岛素注射液(皮下组:0.075 IU/g;腹腔组:0.125 IU/g),共给药4周。
每周检测所有组小鼠的饮食量和体质量;取小鼠尾尖血,测量空腹血糖、餐后1、2 h血糖,并在治疗前后进行口服葡萄糖耐受实验,每只小鼠按照2.5 g/kg葡萄糖进行灌胃,分别测定服糖前(空腹)及服糖后30、60、120 min的血糖。
采用SPSS 19.0软件进行统计学分析,经检验数据不符合正态分布,选用非参数检验Kruskal-Wallis检验比较除发病不治疗组外,各组间数据差异,运用中位数(四分位数间距)[M(QR)]表示,以P<0.05为差异有统计学意义。
如表1所示,除发病不治疗组外,各组全天总饮食量由大到小排列为:未发病组>皮下胰岛素治疗组>腹腔胰岛素治疗组>正常对照组。根据2种饲料的成分表可知,在同等质量条件下,高脂高糖饲料热量更高。根据摄入热量情况,除发病不治疗组外,从高到底排列为:皮下胰岛素治疗组>未发病组>腹腔胰岛素治疗组>正常对照组,即皮下胰岛素治疗组摄入总热量最大。
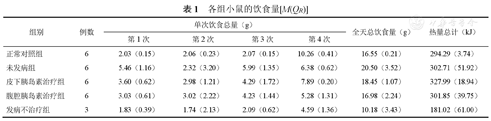
各组小鼠的饮食量[M(QR)]
各组小鼠的饮食量[M(QR)]
| 组别 | 例数 | 单次饮食总量(g) | 全天总饮食量(g) | 热量总计(kJ) | |||
|---|---|---|---|---|---|---|---|
| 第1次 | 第2次 | 第3次 | 第4次 | ||||
| 正常对照组 | 6 | 2.03(0.15) | 2.06(0.23) | 2.07(0.15) | 10.26(0.41) | 16.55(0.21) | 294.29(3.74) |
| 未发病组 | 6 | 5.46(1.16) | 2.32(3.20) | 5.99(1.35) | 6.38(0.62) | 20.50(3.52) | 302.71(51.92) |
| 皮下胰岛素治疗组 | 6 | 3.60(0.62) | 2.98(1.21) | 4.29(1.72) | 7.89(0.20) | 18.45(1.07) | 327.99(18.94) |
| 腹腔胰岛素治疗组 | 6 | 3.03(0.61) | 3.02(2.22) | 4.23(1.44) | 5.28(1.31) | 16.98(2.24) | 301.85(39.75) |
| 发病不治疗组 | 3 | 1.83(0.39) | 1.74(2.13) | 2.09(0.62) | 4.59(1.36) | 10.18(3.43) | 181.02(61.00) |
由表2所示,腹腔胰岛素治疗组起始体质量高于正常对照组、未发病组(均P<0.05),皮下胰岛素治疗组起始体质量高于正常对照组(P<0.05),表明KKAy小鼠2型糖尿病建模成功后,体质量会出现明显变化。治疗后,正常对照组和未发病组体质量未出现较大的波动。腹腔、皮下胰岛素治疗组体质量呈现缓慢下降的趋势,分别与正常对照组、未发病组在相同时间点差异有统计学意义(均P<0.05)。其中,皮下胰岛素治疗组第4周体质量相比起始体质量下降程度最大,推测皮下注射胰岛素对KKAy小鼠体质量下降具有促进作用。此外,观察到正常对照组和未发病组体质量并未因鼠种类和饮食的不同产生差异。
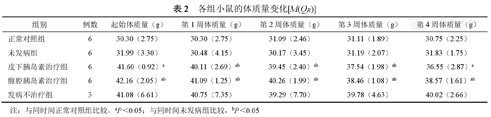
各组小鼠的体质量变化[M(QR)]
各组小鼠的体质量变化[M(QR)]
| 组别 | 例数 | 起始体质量(g) | 第1周体质量(g) | 第2周体质量(g) | 第3周体质量(g) | 第4周体质量(g) |
|---|---|---|---|---|---|---|
| 正常对照组 | 6 | 30.30(2.75) | 30.30(2.75) | 31.09(2.46) | 31.11(1.89) | 30.75(2.25) |
| 未发病组 | 6 | 31.99(3.30) | 30.48(4.15) | 30.17(3.45) | 31.19(2.07) | 31.83(1.75) |
| 皮下胰岛素治疗组 | 6 | 41.60(0.92)a | 40.11(2.69)ab | 39.45(2.40)ab | 37.54(1.98)ab | 36.55(2.87)a |
| 腹腔胰岛素治疗组 | 6 | 42.16(2.05)ab | 41.09(1.25)ab | 40.26(1.99)ab | 38.46(1.08)ab | 38.57(1.61)ab |
| 发病不治疗组 | 3 | 41.08(6.61) | 40.75(7.35) | 39.29(7.70) | 39.78(4.63) | 40.02(2.66) |
注:与同时间正常对照组比较,aP<0.05;与同时间未发病组比较,bP<0.05
如表3所示,治疗后,腹腔、皮下胰岛素治疗组的空腹血糖与正常对照组和未发病组比较差异均无统计学意义(均P>0.05),且2种注射方式对空腹血糖的调控作用相似。
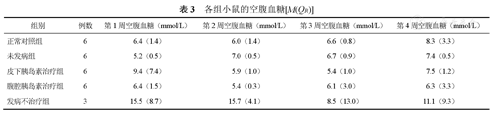
各组小鼠的空腹血糖[M(QR)]
各组小鼠的空腹血糖[M(QR)]
| 组别 | 例数 | 第1周空腹血糖(mmol/L) | 第2周空腹血糖(mmol/L) | 第3周空腹血糖(mmol/L) | 第4周空腹血糖(mmol/L) |
|---|---|---|---|---|---|
| 正常对照组 | 6 | 6.4(1.4) | 6.0(1.4) | 6.6(0.8) | 8.3(3.3) |
| 未发病组 | 6 | 5.2(0.5) | 7.0(0.5) | 6.7(0.9) | 7.4(0.5) |
| 皮下胰岛素治疗组 | 6 | 9.4(7.4) | 5.9(1.0) | 5.4(1.0) | 7.5(1.2) |
| 腹腔胰岛素治疗组 | 6 | 6.4(1.5) | 5.4(0.3) | 6.1(3.0) | 6.3(3.3) |
| 发病不治疗组 | 3 | 15.5(8.7) | 15.7(4.1) | 8.5(13.0) | 11.1(9.3) |
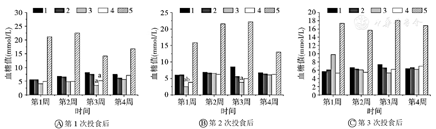
如图1所示,皮下胰岛素治疗组分别在第2周第1次投食和第3周第2次投食,与未发病组和正常对照组比较差异具有统计学意义(均P<0.05)。腹腔胰岛素治疗组与正常对照组和未发病组相比差异均无统计学意义(均P>0.05)。
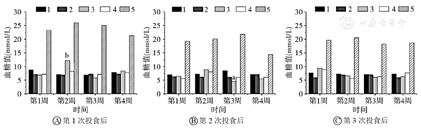

1—正常对照组;2—未发病组;3—皮下胰岛素治疗组;4—腹腔胰岛素治疗组;5—发病不治疗组。与同时间正常对照组比较,aP<0.05;与同时间未发病组比较,bP<0.05
如图2所示,皮下胰岛素治疗组分别在第1周第2次投食、第3周第1、2次投食,餐后2 h血糖值与正常对照组和/或未发病组差异具有统计学意义(均P<0.05);腹腔胰岛素治疗组仅在第3周第1次投食与正常对照组相比差异具有统计学意义(P<0.05)。

1—正常对照组;2—未发病组;3—皮下胰岛素治疗组;4—腹腔胰岛素治疗组;5—发病不治疗组。与同时间正常对照组比较,aP<0.05;与同时间未发病组比较,bP<0.05
根据上述结果,第4周各组血糖最大波动范围(最高血糖值与最低血糖值之差)分别是:正常对照组1.9 mmol/L;未发病组1.4 mmol/L;皮下胰岛素治疗组2.9 mmol/L;腹腔胰岛素治疗组1.7 mmol/L;发病不治疗组10.2 mmol/L。即发病不治疗组波动最大,未发病组波动最小,腹腔胰岛素治疗组波动接近正常对照组,且优于皮下胰岛素治疗组。
如图3所示,腹腔胰岛素治疗组0、30、60 min的糖耐受均提高(均P<0.05),皮下腹腔胰岛素治疗组除0 min(P<0.05)和60 min外,其他时间点皮下胰岛素治疗组在治疗后糖耐受均呈现下降。
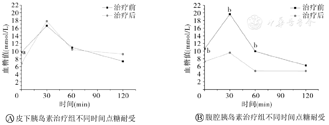

与同时间皮下胰岛素治疗组治疗后比较,aP<0.05;与同时间腹腔胰岛素治疗组治疗后比较,bP<0.05
目前,2型糖尿病仍然是难以完全治愈的慢性疾病,2型糖尿病并发症会对人体造成严重危害。由于胰岛β细胞分泌功能受损,胰岛素分泌不足,导致血糖及游离脂肪酸升高,促使胰岛素抵抗加重,也造成胰岛β细胞进一步损伤[8]。可见,糖脂代谢紊乱和胰岛素抵抗等与2型糖尿病紧密关联。已有研究证明,腹腔注射胰岛素对糖尿病血糖平稳,纠正脂代谢异常等方面优于皮下注射胰岛素[6,9,10]。不同于正常生理条件,皮下胰岛素注射后导致全身高胰岛素血症和肝低胰岛素血症[10]。与之相反,腹腔胰岛素注射可使胰岛素浓度分布与正常生理情况相同[11,12]。研究表明,腹腔注射胰岛素可以刺激胰岛素样生长因子-Ⅰ合成,增加胰岛素的敏感性[6,13,14]。另外,腹腔注射胰岛素针对低血糖发生时,血液中的胰高血糖素大幅度提高,且糖原分解明显增加,进而防止低血糖发生[6,15,16]。本研究结果与上述研究报道一致,腹腔注射胰岛素可以降低KKAy小鼠低血糖发生率,改善糖耐受。此外相关研究证明,腹腔注射胰岛素控制KK小鼠血糖的有效剂量范围为皮下给药最适剂量的±21%[6]。本研究观察到腹腔胰岛素治疗组的剂量是皮下胰岛素治疗组的1.5~2倍,这与KKAy小鼠肥胖和胰岛素抵抗等特征可能存在关联,还需进一步研究。
流行病学数据显示,肥胖会增加2型糖尿病的发病风险,其中肥胖者患有2型糖尿病的概率是体质量正常者的6.28倍,同时体质量下降与胰岛素抵抗减低的改善相关[17,18]。本研究结果表明,单纯进行饮食控制(发病不治疗组)对体质量及血糖值作用有限,这是因为本研究仅显示了饮食量干预结果,未涉及饮食营养配比的研究。腹腔、皮下胰岛素治疗组在相同饮食干预的条件下,腹腔胰岛素治疗组血糖相对稳定,糖耐受得到改善。本研究同时观察到,皮下胰岛素治疗组饮食量高于腹腔胰岛素治疗组,但是皮下胰岛素治疗组体质量下降程度大于腹腔胰岛素治疗组,提示胰岛素腹腔注射可能会提高KKAy小鼠糖利用效果。腹腔注射胰岛素对KKAy小鼠糖代谢的调控可能存在多因素协同作用,其机制还需进一步实验证明。
综上所述,腹腔注射胰岛素配合饮食干预,实现了对自发性2型糖尿病KKAy小鼠血糖的有效控制,更好的稳定血糖变化,对提高糖耐受具有一定作用。鉴于KKAy小鼠具有黄色肥胖和胰岛素抵抗特征,研究该模型的胰岛素治疗效果,对于深入了解相关基因的功能,理解胰岛素腹腔给药作用机制具有积极意义。
所有作者均声明不存在利益冲突



























