
宫颈癌是世界上女性癌症排名第4位的恶性肿瘤,严重威胁女性的健康。宫颈癌患者的主要治疗方案为手术或同步放化疗,随着医学研究的发展,研究者们致力于探究更为有效、特异的治疗方案,以期增加宫颈癌的治疗策略和提高治疗效果。簇状规则间隔短回文重复序列(CRISPR)/CRISPR相关蛋白9(Cas9)技术是Cas9蛋白利用向导RNA(gRNA)的引导进而靶向目标基因,实现对目标基因精准编辑的方法。目前,CRISPR/Cas9技术已成为一种很有前途的强大基因编辑工具,是一种新的有效的靶向治疗方法,且被应用于多种肿瘤的治疗中。主要从作用靶点、联合治疗策略以及相关耐药基因筛选等方面对CRISPR/Cas9技术在宫颈癌治疗中的研究进展进行综述,以期为宫颈癌的治疗提供新的策略。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
宫颈癌是危害女性健康最常见的恶性肿瘤之一。根据国际癌症研究机构团队2021年发表的最新全球癌症统计报告显示[1]:2020年,全球女性中新增宫颈癌发病例为604 127例,死亡病例为341 831例,全球185个国家中有36个国家女性的首发癌症为宫颈癌,严重威胁着女性的身心健康。尤其针对中晚期宫颈癌患者来说,不能仅依靠单纯的手术或放疗,需要进行更加综合性的治疗方案,以期提高治疗效果[2]。因此,迫切需要研究新的治疗模式和治疗方法以期改善宫颈癌患者的预后,提高患者的生存率。
基因编辑技术是一种新兴的分子生物学技术,主要是针对某个特定的基因位点进行人为的改变,如插入、替换、删除等,最终改变目的基因的表达性状,从而达到对目的基因进行功能的研究。簇状规则间隔短回文重复序列(clustered regularly interspaced short palindromic repeat,CRISPR)/CRISPR相关蛋白9(CRISPR-associated protein 9,Cas9)是继锌指核酸内切酶(zinc finger endonuclease,ZFN)和类转录激活因子效应物核酸酶(transcription activator like effector nuclease,TALEN)后的一种新型基因编辑技术。CRISPR/Cas9自从发现以来就受到了广泛的关注,因在基因组编辑和纠正偶然突变方面的潜在能力,其被应用于多种癌症研究中,不仅可以用来癌症诊断,同时也是一种有效的癌症治疗策略[3]。本文主要综述了CRISPR/Cas9技术目前在宫颈癌治疗中的应用现状和应用潜力,以期为宫颈癌的治疗提供新的研究思路。
CRISPR是一种存在于细菌和古细菌中由RNA介导的适应性免疫防御系统,1987年,首次被日本科学家在大肠杆菌中发现[4]。CRISPR/Cas系统是通过使用CRISPR RNA(crRNA)来引导入侵的核酸沉默,从而使细菌或古细菌把病毒基因从自己的基因组上切除,与传统基因编辑技术相比,CRISPR/Cas系统具有灵活性强、成本效益高和易于使用等优点,是实现基因编辑最方便、最有力的工具[5]。
CRISPR/Cas系统主要由Cas基因和CRISPR序列组成,其中CRISPR序列由多个保守重复序列和间隔序列有规律的组成,而Cas作为一种核酸内切酶,主要起到"剪刀"作用,在对应的向导RNA(guide RNA,gRNA)引导下,可以识别并切割靶位点特定的互补DNA链[6]。CRISPR/Cas系统分类的依据主要以Cas基因和它位置的多样性进行的,Makarova等[7]对CRISPR/Cas系统和Cas基因进行了最新的分类,主要分为2个大类、6个类型和33个亚型。第1类CRISPR/Cas系统具有由多个Cas蛋白组成的效应器模块,形成crRNA结合复合物,共同作用于靶标的结合和加工,主要包括Ⅰ、Ⅲ和Ⅳ型3个类型。第2类系统有1个单一的多结构域crRNA结合蛋白,其功能类似于第1类的整个效应器复合体,包括Ⅱ、Ⅴ和Ⅵ型3个类型。其中Ⅱ型系统较为简单,只存在于细菌中,主要依靠Cas9与成熟的crRNA结合形成稳定的crRNP复合物而发挥作用,为此受到广泛的关注,是一种有前景的基因治疗手段,在生物技术、农牧业、生命科学、医学、动物模型和药物开发等多个领域中都有着较为广泛的应用[8]。
CRISPR/Cas9的适应性免疫作用机制主要分为适应、表达和干扰3个阶段[9]。其中,适应阶段:主要是指外源基因特定片段被整合到CRISPR阵列,形成新的高度可变间隔区,以提供感染记忆;表达阶段:主要是指crRNA的合成,即CRISPR阵列在前导序列作用下转录为pre-CRISPR RNA(pre-crRNA),并加工形成成熟的crRNA;干扰阶段:crRNA、tracrRNA和Cas9蛋白核酸酶形成复合物,识别crRNA互补的外源基因序列,进行靶向切割,导致DNA发生DNA双链断裂(double strand break,DSB)。宿主细胞依靠非同源末端连接(non-homologous end joining,NHEJ)和同源重组(homologous directed repair,HDR)2种方式来进行DNA的修复,维持基因组的完整性[10]。在这些DNA进行修复的过程中,可以对目标基因进行删除、插入或修饰等手段从而实现对目标基因的编辑[11]。NHEJ修复速度较快,在大多数细胞类型中出现频率较高,它不依赖同源DNA序列,在修补后易产生过早的终止密码子和随机的插入与删除,该途径有利于科研人员实现目的基因的敲除以及功能基因的筛选。与NHEJ修复不同,HDR修复则需要模板的参与,在细胞周期的S和G2期活跃,实验中选取靶基因同源区域作为修复模板,可以实现对靶基因的精准修复,便于科研人员进行基因编辑[12]。在CRISPR/Cas9技术中,研究人员可以针对靶基因,设计对应的单链向导RNA(single-guide RNA,sgRNA),与Cas9结合后可以识别并切割对应的DNA,从而产生需要的编辑效果,是一种高效的基因编辑手段。
宫颈癌发生的主要原因是由于高危人乳头瘤病毒(human papillomavirus,HPV)持续感染造成的,HPV主要分为2种类型,一种为低风险毒株,一般无致癌性;另一种为高风险毒株,持续感染高风险毒株则会引起癌变,而HPV 16和18就属于HPV高危毒株,可以引起70%以上的宫颈癌[13]。研究发现,E6和E7是宫颈癌发生中的主要致癌基因,其中E6蛋白可以与肿瘤抑制因子p53结合,并诱导其泛素化,或阻止它进入细胞核发挥作用[14]。E7与视网膜母细胞瘤肿瘤抑制蛋白(retinoblastoma protein,RB)相结合,最终导致宿主细胞发生恶性增殖[15]。CRISPR/Cas9技术可以有效的对目的基因进行敲除,因此,采用CRISPR/Cas9技术靶向致癌基因E6和E7进行敲除,是宫颈癌治疗的一种有前景的治疗方案,利用CRISPR/Cas9技术靶向敲除E6和E7基因在宫颈癌中的相关研究见表1。
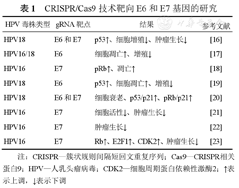
CRISPR/Cas9技术靶向E6和E7基因的研究
CRISPR/Cas9技术靶向E6和E7基因的研究
| HPV毒株类型 | gRNA靶点 | 结果 | 参考文献 |
|---|---|---|---|
| HPV18 | E6和E7 | p53↑、细胞增殖↓、肿瘤生长↓ | [16] |
| HPV16/18 | E6 | 细胞凋亡↑、增殖↓ | [17] |
| HPV16 | E7 | pRb↑、凋亡↑ | [18] |
| HPV18 | E6 | p53↑、细胞凋亡↑、增殖↓ | [19] |
| HPV18 | E6和E7 | 细胞衰老、p53/p21↑、pRb/p21↑ | [20] |
| HPV16 | E7 | 细胞活性↓、肿瘤生长↓ | [21] |
| HPV16 | E7 | 肿瘤生长↓ | [22] |
| HPV16 | E7 | Rb↑、E2F1↑、CDK2↑、肿瘤生长↓ | [23] |
注:CRISPR—簇状规则间隔短回文重复序列;Cas9—CRISPR相关蛋白9;HPV—人乳头瘤病毒;CDK2—细胞周期蛋白依赖性激酶2;↑表示上调,↓表示下调
研究发现,在体外实验中,无论是单独敲除E6或E7,或将两者同时敲除,均可以显著抑制宫颈癌细胞的生长,促进细胞的凋亡[16,17,18,19,20,21,22,23];体内实验中,通过建立小鼠异种移植荷瘤模型,靶向敲除HPV16/18的E6和E7基因,可以显著抑制小鼠体内肿瘤的生长[16,21,22,23]。Gao等[23]分别转染了针对CRISPR/Cas9、TALEN、ZFN的HPV16 E7质粒,来评估CRISPR/CAS9系统在宫颈癌发生中的作用,结果发现,靶向HPV16 E7的CRISPR/Cas9在体外以及在K14-HPV16转基因小鼠体内都能有效逆转HPV相关的宫颈癌发生。以上研究结果为以E6/E7为靶点的宫颈癌治疗提供相应的研究依据,体现了CRISPR/Cas9技术在宫颈癌治疗中的巨大潜力。
针对早期宫颈癌患者,手术治疗是首要的选择,但对于中晚期患者来说,临床上主要使用放化疗手段。在复发或转移性宫颈癌患者中多选择以顺铂为基础的治疗策略,顺铂可以抑制HPV E6和E7的表达,缓解p53的降解,从而诱导细胞的凋亡[24]。Zhen等[25]将HPV16 E6/E7-CRISPR/Cas9作为顺铂治疗的有效增敏剂,建立了新的治疗策略,以减缓顺铂的不良反应和耐药性的产生。研究发现顺铂与HPV16 E6/E7-CRISPR/Cas9联合治疗可明显改善宫颈癌患者的预后,且有效抑制异种皮下移植瘤的肺转移,为进一步研究HPV16 E6/E7-CRISPR/Cas9与其他化疗药物联合治疗提供了研究基础,也为宫颈癌治疗提供了新的选择,有利于改善宫颈癌患者的预后。Pirouzfar等[26]利用CRISPR/Cas9系统靶向敲除HPV-E6和混合谱系白血病5(mixed lineage leukemia 5,MLL5)基因,增加了细胞凋亡率,降低了细胞活性,提高了p53表达,与顺铂联合治疗结果发现,敲除E6和MLL5的表达后,增强了顺铂对细胞的凋亡作用,为后续治疗HPV相关的宫颈癌提供了潜在联合治疗方法。
晚期患者的主要治疗手段是放射治疗,但由于放射敏感性低,常导致其在临床应用中效果不佳,所以探寻放射敏感性潜在的分子机制,找寻抵抗辐射的潜在分子有助于更好地提高放射对宫颈癌的治疗效果。Leung等[27]发现,HPV E6蛋白富集了CD55+宫颈癌细胞群,有助于宫颈癌细胞的侵袭行为和辐射抗性。在此基础上,该研究团队进一步确定了宫颈癌细胞中HPV-E6和CD71蛋白之间的一种新联系。HPV E6诱导CD71+群体富集,增强宫颈癌细胞的自我更新能力、增殖能力、致瘤性和放射抗性[28]。利用CRISPR/Cas9技术抑制CD71和CD55,可以抑制宫颈癌细胞的生长并且增加其对辐射的敏感性,为宫颈癌治疗提供了新的策略。研究发现在辐射后的宫颈癌细胞中早期快速反应基因5(immediate-early response 5,IER5)表达上调,而聚合酶相关因子1(polymerase-associated factor 1,PAF1)是肿瘤进展过程中"诱导"某些基因的关键转录因子。Zheng等[29]通过CRISPR/Cas9敲除增强子的方法证实了PAF1与IER5启动子和增强子的物理相互作用,表明PAF1通过抑制IER5转录降低宫颈癌的辐射敏感性,可能是克服宫颈癌患者辐射抵抗的潜在治疗靶点。
癌症免疫治疗包括免疫检查点抑制剂的使用成为了许多癌症治疗的有效策略。在宫颈癌治疗中,Zhen等[30]利用CRISPR/Cas9技术靶向HPV16 E6/E7与程序性细胞死亡蛋白-1(programmed cell death protein-1,PD-1)阻断进行联合治疗,结果发现这种联合治疗方法增加了树突状细胞(dendritic cell,DC)、CD8+和CD4+ T细胞的数量,增强辅助性T细胞1相关免疫反应基因的表达,具有很强的协同效应,为临床上治疗宫颈癌提供了实验依据。
癌基因的激活和抑癌基因的失活是导致肿瘤发生发展的主要原因,对癌基因进行敲除是一种有效治疗癌症的新思路。作为第3代基因编辑技术,CRISPR/Cas9可以有效地切割和敲除致癌基因,为多种癌症带来新希望。近年来,该技术在宫颈癌的治疗方面也取得了较大的进展。(表2)
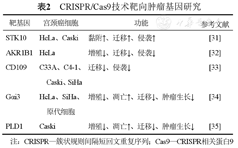
CRISPR/Cas9技术靶向肿瘤基因研究
利用CRISPR/Cas9系统建立了STK10基因敲除的HeLa和Caski细胞系,研究其在宫颈癌中的作用,结果发现,STK10促进了宫颈癌细胞的黏附、迁移和侵袭,首次证实了STK10在参与ERM蛋白磷酸化外的其他生理功能[31]。醛酮还原酶家族1成员B1(Aldo-keto reductase family 1 member B1,AKR1B1),在多种肿瘤中高表达,并被证实与肿瘤的发生发展有关,Ji等[32]利用CRISPR/Cas9技术在HeLa细胞中建立了AKR1B1敲除的稳定细胞系,研究发现AKR1B1基因敲除抑制了HeLa细胞的增殖、迁移和侵袭,并且该基因的醛糖还原酶抑制剂依帕司他也对细胞具有相同的作用效果,为宫颈癌的临床治疗提供了理论研究依据。
CD109是属于α2-巨球蛋白(α2-macroglobulin,α2M)/C3、C4和C5补体超家族的一种糖蛋白,可以过转化生长因子-β1信号转导和信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)激活参与多种肿瘤的发生和发展。Mo等[33]敲除CD109后,发现可以逆转体外和体内的致瘤性和侵袭性,证实了CD109在诱导表皮生长因子受体介导的STAT3调控肿瘤的致瘤性和侵袭性方面起着重要作用,这可能为开发有效的宫颈癌治疗策略提供潜在的分子靶点。这些研究为宫颈癌的靶向治疗或基因治疗提供了研究依据,为宫颈癌治疗提供新的治疗策略。Zhang等[34]利用生物信息学对宫颈癌患者组织进行分析,发现Gα蛋白i亚基3(Gαi3)表达是显著增高的,利用CRISPR/Cas9技术敲除该基因后,体外可以诱导细胞发生凋亡,降低细胞增殖,抑制了细胞的迁移,体内也显著抑制了宫颈癌移植瘤的生长,研究结果表明,Gαi3蛋白可以作为宫颈癌的治疗靶点。磷脂酶D(phospholipase D,PLD)在细胞骨架的形成、细胞侵袭和迁移中起着重要的作用,并且在多种肿瘤中高表达,Song等[35]用CRISPR/Cas9构建了2个PLD1基因敲除的Caski细胞系,结果发现细胞的增殖、侵袭和迁移能力被抑制,且体内肿瘤生长也低于野生型细胞,表明抑制PLD1可能是宫颈癌治疗的一种潜力方法。
化疗是癌症患者治疗的主要策略之一,但在治疗过程中,会出现耐药性,减弱化疗药物的敏感性,导致肿瘤治疗的失败,利用CRISPR/Cas9技术进行宫颈癌相关耐药基因的筛选对解决化疗药物耐药性的有一定的前景。Wei等[36]利用基因组规模的CRISPR/Cas9筛选系统,筛选人SiHa细胞中与紫杉醇敏感性相关的基因,获得了374个候选基因,其中包括一些与先前研究报道一致的,如ATP结合盒亚家族C成员9(ATP binding cassette subfamily C member 9,ABCC9)、白细胞介素-37(interleukin-37,IL-37)、真核细胞翻译起始因子3亚基C(eukaryotic translation initiation factor 3 subunit C,EIF3C)、蛋白激酶Akt底物1(Akt1 substrate 1,AKT1S1)及蛋白磷酸酶(protein phosphatase,PPP)家族的几个成员。一些新发现的基因为研究紫杉醇在宫颈癌中的敏感性机制提供了新的靶点。在局部晚期宫颈癌患者治疗中,新辅助化疗是一种有潜力的治疗方案,但15%~34%女性对该治疗无反应,Tian等[37]通过全外显子测序鉴定了导致患者对新辅助化疗治疗无效的特异性体细胞突变,然后利用CRISPR/Cas9的文库对这些基因进行筛选,确定它们在耐药中的作用,为指导局部晚期宫颈癌选择合适治疗策略做出了贡献。Li等[38]为了提高宫颈癌的治疗效果,解决化疗耐药性,利用CRISPR/Cas9敲除关键癌基因E6和E7并联合化疗药物多西紫杉醇,可显著抑制癌细胞的耐药性,提高宫颈癌的治疗效果,为治疗宫颈癌提供了一种有前景的策略。
如何有效地将CRISPR/Cas成分递送到细胞内是其在癌症治疗中备受关注的一个挑战,其中病毒载体慢病毒、腺病毒和腺相关病毒(adeno-associated virus,AAV)在基因编辑治疗中有着广泛的应用。Ehrke-Schulz等[17]利用腺病毒HCAdV载体,表达Cas9和针对HPV16/18-E6的sgRNA,分别递送至HPV阳性的SiHa和Caski细胞以及HPV的阴性癌细胞,结果发现,HPV阳性宫颈癌细胞系的细胞活力降低、增殖减少,且凋亡增加,而HPV阴性细胞则不受影响。表明HCAdV可以作为HPV特异性癌症基因治疗剂。Noroozi等[19]利用AAV载体,构建AAV-E6-CRISPR/ Cas9系统,靶向破坏HPV18阳性HeLa细胞系中致癌基因E6,结果发现HPV18-E6敲除后,细胞凋亡增加增殖减少,且恢复了p53基因的表达,表明AAV载体发送的CRISPR/Cas系统有望作为宫颈癌的潜在治疗策略。
虽然病毒载体在基因编辑中应用较为广泛,但其仍然存在免疫反应和递送效率等不足的问题。随着纳米技术的发展,非病毒载体作为病毒载体的替代方案,受到了研究者的广泛关注,其具有较低的免疫原性,生物相容性也较高,递送能力较强等优点。Ling等[16]针对HPV18 E6和E7基因,构建CRISPR/Cas9载体(E6E7-KO),在荷瘤小鼠治疗中,将E6E7-KO与脂质体3 000混合,局部注射于小鼠肿瘤内,结果发现肿瘤生长受到明显的抑制,且提高了p53蛋白的表达水平。Gao等[18]合成了基于第0代的聚酰胺-胺(generation 0 of polyamidoamine,PAMAM-G0)和聚(β-氨基酯)[poly(β-amino esters),PBAE]的超支化共聚物作为一种新的基因转染材料,将CRISPR/Cas9系统用于HPV感染相关宫颈癌的基因治疗,结果发现这种复合纳米粒系统在体内外均表现出良好的抗肿瘤能力,为基因药物治疗宫颈癌的临床应用提供了新的策略。在此基础上,该团队开发了一种基于PBAE NPs的改性蒙脱石(modified montmorillonite,mMMT)阴道凝胶,可以有效的将猪内源性逆转录病毒(porcine endogenous retroviruses,PERVa)靶向的CRISPR/Cas9系统递送到哺乳动物猪体内的阴道上皮,有效减少了病毒的拷贝数,且局部递送的SpCas9的表达仅限于阴道/宫颈,不会扩散到附近的器官,该研究表明,基于PBAE的mMMT阴道凝胶可以有效安全地用于宫颈癌治疗中CRISPR/Cas9系统的输送,为阴道基因治疗的临床应用提供了新的输送策略[39]。
Zhen等[40]开发了一种自组装脂质体,制备了新型脂质体-CRISPR/Cas9 gRNA-HPV16 E6/E7复合体,在体外可以有效地诱导细胞凋亡,抑制增殖,在体内通过向裸鼠瘤内注射该阳离子脂质体复合物,可以显著抑制肿瘤生长,且没有明显体内毒性,表明该递送系统具有良好细胞靶向性和高基因敲除率。随后该团队探索了HPV16 E6/E7敲除后诱导细胞死亡中产生的免疫机制,结果发现,HPV靶向引导RNA-脂质体复合物可以促进肿瘤细胞中CD8+ T细胞的浸润,促进炎性细胞因子IL-12、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和干扰素-γ(interferon-γ,IFN-γ)的表达升高;在小鼠荷瘤模型中,将复合物与PD-1抗体联合使用,产生了高效的抗肿瘤作用,且诱导了免疫记忆反应,结果表明,CRISPR纳米药物的肿瘤抑制修复可能会提高免疫检测点阻断的敏感性,并为多种恶性肿瘤提供有效的联合治疗[41]。目前CRISPR/Cas9技术在宫颈癌治疗研究中的应用越来越广泛,开发递送效率高,靶向性强,安全性好的非病毒载体和递送系统也是相关研究热点,具有广阔的研究前景,为CRISPR/Cas9技术的临床转化提供更多的可能性。
随着CRISPR编辑技术的问世,它以操作简单快速、编辑效率高等优点迅速成为了研究热点,广泛应用于多个研究领域,尤其是在疾病和肿瘤的研究中,为患者带来新的希望。陈千一[42]从构建宫颈癌细胞及动物模型和宫颈癌的基因治疗2个方面对CRISPR/Cas9在宫颈癌研究中的应用进行了相关综述,为CRISPR/Cas9技术在癌症发生发展以及治疗研究带来新视野、新发现。近年来,随着生物科学技术的飞速发展,CRISPR/Cas9技术在癌症治疗中的应用也越来越广泛。本文以治疗宫颈癌为出发点,总结了近几年CRISPR/Cas9技术在宫颈癌治疗中的研究,从靶向基因治疗到放化疗等联合治疗以及耐药基因筛选等方面进行了全新的综述,从中可以发现,随着CRISPR/Cas9技术的发展成熟,其在宫颈癌治疗中的应用也越来越广泛,尤其在宫颈癌耐药相关基因筛选方面,相信未来CRISPR/Cas9技术在宫颈癌治疗中的研究会越来越丰富。
虽然CRISPR/Cas9技术目前在癌症治疗中具有极大的潜力,但其在脱靶效应、免疫反应和递送方式等方面仍然面临着一定的挑战。(1)脱靶效应:为了更好地应对CRISPR/Cas9的脱靶效应,研究者通过修饰Cas9蛋白来改变原间隔序列临近基序(protospacer adjacent motif,PAM)偏好或增强对靶DNA的识别,以此来降低脱靶频率[43],如何保持CRISPR/Cas9的有效性和特异性成为了未来研究的重要方向之一;(2)免疫反应:Cas9蛋白本身所引发的免疫反应也是对Cas9的挑战,需要寻找新的、免疫原性较低的Cas9蛋白变体或其他物种的额外可编程核酸酶,以期克服免疫反应的挑战;(3)递送方式:将CRISPR/Cas9输送到靶细胞最常用的载体有病毒载体和非病毒载体,但病毒载体具有低免疫原性和低致癌风险等优点,但其容量有限且长期存在的病毒介导的传递系统可能会增加脱靶切割事件的风险。随着纳米材料科学的飞速发展,非病毒载体能够更精确地控制给药剂量和时间,缩短核酸酶的表达期,降低脱靶效应的风险,最大限度地减少潜在不良反应的可能性,因此,开发纳米载体将CRISPR/Cas9传递到靶向癌症是临床应用的总方向[44]。
2016年,CRISPR/Cas9技术首次在临床中应用于人体上,四川大学华西医院招募了第1批非小细胞肺癌(non-small cell lung cancer,NSCLC)患者[45],从患者的外周血淋巴细胞中采集淋巴细胞,用CRISPR/Cas9进行免疫检查点基因PD-1的敲除。将敲除PD-1基因的T细胞体外扩增后回输给患者,探究这些基因编辑的T细胞的安全性、可行性和治疗效果。研究结果表明,在晚期NSCLC患者中,以PD-1为靶点的CRISPR/Cas9基因编辑T细胞治疗具有安全性和可行性[46]。2019年,Stadtmauer等[47]首次报道了采用CRISPR/Cas9多重编辑T细胞进行免疫治疗的临床Ⅰ期试验,结果表明,3名患者回输了CRISPR/Cas9基因编辑的T细胞,都有很好的耐受性,没有出现严重的不良反应,也没有出现细胞因子释放综合征。初步证明了利用CRISPR/Cas9在T细胞中编辑多个基因进行免疫治疗的可行性和安全性。虽然目前关于该技术在宫颈癌的临床研究未见报道,但相信随着CRISPR/Cas9靶向特定基因组区域特异性的提高和构建靶向特定器官或肿瘤递送方法的进步,未来必将进一步推动该技术在宫颈癌治疗方面的临床试验。
所有作者均声明不存在利益冲突



























