
探究组蛋白甲基化酶zeste基因增强子同源物2(EZH2)对人肥大心肌细胞AC16增殖和凋亡的影响。
通过在AC16细胞培养基中添加血管紧张素Ⅱ构建AC16肥大心肌细胞模型,细胞分为空白对照组、血管紧张素Ⅱ组、空载+血管紧张素Ⅱ组和EZH2过表达+血管紧张素Ⅱ组,并通过荧光定量PCR法检测EZH2和脑钠肽(BNP)基因的表达水平,Western Blot法检测EZH2、组蛋白H3第27位赖氨酸的三甲基化(H3K27me3)和BNP蛋白的表达水平,MTS法检测AC16肥大心肌细胞增殖,以及流式细胞仪检测细胞凋亡。
与空白对照组相比,血管紧张素Ⅱ组EZH2和H3K27me3表达水平降低,BNP的表达水平升高,细胞增殖降低,凋亡水平升高(均P<0.001);与空载+血管紧张素Ⅱ组相比,EZH2过表达+血管紧张素Ⅱ组EZH2和H3K27me3表达水平升高,BNP的表达水平降低,细胞增殖水平升高,凋亡水平降低(均P<0.001);血管紧张素Ⅱ组和空载+血管紧张素Ⅱ组相比上述指标差异均无统计学意义(均P>0.05)。
组蛋白甲基化酶EZH2对AC16细胞的增殖和凋亡具有影响,为心肌肥厚的治疗以及揭示心肌肥厚的发病机制提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
心肌肥厚分为生理性心肌肥厚和病理性心肌肥厚。生理性心肌肥厚与正常的心脏功能相关,如体育锻炼或妊娠时,而心脏的结构或功能不会发生异常。在长期压力负荷过重的情况下,病理性心肌肥厚可以产生较有效的代偿功能,心肌总量增加,收缩力加强,使心脏得以维持正常的血循环,但在发挥代偿功能过程中,因为肥大的心肌需氧增加,而冠状动脉的供血量往往不能予以满足,造成心肌缺血,导致心肌收缩力减退,甚至心力衰竭。
血管紧张素Ⅱ是由肾素作用血管紧张素原产生血管紧张素Ⅰ,再经转化酶的作用而生成。血管紧张素Ⅱ具有较高的生物活性,是最有效的加压物质,其加压作用是去甲肾上腺素的40倍,还可刺激肾上腺分泌肾上腺素和醛固酮。血管紧张素Ⅱ可以直接促进心肌细胞蛋白质的合成,调节心肌的功能。
zeste基因增强子同源物2(zeste gene enhancer homolog 2,EZH2)属于多梳蛋白复合体(polycomb group,PcG)一族,诱导组蛋白H3第27位赖氨酸的三甲基化(trimethylation of lysine at position 27 of histone H3,H3K27me3)[1]。朱文思[2]研究表明微小核糖核酸-214(micro RNA-214,miR-214)通过在转录水平抑制EZH1和EZH2,使过氧化物酶体增殖物激活受体γ表达增加,进而降低心肌成纤维细胞中纤维化相关基因的表达。高糖通过EZH2上调心肌成纤维细胞纤维化相关蛋白表达及心肌成纤维细胞分化、迁移和增殖,促进心肌纤维化;抑制EZH2可以降低高糖刺激下心肌成纤维细胞纤维化相关蛋白表达及心肌成纤维细胞分化迁移和增殖能力,改善心肌纤维化[3]。在心脏前体细胞中敲除EZH2后可以激活同源异形框基因1依赖的骨骼肌基因表达,从而诱导心肌肥厚[4]。因此,EZH2在维持心脏形态稳定,尤其是防治心肌肥厚中起到了关键的调控作用。证据表明EZH2和H3K27me3在心肌细胞中表达具有重要作用[4],不仅对于心肌细胞的分化有影响,同时与心肌肥厚的水平存在关联,但是针对EZH2对肥大心肌细胞AC16影响的研究尚无系统报道,并且EZH2对于心肌肥厚影响的观点尚不一致,因此针对EZH2对AC16细胞影响的机制研究具有重要意义。因此,本研究旨在探讨组蛋白甲基化酶EZH2对AC16细胞增殖和凋亡的影响,并揭示EZH2调控心肌肥厚的分子机制,为心肌肥厚的治疗以及揭示其发病机制提供参考。
人心肌细胞AC16购自美国细胞培养物收藏中心;血管紧张素Ⅱ(德国Millipore公司),鼠源甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体(艾博抗贸易有限公司),兔源脑钠肽(brain natriuretic peptide,BNP)单克隆抗体(密理博有限公司),胎牛血清(四季青),SYBR®Green Master Mix(瑞士罗氏公司),1640培养基(上海立菲生物科技有限公司),胰蛋白酶(西安沃尔森生物技术有限公司),BCA蛋白质定量试剂盒(北京鼎国生物公司),RNA提取试剂盒[生物工程(上海)有限公司],增强型化学发光试剂(enhanced chemiluminescence,ECL)发光液(碧云天生物技术有限公司),Lipofectamine TM 3000试剂盒(美国Gibco公司),二抗辣根过氧化物酶标记的山羊抗兔、鼠(美国Cell Signal Technology),逆转录试剂盒(天根生化科技有限公司),鼠源H3单克隆抗体(组蛋白H3,密理博有限公司),兔源H3K27me3单克隆抗体(密理博有限公司);FACSCanto流式细胞仪(美国BD公司),CKX53倒置显微镜(日本奥林巴斯公司)。
AC16细胞无菌培养于含10%的胎牛血清、100 U/ml双抗的1640培养基,37 ℃、5% CO2条件下培养,细胞密度达到90%时传代,培养基中加入血管紧张素Ⅱ使终浓度为10−7 mol/L,作用48 h后,倒置显微镜下进行观察确定模型构建成功。细胞于转染前1天接种到不含抗生素的培养基中,细胞融合到90%时可进行转染,每孔中加入500 μl转染液,37 ℃培养48 h,转染4 h后更换培养基,用于后续实验。
将细胞分为空白对照组、血管紧张素Ⅱ组(培养基中加入血管紧张素Ⅱ使终浓度为10−7 mol/L,作用48 h)、空载+血管紧张素Ⅱ组和EZH2过表达+血管紧张素Ⅱ组,每组设置6个重复。转染后进行常规培养48 h,收集各组细胞,供后续检测。
各组收集细胞后,Trizol法提取总的RNA,之后取出1 μg RNA逆转录,荧光定量PCR法扩增cDNA片段。EZH2上游序列:5’-CGGGATCCATGGGCCAGA CTGGGAAGA-3’,下游序列:5’-TCCCCCGGGTCA AGGGATTTCCATTTCTCGTTC-3’;BNP上游序列:5’-ATCCCAGTTCAATCGCCG-3’,下游序列:5’-AATCACTGGCTTACGGCCTCCG-3’。
荧光定量PCR反应体系:Mix 10 μl,primer F 0.4 μl,primer R 0.4 μl,Rox 0.4 μl,cDNA 2 μl,ddH2O 6.8 μl。反应条件:94 ℃ 5 min;94 ℃ 15 s,60 ℃ 1 min,循环40次,95 ℃ 15 s,60 ℃ 1 min,95 ℃ 30 s,60 ℃ 15 s。
吸出培养液,加入2 ml磷酸缓冲盐溶液(phosphate buffer saline,PBS)润洗细胞,吸出PBS丢弃,加入1 ml胰酶消化,加入含血清的培养基终止消化,收集细胞悬液离心,丢弃上清,用PBS洗涤,1 000 r/min,4 ℃下离心5 min(离心半径13.5 cm),离心后吸出上清丢弃,加入预冷的含抑制剂的蛋白质抽提试剂(1 ml RIPA中加入10 µl蛋白酶抑制剂)混匀,冰上孵育30 min,每10 min涡旋混匀1次,充分裂解后于预冷的离心机中离心,转移上清液至新的离心管中,加入BCA工作液,震荡30 s混匀,37 ℃放置30 min,分光光度计检测蛋白浓度,将剩余样品加入上样缓冲液混匀后100 ℃下10 min,以确保蛋白质变性。制备聚丙烯酰胺凝胶,所有蛋白样品调至等浓度后上样,样品两侧的泳道用等体积的上样缓冲液上样,Marker也用上样缓冲液调整至与样品等体积,以恒压80 V跑胶至Marker分开后改为120 V继续电泳。在目的蛋白泳动至距胶下缘1 cm以上结束,用300 mA恒流转移膜1.5 h,然后用5%脱脂奶的TBST密封2 h,用兔单克隆抗体EZH2(1∶1 000)、H3K27me3(1∶3 000)、BNP(1∶1 000),小鼠单克隆抗体GAPDH(1∶1 000)、H3(1∶3 000)在4 ℃下孵育过夜,然后用TBST在室温下脱色摇床上洗3次,每次10 min,加入二抗,放在摇床上,室温下孵育1~2 h后,用TBST在室温下脱色摇床上洗3次,每次10 min。用ECL发光液显影,均匀滴在PVDF膜的蛋白面,反应1~2 min后放入曝光机器中自动曝光。
收集AC16细胞,加细胞悬液在24孔板中,并按照LipofectamineTM 3000试剂盒操作说明进行转染。置37 ℃、5% CO2孵育,48 h后进行MTS实验,酶标仪检测490 nm处的吸光度(A)值,并计算细胞相对存活率。
细胞相对存活率(%)=(A实验组-A空白对照组)/(A对照组-A空白对照组)×100%
其中,对照组指第1次各组检测到的数值。
收集AC16细胞后,用孵育缓冲液洗涤1次,500~1 000 r/min,4 ℃下离心5 min(离心半径13.5 cm)。用100 μl标记溶液重悬细胞,室温下避光孵育10~15 min。500~1 000 r/min,4 ℃下离心5 min(离心半径13.5 cm)沉淀细胞孵育缓冲液洗1次。加入荧光溶液4 ℃下孵育20 min,避光并不时振动。流式细胞仪检测细胞凋亡情况。
结果以Bandscan图像分析软件和SPSS 17. 0数据统计软件进行分析,应用Bonferroni检验对组间数据进行处理和分析,所有数值以均数±标准差( ±s)表示,以P<0.05为差异有统计学意义。
±s)表示,以P<0.05为差异有统计学意义。
如图1所示,荧光定量PCR结果显示与空白对照组相比,血管紧张素Ⅱ组EZH2基因相对表达量降低(P<0.001),BNP基因的相对表达量升高(P<0.001);与空载+血管紧张素Ⅱ组相比,EZH2过表达+血管紧张素Ⅱ组EZH2基因相对表达量升高(P<0.001),BNP基因相对表达量降低(P<0.001);血管紧张素Ⅱ组和空载+血管紧张素Ⅱ组比较差异无统计学意义(P>0.05)。说明血管紧张素Ⅱ的加入促使心肌肥厚因子升高,并且随着EZH2基因表达水平的改变,肥厚因子表达随之改变。


1—空白对照组;2—血管紧张素Ⅱ组;3—空载+血管紧张素Ⅱ组;4—EZH2过表达+血管紧张素Ⅱ组;EZH2—zeste基因增强子同源物2;BNP—脑钠肽。***P<0.001
如图2所示,与空白对照组相比,血管紧张素Ⅱ组EZH2和H3K27me3蛋白表达水平降低(P<0.001),BNP蛋白表达水平升高(P<0.001);与空载+血管紧张素Ⅱ组相比,EZH2过表达+血管紧张素Ⅱ组EZH2和H3K27me3蛋白表达水平升高(P<0.001),BNP的表达水平降低(P<0.001);血管紧张素Ⅱ组和空载+血管紧张素Ⅱ组比较差异无统计学意义(P>0.05)。蛋白表达结果进一步证实随着EZH2表达水平的升高/降低,其下游H3K27me3蛋白表达水平随之升高/降低,并且肥厚相关蛋白BNP表达水平降低/升高。
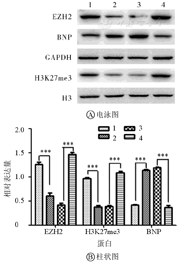

1—空白对照组;2—血管紧张素Ⅱ组;3—空载+血管紧张素Ⅱ组;4—EZH2过表达+血管紧张素Ⅱ组;EZH2—zeste基因增强子同源物2;BNP—脑钠肽;GAPDH—甘油醛-3-磷酸脱氢酶。***P<0.001
如图3所示,与空白对照组相比,血管紧张素Ⅱ组AC16细胞增殖水平降低;与空载+血管紧张素Ⅱ组相比,EZH2过表达+血管紧张素Ⅱ组AC16细胞增殖水平升高,增殖水平的升高或降低和细胞中EZH2基因的表达呈正比,并与BNP肥厚因子的表达呈反比。说明血管紧张素Ⅱ降低了AC16细胞中EZH2基因的表达,同时抑制了AC16细胞的增殖,并且通过过表达EZH2可以逆转细胞增殖水平的降低。
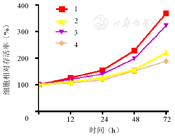

1—空白对照组;2—血管紧张素Ⅱ组;3—空载+血管紧张素Ⅱ组;4—EZH2过表达+血管紧张素Ⅱ组;EZH2—zeste基因增强子同源物2
如图4所示,与空白对照组相比,血管紧张素Ⅱ组AC16细胞凋亡水平升高(P<0.001);与空载+血管紧张素Ⅱ组相比,EZH2过表达+血管紧张素Ⅱ组AC16细胞凋亡水平降低(P<0.001),凋亡水平的降低或升高和细胞中EZH2基因的表达呈正比,并与BNP肥厚因子的表达呈反比。说明血管紧张素Ⅱ降低了AC16细胞中EZH2基因的表达,同时使AC16细胞凋亡增加,并通过过表达EZH2逆转细胞凋亡。
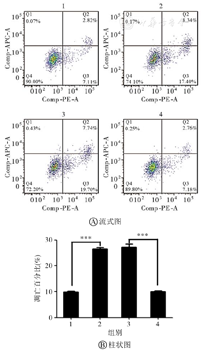

1—空白对照组;2—血管紧张素Ⅱ组;3—空载+血管紧张素Ⅱ组;4—EZH2过表达+血管紧张素Ⅱ组;EZH2—zeste基因增强子同源物2。***P<0.001
心肌肥厚是心脏对超负荷或损伤的反应机制,是心肌细胞在压力、神经体液因素和心肌基因突变作用下的一种适应性反应。在分子和细胞水平上,心肌肥厚的特征是细胞体积增加、蛋白质合成增加以及相关胚胎沉默基因(如心钠肽和BNP)的重新表达[5]。心肌肥厚的持续恶化会导致心肌细胞营养不良和死亡,这是临床实践中的一个负面结果,因此它被用于预测心血管疾病和死亡。
本研究首先用10−7 mol/L血管紧张素Ⅱ作用于AC16细胞48 h,制备AC16肥大心肌细胞模型。通过检测细胞内BNP蛋白验证模型制备成功。在心血管领域,BNP是心肌肥厚、高血压和心力衰竭的重要生物标志物[6,7,8]。血浆BNP水平在心肌肥厚和心力衰竭的诊断和预后中起重要作用,可作为疾病治疗的监测指标[9]。本研究中与空白对照组相比,采用血管紧张素Ⅱ诱导的AC16细胞的BNP表达显著升高,进一步验证了本实验利用血管紧张素Ⅱ成功制备了AC16肥大心肌细胞模型,可用于下一步实验。
近年来,随着基因组学研究的发展,基因表观遗传修饰在疾病发病机制中的作用越来越受到重视。转录水平的改变被认为与许多信号通路和疾病的发生有关。深入探讨可能参与心肌肥厚发病机制的基因转录水平的修饰状态变化,如DNA和组蛋白的甲基化和乙酰化,可以为进一步阐明心肌肥厚的发病机制提供新的思路[10]。虽然现有证据证明EZH2与心肌肥厚的发生和发展有关,但关于EZH2与心肌肥大关系的观点仍不一致,其在病理性心肌肥厚发病机制中的作用尚不清楚[11]。
本研究结果表明通过转染EZH2过表达质粒成功实现了AC16心肌细胞中EZH2的过表达,同时引起下游H3K27me3表达水平升高,之后增殖和凋亡实验结果显示随着血管紧张素Ⅱ诱导AC16细胞EZH2表达水平的降低,细胞增殖水平降低,凋亡水平升高,并且此过程随着EZH2的过表达增殖和凋亡水平得到逆转,说明EZH2的表达对AC16肥大心肌细胞增殖和凋亡产生影响。
综上所述,血管紧张素Ⅱ诱导的AC16肥大心肌细胞中EZH2表达的改变影响肥大心肌细胞的增殖和凋亡,从表观遗传学角度揭示了组蛋白甲基化对心肌肥厚的影响,本研究证明针对心肌肥厚发生机制中EZH2的研究非常必要,为心肌肥厚的治疗寻找新的标志物以及为揭示心肌肥厚的发病机制提供参考。
所有作者均声明不存在利益冲突



























