
通过单细胞核转录组测序分析面肩肱型肌营养不良症(FSHD)中细胞间通讯模式。
选取2例FSHD患者的双侧不对称病变的口轮匝肌组织和2例正常口轮匝肌组织,共6例样本,分为对照组、轻度组和重度组。对照组为2例健康人的正常肌肉组织,轻度组和重度组分别为FSHD患者相对正常和损伤较重的一侧肌肉组织。对3组样本的全部细胞进行单细胞核转录组测序,鉴定差异表达基因和富集通路,并通过细胞通讯分析主要细胞类型间的细胞间通讯模式以及关键信号通路。
FSHD患者双侧肌肉样本的差异基因表达分析共鉴定了不同细胞类型中与疾病相关的46个功能性差异表达基因,与细胞凋亡、氧化应激、免疫炎症和肌肉功能等相关。FSHD重度组的细胞间通讯普遍增加。纤维/脂肪祖细胞(FAPs)和巨噬细胞是FSHD异常肌肉微环境中的重要信号来源,与疾病进展密切相关。FSHD组中存在6条独有信号通路:骨形态发生蛋白(BMP)、转化生长因子-β(TGF-β)、CXC基序趋化因子配体(CXCL)、黏附G蛋白偶联受体E5(ADGRE5)、白细胞介素-16(IL-16)和无翅型MMTV整合位点家族(WNT)信号通路,这些信号通路主要涉及巨噬细胞、FAPs和脂肪细胞间的相互作用,可能参与调控病变肌肉的脂肪沉积和纤维化改变。
单细胞核转录组测序提供了FSHD关键细胞类型间较为全面的细胞间通讯模式,为理解FSHD肌肉微环境的细胞间调控机制提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
面肩肱型肌营养不良症(facioscapulohumeral muscular dystrophy,FSHD)是一种遗传性神经肌肉病,主要表现为面肌、肩带肌和上肢肌群进行性无力。症状通常在10~20岁开始,随着疾病的进展,下肢肌肉也可能受到影响[1,2]。FSHD患者的骨骼肌病变是由逆转录基因DUX4的表观遗传抑制失败引起的,DUX4编码一种参与早期胚胎发生的转录因子,在大多数体细胞中处于沉默状态。由DUX4在骨骼肌中误表达引起的转录变化最终导致骨骼肌细胞死亡[3,4,5]。FSHD是一种慢性退行性肌肉疾病,组织病理学特征包括慢性炎症改变、肌肉萎缩、毛细血管缺失、纤维化和脂肪沉积[6]。FSHD的异常肌肉微环境破坏了正常肌肉稳态,将FSHD锁定在一种损害肌再生并促进纤维化和脂肪沉积的状态[7]。FSHD区别于其他肌营养不良病的主要特征是双侧不对称性的肌肉改变,然而机制尚不清楚。骨骼肌是一种复杂的异质组织,由多核肌纤维、免疫细胞、内皮细胞、卫星细胞、纤维/脂肪祖细胞(fibro-adipogenic progenitors,FAPs)和其他单核细胞组成。这些细胞群,尤其是非肌源性细胞群,对维持肌肉稳态至关重要。免疫细胞和FAPs在支持受损肌肉组织的清除方面发挥着重要作用,同时协助卫星细胞发挥再生作用[8,9,10]。然而,再生过程中协调有序的细胞间相互作用在肌营养不良患者中逐渐失效。内在缺陷细胞的积累和干细胞生态位的改变导致脂肪浸润和纤维化状态,损害肌肉功能[11,12,13]。因此推测,FSHD中免疫细胞、FAPs等与肌源性细胞之间的复杂相互作用可能与病变肌肉的持续炎症和病理性纤维化相关。
既往研究中应用普通转录组技术虽然可以了解DUX4的细胞毒作用及其下游靶基因的改变[4,5,14,15],但对细胞异质性和关键信号通路的探索存在局限性。单细胞/单细胞核转录组测序技术将整个转录谱的研究与全面的生物信息学方法相结合,可以在单细胞层面探索组织中特定细胞类型的分子特征和基因调控网络,是探索疾病微环境中细胞谱系异质性及功能特点的先进技术[16]。由于骨骼肌属于多核肌纤维,FSHD肌肉组织更适用于单细胞核RNA测序技术。单细胞核转录组测序数据的综合分析不仅可以全面表征FSHD肌肉组织的基本细胞成分和单细胞异质性,还可以对FSHD的肌肉微环境和免疫微环境特征进行剖析,深入探索疾病不同阶段下各细胞类型之间的相互作用关系,是研究FSHD发病机制以及治疗靶点的有利工具。迄今为止,尚无涉及FSHD肌肉活检组织的单核转录组研究。因此,本研究旨在对2例FSHD患者的双侧不对称病变的口轮匝肌组织和2例健康人的口轮匝肌组织进行单细胞核转录组测序分析,揭示FSHD双侧肌肉微环境的异质性以及主要细胞类型间的相互作用关系。这些新发现可能在FSHD的靶向治疗中发挥积极作用,以减少纤维脂肪沉积并促进肌肉再生。
磷酸盐缓冲液(phosphate buffered saline,PBS)、胎牛血清、细胞核EZ裂解缓冲液均购自美国Sigma公司;常温离心机、冷冻离心机、Qubit 4.0荧光定量仪均购自美国Thermo Fisher Scientific公司。
本研究纳入2021年8月至2022年4月来中国医学科学院整形外科医院就诊的2例FSHD患者(男1例,女1例;年龄分别为65、46岁)和2例健康人(男1例,女1例;年龄分别为42、38岁)为研究对象。所有参与者均签署了知情同意书,且该研究获得了中国医学科学院整形外科医院医学伦理委员会的批准(批件号2020004)。选取2例FSHD患者的双侧不对称病变的口轮匝肌组织和2例正常口轮匝肌组织,共6例样本。
6例样本分为3组,2例患者肌肉相对正常的一侧为轻度组,2例患者肌肉损伤较重的一侧为重度组,2例健康人的正常肌肉组织为对照组。
将手术活检取得的新鲜肌肉组织用PBS反复清洗,去除残留血液和杂质,4 ℃储存并送至实验室。将肌肉组织剪成直径3~5 mm的小块,重悬于0.5 ml细胞核EZ裂解缓冲液,并用研磨机在冰上均质化。匀浆依次通过70、40 mm的细胞过滤器过滤,4 ℃(1 000×g)下离心5 min沉淀细胞核。将沉淀物重悬于含有2%牛血清白蛋白的PBS溶液中,随后通过20 μm细胞过滤器过滤,即得单细胞核悬液。
使用10×Genomics Chromium平台构建单细胞核文库。根据制造商的操作说明,制备好的细胞核悬浮液利用微流控芯片,将带有细胞标签序列的胶珠和细胞核包裹在液滴中,收集包有细胞核的液滴,在液滴中,将细胞核裂解,使得细胞核中的mRNA与胶珠上面的细胞标签序列相连,形成单细胞GEMs(油包水的微体系),在液滴中进行反转录反应,随后破乳,进行互补DNA的文库构建。使用互补DNA酶切打断成200~300 bp的片段,加上测序接头和引物等传统二代测序的建库过程,最后进行PCR扩增得到DNA文库。利用Illumina测序平台NovaSeq对构建好的文库进行双端文库测序。
使用Cell Ranger V 6.0对下机数据进行处理,获得cell×gene的表达式矩阵。R包Seurat V 4.1.1用于分析单核数据。将阈值设置如下:(1)在≥3个细胞中表达的基因;(2)400≤总基因数≤5 000的细胞;(3)线粒体基因比例≤10%的细胞。
对多样本整合后进行无监督聚类分群:(1)使用归一化函数、基于LogNormalize方法进行表达量标准化;(2)使用在≥3个细胞中表达并且高度可变的前2 000个基因进行主成分分析,选取前20个主成分用于后续的聚类和分群分析;(3)采用louvain算法对归一化后的数据进行聚类分析;(4)采用统一流形逼近与投影(uniform manifold approximation and projection,UMAP)方法进行降维将聚类结果可视化展示。
使用FindMarkers函数、基于Wilcox算法筛选目标基因:(1)基因在细胞群中的表达比例pct.1或pct.2>0.25;(2)表达倍数avg_log2FC>0.25;(3)P<0.01。使用SingleR提供的方法和参考数据集对各个cluster进行细胞类型定义。
为研究FSHD双侧肌肉样本的转录异质性,比较FSHD重度组和轻度组不同细胞类型之间的差异表达基因(differentially expressed genes,DEGs),并对上述功能性DEGs进行KEGG通路富集分析,进一步探索其参与的生物学功能。使用FindMarkers函数、基于Wilcox算法,对同一个细胞类型内不同样本的细胞进行两两比较差异分析,筛选出DEGs:(1)|avg_log2FC|>1;(2)P<0.05。
使用clusterProfiler进行京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析。挑选显著富集的KEGG通路(P<0.05),从而确定DEGs主要参与的代谢途径和信号通路。
使用R包CellChat 1.1.0软件识别和可视化不同样本中各细胞类型的细胞间相互作用[17]。应用CellChat研究FSHD中不同细胞类型之间的细胞通讯模式。CellChat通过使用网络分析以及配对模式来识别细胞间主要的输入与输出信号,反映不同细胞接收信号的交互强度,输入强度,反映不同细胞接收信号的交互强度,输出强度反映不同细胞发送信号的交互强度;以及确定他们之间的相互作用关系,并可通过多种可视化方式呈现。
使用SPSS 26.0软件对数据进行统计学分析。采用t检验比较各组间差异基因的表达水平,以P<0.05为差异有统计学意义。
根据细胞类型标记基因注释,在23个cluster中共鉴定出10种基本细胞类型(图1A、图1C):肌细胞(ACTA1、AGBL1)、卫星细胞(PAX7、MUSK)、FAPs(PDGFRA、NEGR1)、平滑肌细胞(MYH11、ACTA2)、内皮细胞(PECAM1、VWF)、巨噬细胞(MS4A6A、CD163)、肥大细胞(CPA3)、T细胞(THEMIS、CD247)、脂肪细胞(PLIN1、FABP4)和施旺细胞(MPZ、NRXN1)。3组样本中不同细胞类型的比例存在很大差异。FSHD重度组的肌源性细胞比例明显下降,脂肪细胞和FAPs比例升高,尤其是脂肪细胞明显增加,提示FSHD重度组区别于轻度组的主要特征是肌肉的纤维化和脂肪浸润。2个疾病组的内皮细胞和平滑肌细胞比例均下降,免疫细胞比例均升高,尤其是巨噬细胞明显增加(图1B)。
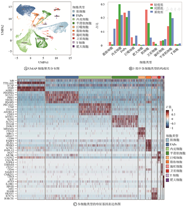

UMAP—统一流形逼近与投影;FAPs—纤维/脂肪祖细胞
与FSHD轻度组相比,重度组的10种细胞类型中共有272个DEGs,并鉴定了其中46个与疾病相关的功能性DEGs。这些功能性DEGs主要集中在肌源性细胞、免疫细胞和FAPs,与细胞凋亡、氧化应激、免疫炎症和肌肉调节等功能相关(表1)。图2显示,与FSHD轻度组相比,重度组功能性DEGs的KEGG分析的上调通路主要富集在趋化因子信号通路、过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptor,PPAR)信号通路、细胞因子-细胞因子受体相互作用通路和吞噬体通路等;下调通路主要富集在丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路、黏着斑途径、磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)信号通路和钙离子信号通路等,提示重度组存在更严重的炎症和促脂质沉积的肌肉微环境以及对细胞内正常信号传导途径的抑制作用。
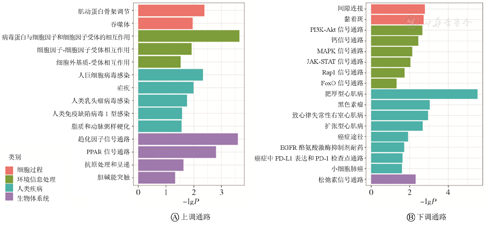

PPAR—过氧化物酶体增殖物激活受体;PI3K-Akt—磷脂酰肌醇3-激酶-蛋白激酶B;MAPK—丝裂原活化蛋白激酶;JAK-STAT—Janus激酶-信号转导子与转录激活子;Rap1—Ras相关蛋白1;FoxO—叉头转录因子;EGFR—表皮生长因子受体;PD-L1—细胞程序性死亡-配体1;PD-1—程序性死亡受体-1
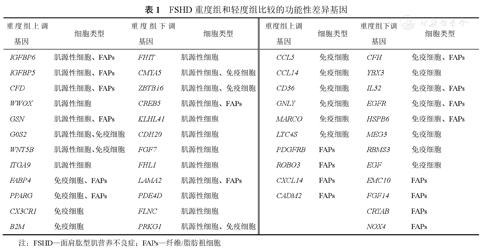
FSHD重度组和轻度组比较的功能性差异基因
FSHD重度组和轻度组比较的功能性差异基因
| 重度组上调基因 | 细胞类型 | 重度组下调基因 | 细胞类型 | 重度组上调基因 | 细胞类型 | 重度组下调基因 | 细胞类型 |
|---|---|---|---|---|---|---|---|
| IGFBP6 | 肌源性细胞、FAPs | FHIT | 肌源性细胞 | CCL5 | 免疫细胞 | CFH | 免疫细胞、FAPs |
| IGFBP5 | 肌源性细胞、FAPs | CMYA5 | 肌源性细胞、免疫细胞 | CCL14 | 免疫细胞 | YBX3 | 免疫细胞 |
| CFD | 肌源性细胞、FAPs | ZBTB16 | 肌源性细胞、免疫细胞 | CD36 | 免疫细胞 | IL32 | 免疫细胞、FAPs |
| WWOX | 肌源性细胞 | CREB5 | 肌源性细胞、FAPs | GNLY | 免疫细胞 | EGFR | 免疫细胞、FAPs |
| GSN | 肌源性细胞、FAPs | KLHL41 | 肌源性细胞 | MARCO | 免疫细胞 | HSPB6 | 免疫细胞、FAPs |
| G0S2 | 肌源性细胞、免疫细胞 | CDH20 | 肌源性细胞 | LTC4S | 免疫细胞 | MEG3 | 免疫细胞 |
| WNT5B | 肌源性细胞、免疫细胞 | FGF7 | 肌源性细胞 | PDGFRB | FAPs | RBMS3 | 免疫细胞 |
| ITGA9 | 肌源性细胞 | FHL1 | 肌源性细胞 | ROBO3 | FAPs | EGF | 免疫细胞 |
| FABP4 | 免疫细胞、FAPs | LAMA2 | 肌源性细胞、FAPs | CXCL14 | FAPs | EMC10 | FAPs |
| PPARG | 免疫细胞、FAPs | PDE4D | 肌源性细胞 | CADM2 | FAPs | FGF14 | FAPs |
| CX3CR1 | 免疫细胞 | FLNC | 肌源性细胞 | CRYAB | FAPs | ||
| B2M | 免疫细胞 | PRKG1 | 肌源性细胞、免疫细胞 | NOX4 | FAPs |
注:FSHD—面肩肱型肌营养不良症;FAPs—纤维/脂肪祖细胞
图3显示,FSHD重度组具有最多的配受体对数目和最强的细胞间相互作用强度,提示FSHD重度组肌肉微环境中存在更复杂的细胞间通讯网络。表2显示,FAPs的配受体数目在所有细胞类型中最多,尤其是配体数目,提示FAPs是FSHD肌肉微环境中的重要信号来源。FSHD重度组中,肌细胞的配受体数目减少,巨噬细胞配受体数目明显增加,提示巨噬细胞在FSHD疾病进展中起重要作用。

FAPs—纤维/脂肪祖细胞
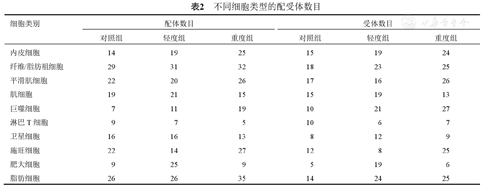
不同细胞类型的配受体数目
不同细胞类型的配受体数目
| 细胞类别 | 配体数目 | 受体数目 | ||||
|---|---|---|---|---|---|---|
| 对照组 | 轻度组 | 重度组 | 对照组 | 轻度组 | 重度组 | |
| 内皮细胞 | 14 | 19 | 25 | 15 | 19 | 24 |
| 纤维/脂肪祖细胞 | 29 | 31 | 32 | 18 | 23 | 25 |
| 平滑肌细胞 | 22 | 20 | 26 | 17 | 16 | 26 |
| 肌细胞 | 19 | 21 | 15 | 15 | 19 | 13 |
| 巨噬细胞 | 7 | 11 | 19 | 10 | 21 | 27 |
| 淋巴T细胞 | 9 | 7 | 5 | 10 | 6 | 7 |
| 卫星细胞 | 16 | 16 | 13 | 8 | 12 | 9 |
| 施旺细胞 | 22 | 14 | 27 | 12 | 8 | 25 |
| 肥大细胞 | 9 | 25 | 9 | 5 | 19 | 6 |
| 脂肪细胞 | 26 | 26 | 35 | 14 | 24 | 25 |
图4显示,在信号输入强度方面,疾病组的肌细胞信号输入强度明显减弱;重度组的FAPs信号输入强度明显减弱;巨噬细胞和脂肪细胞在疾病组,尤其是重度组,信号输入强度明显增强。在信号输出强度方面,疾病组的肌细胞信号输出强度明显减弱;相比于其他细胞类型,FAPs在3组中都存在较强的信号输出强度;重度组的巨噬细胞和脂肪细胞信号输出强度明显增强。提示,FAPs和巨噬细胞通讯模式的变化与FSHD异常的肌肉微环境密切相关,重度组中巨噬细胞、FAPs和脂肪细胞是细胞间通讯的主要细胞类型。
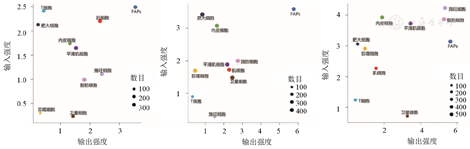

FAPs—纤维/脂肪祖细胞
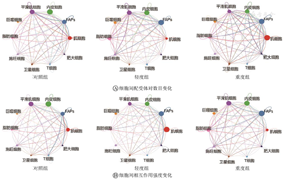
通过比较3组中细胞间信号传导通路的变化情况,发现了6条FSHD的独有信号通路:骨形态发生蛋白(bone morphogenetic proteins,BMP)、转化生长因子-β(transforming growth factor-β,TGF-β)、CXC基序趋化因子配体(CXC motif chemokine ligand,CXCL)、黏附G蛋白偶联受体E5(adhesion G protein-coupled receptor E5,ADGRE5)、白细胞介素-16(interleukin-16,IL-16)和无翅型MMTV整合位点家族(wingless-type MMTV integration site family,WNT)信号通路。说明上述通路是与FSHD疾病相关性较强的信号通路,这些信号通路传导的失调可导致FSHD肌肉微环境紊乱,进而影响肌肉功能。
图5、图6表明,与轻度组相比,重度组中TGF-β信号通路中巨噬细胞到脂肪细胞、T细胞和肥大细胞的通讯增加;BMP信号通路中脂肪细胞到FAPs的通讯增加;IL-16信号通路中脂肪细胞到巨噬细胞的通讯增加。CXCL和WNT信号通路仅存在于FSHD重度组。其中,CXCL信号通路主要表现为FAPs和内皮细胞到脂肪细胞的通讯增强;WNT信号通路主要表现为FAPs到脂肪细胞和内皮细胞的通讯增强。提示巨噬细胞、FAPs和脂肪细胞间的相互作用与FSHD的疾病进展密切相关,可能参与调控病变肌肉的脂肪沉积和纤维化改变。
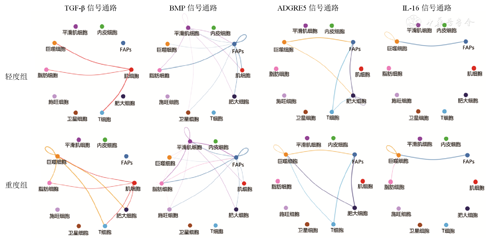

TGF-β—转化生长因子-β;BMP—骨形态发生蛋白;ADGRE5—黏附G蛋白偶联受体E5;IL-16—白细胞介素-16;FAPs—纤维/脂肪祖细胞
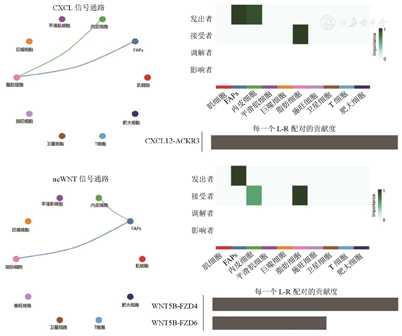

CXCL—CXC基序趋化因子配体;WNT—无翅型MMTV整合位点家族;FAPs—纤维/脂肪祖细胞
本研究通过对2例FSHD患者的双侧不对称病变口轮匝肌和2例正常口轮匝肌的单核转录组测序数据进行综合分析,揭示了FSHD双侧肌肉微环境的转录异质性以及关键细胞类型间的细胞通讯模式。
FSHD区别于其他肌营养不良病的主要特征之一是肌肉病变过程中的双侧不对称性,这主要与DUX4引起的肌肉纤维化和脂肪替代程度不同有关[18]。为探究FSHD双侧肌肉不对称的分子机制,本研究分析了双侧肌肉样本的转录异质性,发现与轻度组相比,重度组存在更严重的炎症和脂肪浸润的肌肉微环境以及细胞内正常信号传导途径的抑制,提示FSHD的临床表型和转录组特征之间存在一定相关性。本研究通过单核转录组分析,首次在FSHD患者肌肉活检组织中鉴定了双侧肌肉样本的功能性差异基因和富集通路,为FSHD双侧不对称病变的发病机制提供了一些参考。
既往研究已经证实了DUX4及其靶基因在FSHD疾病中的关键作用[19,20],并推测免疫细胞和FAPs可能在慢性肌营养不良背景下参与疾病的进展,破坏正常的肌肉微环境[21,22,23]。FSHD的晚期特征是持续的慢性炎症和病理性纤维化和脂肪浸润,尤其是脂质的沉积。DUX4的早期短暂表达即可干扰肌肉稳态,导致FSHD疾病状态的持续存在和进展[24]。因此,造成FSHD异常肌肉微环境持续状态的关键非肌源性细胞(免疫细胞和FAPs等)之间的细胞通讯模式可能是FSHD发病机制的重要方面。本研究对FSHD肌肉微环境下不同细胞类型之间的细胞间相互作用关系进行了较为全面的分析,发现与对照组相比,正常肌肉再生过程中协调有序的细胞间相互作用在慢性肌营养不良背景下发生改变。本研究结果证实了FAPs和巨噬细胞是FSHD异常肌肉微环境中细胞通讯网络的重要信号来源,与疾病进展密切相关。并且,重度组FSHD中具有更复杂的细胞间相互作用关系。BMP、TGF-β、CXCL、ADGRE5、IL-16和WNT信号通路是FSHD组中发现的6条特有通路,主要介导炎症、免疫、纤维化、趋化性和黏附性等生理过程,是与FSHD疾病发生和进展相关的重要信号通路。对上述通路的进一步分析发现,这些信号通路在重度组主要涉及巨噬细胞、FAPs和脂肪细胞间的细胞通讯,可能参与调控病变肌肉的脂肪沉积和纤维化改变。以上结果或可在FSHD的靶向治疗中起一定作用,以抑制肌肉的纤维和脂肪化。
本研究有以下几点局限性。首先,研究仅纳入了2例双侧FSHD样本进行单核转录组测序,纳入的个体数量较少。其次,细胞间通讯模式的分析仅限于主要细胞类型间的相互作用,对FSHD肌肉微环境中其他细胞类型未进行全面分析。另外,研究未纳入其他水平的验证数据,研究结果在未来需结合体内外实验对巨噬细胞、FAPs和脂肪细胞之间的关键信号通路进行更深入的功能和机制研究。
综上所述,本研究为FSHD双侧不对称病变的肌肉样本提供了较为全面的细胞间通讯网络,为理解FSHD肌肉微环境的细胞间调控机制提供适当参考。
所有作者均声明不存在利益冲突



























