
癌症是全球范围内死亡的第2大原因,而癌症患者前期症状不明显以及预后较差是导致患者死亡的主要因素。因此,寻找有效的诊断性及预后评估的生物标志物对于降低癌症发生率以及提高预后准确性都具有十分重要的意义。tRNA衍生片段是一类新的非编码RNA,在癌症生物学中具有重要的调控作用。主要对tRNA衍生片段在肿瘤发生、发展及预后过程中作为生物标志物的研究进展进行综述,为癌症的诊断和预后评估提供理论基础。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
转运RNA(transfer RNA,tRNA)衍生片段存在于多种物种细胞内,在某些特定情况下由成熟tRNA或前体tRNA特异性剪切产生。高通量测序和实时荧光定量等技术发现tRNA衍生片段在不同组织及体液中的表达量具有差异。通过对各类癌症中tRNA衍生片段的差异性表达进行分析,tRNA衍生片段大多具有生物标志物的作用,而此作用主要体现在诊断性和预后评估生物标志物2个方面。tRNA衍生片段作为诊断性生物标志物,为实行早期无侵入性诊断肿瘤提供了有力证据;作为预后评估生物标志物,为评估患者预后情况及预测患者生存期等方面提供了重要的理论依据,同时,其为干预患者预后不良提供了有意义的指标。tRNA衍生片段存在于生命中各个时期,并且在一定程度上能在多个层面参与对生命的调控。本文主要对tRNA衍生片段在肿瘤发生、发展及预后过程中作为生物标志物的研究进展进行综述,为癌症的诊断和预后评估提供理论基础,在干预肿瘤生长、侵袭以及肿瘤不良预后等方面具有重要的临床意义。
根据不同的切割方式,tRNA产生了tRNA衍生的小RNA(tRNA-derived small RNA,tsRNAs)、tRNA源性应激诱导RNAs(tRNA-derived stress-induced RNAs,tiRNAs)和tRNA来源的小片段RNA(tRNA-derived fragments,tRFs)3种不同类别的tRNA衍生片段[1]。
tsRNAs是一类由tRNAs衍生的小RNA,通常长度为18~40 nt,是一类新的调节性非编码小RNA,参与多种生理和病理过程,在不同水平上调节基因表达[2]。通过tsRNAs特异微阵列芯片发现tsRNAs的异常表达在胃癌等多种肿瘤的发生、发展及预后中具有十分重要的作用。因此可将其作为生物标志物对肿瘤的发展进行预测[3]。
tiRNAs片段由成熟tRNA反密码环中特定位点切割而产生,长度为29~50 nt。根据包含5’或3’序列,可以将tiRNAs分为tiRNAs-5和tiRNAs-3[4]。tiRNAs具有多种生物学功能,如在应激反应中作为信号分子参与基因表达调控,通过结合蛋白质影响mRNA的稳定性,对癌症起到抑制作用[5]。不同类型、不同表达量的tiRNAs与各类癌症密切相关,因此tiRNAs具有作为肿瘤标志物的潜能[6]。
tRFs是细胞根据需要主动对tRNA进行特异性剪切和加工所产生的结果,短于tiRNAs。tRFs主要有3种,分别为tRF-5、tRF-3和tRF-1。tRF-5通过切割D环从成熟tRNA5’端衍生而来,tRF-3是由TψC环中成熟tRNA3’端被特异性切割而形成,而tRF-1是从前体tRNA3’端尾部产生[7]。除以上3种主要tRFs外还有tRF-2和I-tRFs,tRF-2由tRNA反密码子环分解产生,I-tRFs通常来源于成熟tRNAs内部区域,并可以跨越反密码子[8]。在癌症发生阶段,tRFs表达量会上升,可将其作为致癌因子,而在肿瘤进展阶段,当敲除tRFs时又会加速肿瘤进展,又可将其作为抑癌因子,但对此现象的机制仍需验证[9],不可否认的是tRFs的变化会涉及癌症、代谢、病毒感染、肌肉性疾病等多种疾病,具有重要的生物标志物潜能。
现目前,各类肿瘤的诊断方式除了通过影像学、病理学检验以外,利用生物标志物也是重要手段之一。传统临床上所使用的生物标志物主要为肿瘤抗原或异常激素等。但由于此类生物标志物具有多种不足,如灵敏性低、准确度低,在诊断过程中容易造成患者错失最佳治疗时间,导致患者预后不良甚至死亡。而近年来,大量研究发现多种tRNA衍生片段在肿瘤患者的体液中能够稳定存在,并且在一定程度上参与肿瘤疾病的发生、发展。由于tRNA衍生片段的表达水平随着肿瘤疾病的进展不断发生动态变化,这对于把握肿瘤患者的预后情况具有重要意义。所以利用tRNA衍生片段作为肿瘤诊断及评估预后的生物标志物是目前肿瘤生物标志物研究领域中较为热门的研究之一。
肺癌可分为小细胞肺癌和非小细胞肺癌(non-small cell lung cancer,NSCLC),在肺癌患者血浆及癌组织中存在异常表达的tRNA衍生片段。且研究发现有超过80%的肺癌患者为NSCLC。因此,在NSCLC中寻找异常表达的tRNA衍生片段具有十分重要的诊断性意义。Sun等[10]基于以往研究发现tRNAIleAAT-8-1A在NSCLC中较正常组织显著上调,预测其可能为NSCLC诊断的生物标志物。此外,另一项研究通过分析tRiC数据库和GDC网站上的临床数据,发现tRNA-Ser-AGA-2-1在Ⅰ期NSCLC研究中高表达[11]。同时,Li等[12]通过实时荧光定量PCR技术检测20对NSCLC患者术前、术后血清标本中tRF-31-79MP9P9NH57SD的表达,发现NSCLC患者血清tRF-31-79MP9P9NH57SD表达较高,且tRF-31-79MP9P9NH57SD的表达水平与临床分期有关。在此基础上,利用受试者工作特征(receiver operating characteristic,ROC)曲线分析其诊断效果,证明血清tRF-31-79MP9P9NH57SD可能是NSCLC诊断的一个新的突破性生物标志物。Shao等[13]通过小RNA测序技术检测NSCLC组织、细胞株和血清中小RNA的表达水平,发现NSCLC中tRF-Leu-CAG-RNA水平高于正常组织,根据ROC曲线分析,Ⅳ期病例的曲线下面积(area under curve,AUC)为0.7,证明tRF-Leu-CAG可以作为NSCLC Ⅳ期患者的诊断指标。同时在NSCLC中的肺腺癌组织及血浆中tRF-16-L85J3KE表达下调,tRF-21-RK9P4P9L0和tRF-16-PSQP4PE表达上调,AUC为0.92。因此可将其作为肺腺癌诊断的生物标志物[14]。
喉鳞状细胞癌是头颈部常见的恶性肿瘤。研究人员从4对喉鳞状细胞癌组织及邻近正常组织中提取RNA,通过高通量测序发现tRF-33-Q1Q89P9L842205在喉鳞状细胞癌中表达下调。采用ROC曲线进行评估,判定其作为一个潜在的诊断性生物标志物[15]。此外,Li等[16]应用实时荧光定量PCR技术检测喉鳞状细胞癌组织及邻近正常组织中tRNA的表达谱,发现tRNAIniCAT在喉鳞状细胞癌中的表达较对照组明显降低。并采用ROC曲线评估诊断价值,判定tRNAIniCAT可作为喉鳞状细胞癌早期诊断的一种新的生物标志物。
结直肠癌是全球常见的第3大癌症,具有高度变异性且变异形式多种多样,因此在早期筛查中很难被准确发现。Zhu等[17]利用小RNA测序分析了104例结直肠癌患者中tsRNAs在肿瘤组织和癌旁组织的表达,筛选出了4个有显著意义的tsRNAs即tRF-22-WB86Q3P92、tRF-22-WE8SPOX52、tRF-22-WE8S68L52和tRF-18-8R1546D2,基于4个tsRNAs模型的AUC为0.93,应用2个独立的数据集对分类模型进行测试,AUC分别为0.97和0.99,这些数据表明它们可以作为结直肠癌的诊断模型。这对于结直肠癌的早期诊断具有十分重要的意义。此外,Chen等[18]研究发现在结直肠癌细胞HT29中tRF-phe-GAA-031和tRF-VAL-TCA-002的表达较癌旁组织显著上调。通过评估tRF-Phe-GAA-031和tRF-VAL-TCA-002的诊断价值,前者AUC为0.755 4(95% CI:0.673 9~0.836 9),后者AUC为0.731 3(95% CI:0.647 4~0.815 1),并通过Kaplan-Meier分析tRF-Phe-GAA-031和tRF-VAL-TCA-002表达与患者总生存期之间的关系。表明tRF-Phe-GAA-031和tRF-VAL-TCA-002表达较高的患者总生存期较低,并显示tRF-Phe-GAA-031和tRF-VAL-TCA-002可能为其临床诊断的潜在生物标志物和干预靶点。同时,Wu等[19]采用小RNA测序研究了结直肠癌患者血浆中tDRs的表达谱,5’-tRF GlyGCC在结直肠癌患者血浆中较对照组显著升高,AUC为0.882(95% CI:0.83~0.92,P<0.001),是一种结直肠癌潜在的诊断性生物标志物。
乳腺癌是女性中常见、对人类健康有极大危害的恶性肿瘤之一,早期诊断可提高乳腺癌患者的生存率。研究报道miR-1260a和miR-4521可成为乳腺癌的生物标志物,而这2种miRNA序列分别来源于tRF-3001a和tRF-1003。研究人员利用实时荧光定量PCR法发现相较于它们所衍生的miRNA,tRF-3001a和tRF-1003能更精准地诊断乳腺癌,并且这2类tRNA衍生片段在一定程度上可以对乳腺癌患者的生存进行预测[20]。在三阴性乳腺癌细胞MDA-MB-231中抑制tRF-19-W4PU732S的表达,可减弱MDA-MB-231细胞的增殖、迁移和侵袭,促进细胞凋亡。因此可将其作为MDA-MB-231的潜在生物标志物[21]。Wang等[22]通过收集128例未接受辅助治疗的乳腺癌患者和116例健康对照者,收集其外周静脉血样,通过高通量测序发现tRF-Arg-CCT-017、tRF-Gly-CCC-001和tiRNA-Phe-GAA-003的表达水平高于人乳腺上皮细胞MCF-10A,并采用ROC曲线评价诊断价值。发现这3个tRNA衍生片段的AUC分别为0.683(95% CI:0.615~0.751,P<0.001)、0.656(95% CI:0.585~0.727,P<0.001)、0.666(95% CI:0.595~0.737,P<0.001),表明这些小RNA对于乳腺癌的诊断具有一定的价值。此外,Zhang等[23]通过高通量测序发现与健康志愿者相比,乳腺癌患者以及早期患者的组织和血清中tRF-Gly-CCC-046、tRF-Tyr-GTA-010和tRF-Pro-TGG-001均下调。AUC达到0.7871,敏感性为83.6%,特异性为56.6%,表明这3种tRFs具有作为乳腺癌无创循环生物标志物的巨大潜力,可作为乳腺癌早期诊断的生物标志物。
胃癌是仅次于肺癌的全球第2大癌症,大多数胃癌患者在诊断时已表现出晚期体征,并且转移复发率极高。寻找新的生物标志物对于癌症的诊断具有十分重要的作用。Wang等[24]通过高通量测序发现tRF-24-V29K9UV3IU在胃癌中低表达。tRF-24-V29 K9UV3IU可以通过下调G蛋白偶联受体78的表达,从而抑制胃癌细胞的增殖、侵袭和迁移,促进胃癌细胞凋亡。可将其作为胃癌中新的靶点和诊断生物标志物,为胃癌的诊断开发分子疗法,这对于临床治疗具有十分重要的作用。此外,研究人员通过对胃癌患者和健康人血浆中tsRNAs测序,发现tRF-33-P4R8YP9LON4VDP在胃癌患者较健康人中显著上调,并将其作为胃癌新的诊断标志物和靶点[25]。Shen等[25]还通过实时荧光定量PCR鉴定了tRF-3L7L73JD在胃癌患者血浆中与对照组的差异表达,并测定了40例胃癌患者和对照者血浆tRF-3L7L73JD的水平,结果表明tRF-19-3L7L73JD在胃癌患者中表达较低。且AUC为0.623 0,灵敏度为0.404 5,特异性为0.795 9。表明tRF-19-3L7L73JD在胃癌筛查与诊断中具有十分重要的作用[3]。此外,Zhang等[26]采用高通量测序技术检测胃癌组织中tsRNAs的差异表达,发现tRF-23-Q99P9P9NDD在胃癌血清中的表达明显高于对照组。ROC评价tRF-23-Q99P9P9NDD在胃癌中的诊断效果,显示tRF-23-Q99P9P9NDD具有更高的诊断效能,因此认为tRF-23-Q99P9P9NDD有可能成为胃癌的新诊断性生物标志物。
胰腺癌是一种死亡率极高的癌症,其前期特异性症状不明显,预后差,目前需要进一步研究其诊断性生物标志物。tRNA衍生片段的出现为胰腺癌的诊断及治疗提供了潜在的契机。Sui等[27]通过高通量测序发现tRF-Leu-AAG在胰腺癌细胞中的表达明显高于癌旁组织。敲除tRF-Leu-AAG可显著抑制细胞增殖、迁移和侵袭。这为tRF-Leu-AAG作为胰腺癌诊断生物标志物提供了新的可能。有研究通过从下咽癌患者和健康人的细胞外囊泡中提取小RNAs,并通过实时荧光定量PCR验证,结果显示tRF-1:30-Lys-CTT-1-M2在下咽癌患者和肿瘤细胞中明显高表达,且AUC为0.9172,差异有统计学意义(P<0.001),可将其作为下咽癌的新诊断性生物标志物[28]。此外,Zhu[29]通过对肝癌患者血浆外泌体检测发现,与对照组相比,tRNA-ValTAC-3、tRNA-GlyTCC-5、tRNA-ValAAC-5和tRNA-glutcc-5表达水平显著升高,研究表明血浆外泌体tsRNAs可作为一种新的诊断性生物标志物。与此同时,Li等[30]通过对食管鳞状细胞癌患者唾液外泌体中的小RNA和健康志愿者唾液中外泌体小RNA进行研究分析发现tRNA-glygc-5在食管鳞状细胞癌患者中高表达,并将其作为食管鳞状细胞癌诊断的非侵入性生物标志物具有重要价值。此外,研究人员通过对宫颈癌腺癌组织样本进行小RNA测序,对于不同的宫颈管腺癌的亚类以及所有TDr亚型而言,tRF-5的表达量较高,且通过进一步分析发现Other-2:23-tRNA-Val-AAC-1-M7在不同亚型的宫颈癌腺癌中具有差异,即其具有作为宫颈癌腺癌潜在生物标志物的价值[31]。研究发现tRFs/tiRNAs可能是多发性骨髓瘤的潜在生物标志物[32],在原发性鼻咽癌中tRFs和tiRNAs均存在异常表达,tRFs和tiRNAs可能成为一类新的生物学诊断指标[33]。
在结直肠癌患者肿瘤转移、侵袭前期把握其发展程度,对于有效治疗肿瘤以及患者的预后程度都有极大的益处,Chen等[18]通过实时荧光定量PCR验证了结直肠患者肿瘤组织以及非肿瘤组织中差异性表达的tsRNAs,发现tRF-phe-GAA-031和tRF-VAL-TCA-002在结直肠癌组织中显著上调,表明这2种tRF与结直肠癌的侵袭、转移显著相关。并且通过Kaplan-Meier分析表明高水平tRF-phe-GAA-031和tRF-VAL-TCA-002的患者总生存期较低,表示这2种tRF可能成为评估患者预后情况的重要生物标志物。此外,有研究通过RNA测序鉴定发现tRF3008A在结直肠癌中表达量下降,并且tRF3008A的下降与结直肠癌转移显著相关。该研究表示tRF3008A在结直肠癌的发展中是一个独立性的因素[34]。并且,Tsiakanikas等[35]基于既往研究,通过从结直肠癌患者肿瘤组织以及正常组织中提取RNA,利用实时荧光定量PCR技术进行评估5’-tiRNA-ProTGG的表达水平,COX回归表明高水平的5’-tiRNA-ProTGG是结直肠癌患者术后复发等不利预后情况的独立性因素之一,同时该研究表示其表达水平可以作为结直肠癌患者预后存活时长的预测指标之一。在另一项研究中,Zhu等[17]利用小RNA测序技术对结直肠癌患者肿瘤组织中的tsRNAs进行测定,tRF-18-HSRVK7D2、tRF-33-PSQP4PW3FJI0W、tRF-33-PSQP4PW3FJIKW、tRF-18-H9Q867D2、tRF-32-O7M8LOMLQHWU3和tRF-16-I3FJQSD的变化情况与结直肠癌患者的预后显著相关,并进一步通过LASSO COX回归模型建立了预后风险评估模型,表示低风险评分的患者拥有更高的生存可能性。
前列腺癌和胰腺导管腺癌是危害性最大的常见肿瘤之一。Xue等[36]在对胰腺导管腺癌患者血清进行小RNA测序,以探索血清中tsRNAs表达谱作为把握癌症发展的重要生物标志物时,发现患者血清中tsRNA-MetCAT-37、tsRNA-ValTAC-41和tsRNA-ThrTGT-23发生了上调,通过ROC分析得出tsRNA-MetCAT-37与tsRNA-ValTAC-41的AUC值分别为0.687、0.793,表明其具有一定的诊断能力。此外,该研究表明,tsRNA-ValTAC-41表达水平与患者存活时间呈负相关趋势,即这些tsRNAs在把握肿瘤进程过程中可能具有重要作用。同时,另一项基于前列腺癌患者血清样本tsRNAs检测表明,tRF-Pro-AGG-004和tRF-Leu-CAG-002呈现出高表达,且Jin等[37]通过进一步分析发现这两者表达水平与患者生存时间呈现正相关趋势,表明这2种tsRNAs不仅作为诊断时具有重要意义,而且在预测患者术后生存时间方面也具有重要作用。Li等[38]通过基于既往研究表明tRF-Pro-CGG在前列腺癌组织与正常胰腺组织中差异性表达,对比正常胰腺组织与胰腺导管腺癌患者的肿瘤组织中tRF-Pro-CGG的表达情况,发现其表达量下降,且作为一个独立性预后因素,在其水平下降时预示患者存活率降低。即在评估患者预后情况上具有重要意义。除此之外,也有研究寻找与胰腺导管腺癌患者预后存活时间相关的tRFs,通过实时荧光定量PCR发现,高水平表达tRF-21的胰腺导管腺癌患者的生存时间与低水平表达tRF-21的患者相比,前者具有更长的生存时间,表示tRF-21参与了胰腺导管腺癌的发展。即tRF-21不仅可以作为提高患者生存率的治疗靶点,并且在一定程度上可以作为预测患者生存度的有力指标[39]。
脑胶质瘤通过早期准确诊断,及时通过外科手术的方式进行治疗是目前较为常用的手段。但对患者术后预后情况把握是提高患者生存率的重要手段之一。Huang等[40]通过高通量测序筛选了脑胶质瘤患者肿瘤组织中tRNAs衍生的小RNA,发现tRF-31-U5YKFN8DYDZDD在脑胶质瘤中高表达,并且能够稳定的存在于肿瘤组织以及血清中。同时,脑胶质瘤的发生、发展与之显著相关,其不仅可以作为一种诊断性生物标志物(AUC为0.74),而且可作为一种把握脑胶质瘤预后的预测因子,在提高患者生存率方面有积极作用。此外,有研究人员利用OncotRF数据库筛选得到可作为生物标志物的tRNA衍生片段hsa_tsr016141,再通过实时荧光定量PCR检测脑胶质瘤患者血清以及肿瘤组织中tRNA衍生的hsa_tsr016141表达水平,发现其血清表达水平与发展程度呈正相关,并且由于其具有良好的稳定性以及特异性(78%),所以hsa_tsr016141作为一种生物标志物,不仅能在诊断方面具有重要价值,更重要的是其可以通过便捷的动态监测手段实现对患者预后情况的动态把握,为提高患者生存率以及防止复发率起到了重要作用[41]。Zhu等[42]通过实时荧光定量PCR检测脑胶质瘤患者肿瘤组织和患者血浆中tRF-5026a的表达水平时,发现脑胶质瘤患者组织和血浆中tRF-5026a表达下调。该研究表示tRF-5026a水平与肿瘤大小密切相关,并且证实了tRF-5026a是通过调类脂磷酸酶/磷脂酰肌醇3-激酶/蛋白激酶B信号通路抑制脑胶质瘤细胞的增殖、迁移和细胞周期进程。进一步评估其诊断价值,tRF-5026a在组织以及血浆中AUC分别为0.631、0.883,且两者合并之后AUC为0.908,具有显著的诊断效力。同时,该研究通过绘制生存曲线,表示tRF-5026a是脑胶质瘤预后的独立预测因子,其低表达时患者生存期与高表达组相比明显不足。
除上述几类癌症中tRNA衍生片段作为预后生物标志物以外,近年来,在其他多种癌症中均展示出tRNA衍生片段作为预后生物标志物的重要作用。如Katsaraki等[43]通过分析B细胞慢性淋巴细胞白血病患者的测序数据,并通过患者血液样本进行验证,发现具有高水平tRF-LeuAAG/TAG的患者生存期明显缩短,表示高水平的tRF-LeuAAG/TAG是一种独立的预后因素,其在评估患者预后水平上具有显著意义。除此之外,有研究通过运用高通量测序检测B细胞慢性淋巴细胞白血病患者血浆中差异性表达的tsRNAs,阐明了tRF-Arg-CCT-017、tRF-Arg-CCT-001和tiRNA-Phe-GAA-003的表达水平在B细胞慢性淋巴细胞白血病患者血浆中的表达具有显著差异,且高水平tRF-Arg-CCT-017或tiRNA-Phe-GAA-003的患者预后情况较差,这主要表现为总生存期明显降低[22]。同时,Li等[30]通过对食管鳞状细胞癌患者的唾液外泌体进行RNA测序发现tRNA-GlyGCC-5和一种既往没有被表征过的小RNA在该类肿瘤患者的唾液外泌体中特异性富集,而利用这2种双RNA所构建的预后逻辑回归模型在很大程度上反映了患者的总生存期。而在这个评估系统中tsRNA是必不可少的一员,能在很大程度上提高对于患者预后情况的把握,从而施行精准的治疗。还有研究表明原发性肝癌中tRNA衍生片段在预后阶段同样具有重要作用,如Zuo等[44]通过检测肝原发性肿瘤以及癌旁组织中差异性表达的tsRNAs(ts-N20、ts-N21、ts-N22、ts-N36、ts-N37、ts-N44和ts-N64),并通过LASSO COX回归模型构建预后模型,表明低风险患者的生存率明显高于高风险患者,且Ⅱ期与Ⅳ期的高低风险具有显著性差异,且此预后评估模型仍然是一个独立的因素。
不同tRNA衍生片段作为肿瘤预后标志物见表1。
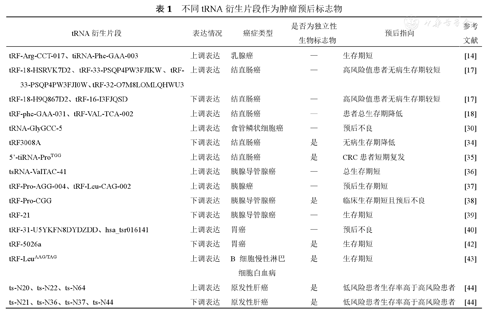
不同tRNA衍生片段作为肿瘤预后标志物
不同tRNA衍生片段作为肿瘤预后标志物
| tRNA衍生片段 | 表达情况 | 癌症类型 | 是否为独立性生物标志物 | 预后指向 | 参考文献 |
|---|---|---|---|---|---|
| tRF-Arg-CCT-017、tiRNA-Phe-GAA-003 | 上调表达 | 乳腺癌 | — | 生存期短 | [14] |
| tRF-18-HSRVK7D2、tRF-33-PSQP4PW3FJIKW、tRF-33-PSQP4PW3FJI0W、tRF-32-O7M8LOMLQHWU3 | 上调表达 | 结直肠癌 | — | 高风险值患者无病生存期较短 | [17] |
| tRF-18-H9Q867D2、tRF-16-I3FJQSD | 下调表达 | 结直肠癌 | — | 高风险值患者无病生存期较短 | [17] |
| tRF-phe-GAA-031、tRF-VAL-TCA-002 | 上调表达 | 结直肠癌 | — | 患者总生存期降低 | [18] |
| tRNA-GlyGCC-5 | 上调表达 | 食管鳞状细胞癌 | — | 预后不良 | [30] |
| tRF3008A | 下调表达 | 结直肠癌 | 是 | 无病生存期降低 | [34] |
| 5’-tiRNA-ProTGG | 上调表达 | 结直肠癌 | 是 | CRC患者短期复发 | [35] |
| tsRNA-ValTAC-41 | 上调表达 | 胰腺导管腺癌 | — | 总生存期短 | [36] |
| tRF-Pro-AGG-004、tRF-Leu-CAG-002 | 上调表达 | 胰腺癌 | — | 预后生存期短 | [37] |
| tRF-Pro-CGG | 下调表达 | 胰腺导管腺癌 | 是 | 临床生存期短且预后不良 | [38] |
| tRF-21 | 下调表达 | 胰腺导管腺癌 | — | 生存期短 | [39] |
| tRF-31-U5YKFN8DYDZDD、hsa_tsr016141 | 上调表达 | 胃癌 | — | 预后不良 | [40] |
| tRF-5026a | 下调表达 | 胃癌 | 是 | 生存期短 | [42] |
| tRF-LeuAAG/TAG | 上调表达 | B细胞慢性淋巴细胞白血病 | 是 | 生存期短 | [43] |
| ts-N20、ts-N22、ts-N64 | 上调表达 | 原发性肝癌 | 是 | 低风险患者生存率高于高风险患者 | [44] |
| ts-N21、ts-N36、ts-N37、ts-N44 | 下调表达 | 原发性肝癌 | 是 | 低风险患者生存率高于高风险患者 | [44] |
早期癌变组织体积上的微小变化在影像学证据中可能被忽略,易导致发生误诊及漏诊,所以探寻特异性肿瘤生物标志物是诊断和把握肿瘤发生、发展的一种有效途径。
癌症的早期诊断对于肿瘤的发病率和死亡率起着关键作用。因tRNA衍生片段具有稳定、高度富集和组织特异性强且存在于多种生物体液等特性,所以可以通过多种途径被检测,在新型标志物的探索和开发上有重要优势。近年来,tRNA衍生片段已成为探索高特异性、高灵敏性和高准确性的肿瘤生物标志物的研究热点。
随着tRNA衍生片段的深入研究,人们还在代谢性疾病、肌肉性疾病、神经性疾病、艾滋病、阿尔茨海默症、癫痫、糖尿病、智力残疾、听力损失和心肌病等疾病中发现了tRNA衍生片段的踪迹。因此,tRNA衍生片段在不同肿瘤及其他疾病研究中占有十分重要的地位,并有望成为诊断和治疗这些疾病的新方向。
所有作者均声明不存在利益冲突



























