
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
青少年发病的成人型糖尿病(maturity onset diabetes of the young, MODY)是一种由单个基因突变导致的特殊类型糖尿病。其特征性表现为:发病年龄早;常染色体显性遗传;至少5年内不依赖胰岛素治疗,无酮症倾向。迄今为止已发现14种基因与MODY有关,其中HNF1α-MODY较为常见,笔者在此报道3例南京鼓楼医院内分泌科确诊的具有显著临床异质性的HNF1α-MODY病例。
病例1:女性,26岁,因"发现血糖升高1个月"于2018年7月26日入院。患者1个月前因恶心、呕吐于当地医院就诊,测随机血糖17.4 mmol/L,尿常规示酮体+++,尿糖+++,糖化血红蛋白A1c(HbA1c)12.0% ,胰岛自身抗体阴性,诊断为"糖尿病,糖尿病酮症",强化降糖后应用门冬胰岛素30早10 U晚8 U皮下注射,联合沙格列汀5 mg,每日1次,及阿卡波糖50 mg,每日3次控制血糖,血糖控制一般,伴视物模糊、尿泡沫增多、四肢麻木。为进一步明确诊断并调整血糖来院就诊。患者有糖尿病视网膜病变、糖尿病肾病及周围神经病变病史,出生发育史正常,母亲无妊娠期高血糖,无糖尿病家族史,已婚未育。查体:体重指数(BMI)20.47 kg/m2,无胰岛素抵抗体征(表1)。应用MODY概率计算器(MODY probability calculator, MPC)[1]计算阳性预测值(PPV)为4.9%,基因测序发现HNF1α基因存在致病突变(图1及表2),既往已有文献报道,为热点突变[2]。患者有眼科手术指征,继续应用胰岛素降糖治疗,随访期间因糖尿病视网膜病变于外院多次行手术治疗,复查HbA1c 4.8%,无心慌、多汗等低血糖表现,在当地医师指导下调整胰岛素剂量。
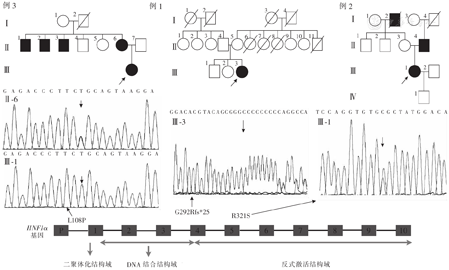

注:箭头表示先证者;圆圈表示女性,方框表示男性,空心框表示血糖正常,实心框表示临床诊断糖尿病,斜杠为去世个体,例3中Ⅲ-1及Ⅱ-6存在相同突变。例1~3突变分别位于第4外显子、第5外显子、第1外显子编码区
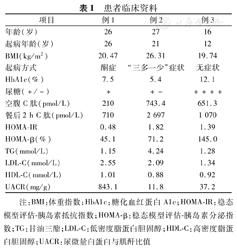
患者临床资料
患者临床资料
| 项目 | 例1 | 例2 | 例3 |
|---|---|---|---|
| 年龄(岁) | 26 | 27 | 16 |
| 起病年龄(岁) | 26 | 21 | 12 |
| BMI(kg/m2) | 20.47 | 26.31 | 19.74 |
| 起病方式 | 酮症 | "三多一少"症状 | 无症状 |
| HbA1c(%) | 7.5 | 5.4 | 12.1 |
| 尿糖(+/-) | + | +- | ++++ |
| 空腹C肽(pmol/L) | 210 | 743.4 | 651.3 |
| 餐后2 h C肽(pmol/L) | 710 | 2 697 | 1 070 |
| HOMA-IR | 0.48 | 1.82 | 1.39 |
| HOMA-β(%) | 45.1 | 71.2 | 145.0 |
| TG(mmol/L) | 1.15 | 4.24 | 1.28 |
| LDL-C(mmol/L) | 2.55 | 2.09 | 1.34 |
| HDL-C(mmol/L) | 1.01 | 0.88 | 0.92 |
| UACR(mg/g) | 843.1 | 11.8 | 37.2 |
注:BMI:体重指数;HbA1c:糖化血红蛋白A1c;HOMA-IR:稳态模型评估-胰岛素抵抗指数;HOMA-β:稳态模型评估-胰岛素分泌指数;TG:甘油三酯;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇;UACR:尿微量白蛋白与肌酐比值
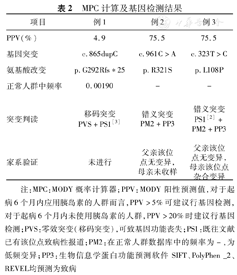
MPC计算及基因检测结果
MPC计算及基因检测结果
| 项目 | 例1 | 例2 | 例3 |
|---|---|---|---|
| PPV(%) | 4.9 | 75.5 | 75.5 |
| 基因突变 | c.865dupC | c.961C>A | c.323T>C |
| 氨基酸改变 | p.G292Rfs*25 | p.R321S | p.L108P |
| 正常人群中频率 | 0.00190 | - | - |
| 突变判读 | 移码突变PVS+PS1[3] | 错义突变PM2+PP3 | 错义突变PS1[2]+PM2+PP3 |
| 家系验证 | 未进行 | 父亲该位点无变异,母亲未收样 | 父亲该位点无变异,母亲该位点杂合变异 |
注:MPC:MODY概率计算器;PPV:MODY阳性预测值,对于起病6个月内应用胰岛素的人群而言,PPV>5%可建议行基因检测,对于起病6个月内未使用胰岛素的人群,PPV>20%时建议行基因检测;PVS:零效突变(移码突变),可致基因功能丧失;PS1:既往文献已有该位点致病性报道;PM2:在正常人群数据库中的频率为-,为低频变异;PP3:生物信息学蛋白功能预测软件SIFT、PolyPhen _2、REVEL均预测为致病
病例2:女性,27岁,因"口干、多饮、多尿6年"于2019年3月13日门诊就诊。患者6年前因口干、多饮、多尿症状于当地医院就诊,测空腹血糖8.72 mmol/L,餐后2 h血糖14 mmol/L,HbA1c 5.9%,胰岛自身抗体阴性。诊断为"2型糖尿病",初予以二甲双胍0.5g,每日3次降糖,血糖控制不佳,后改为四针方案(具体不详)。为进一步调整血糖来医院就诊。患者已婚已育,既往有脂肪肝病史,父亲及外祖父有糖尿病,患者父亲45岁时诊断为2型糖尿病,体型超重(BMI 26.26 kg/m2),通过饮食及运动降糖,测HbA1c 5.9%,空腹C肽1 793 pmol/L,餐后2 h C肽6 514 pmol/L,合并高甘油三酯(TG)血症(TG 9.01 mmol/L)。查体:BMI 26.31 kg/m2,腰围80 cm,臀围92 cm,无胰岛素抵抗体征。应用MPC计算PPV为75.5%,基因测序发现患者HNF1α基因存在致病突变,父亲突变阴性。调整降糖方案为格列齐特60 mg,每日1次联合二甲双胍1.0 g,每日2次,半年后随访空腹C肽1 269 pmol/L,餐后2 h C肽2 233 pmol/L,HbA1c 6.1%,随访期间未发生低血糖事件及糖尿病并发症,BMI及TG均较前降低。
病例3:女性,16岁,因"体检发现血糖升高4年"于2019年1月16日入院。患者4年前体检时发现空腹血糖10 mmol/L,当地医院查HbA1c 12.1%,胰岛自身抗体阴性,诊断"糖尿病",予以胰岛素降糖(具体不详),后家属自行调整为二甲双胍0.25 g,每日3次降糖,血糖未监测。复查空腹血糖10.73 mmol/L,HbA1c 12.3%,为进一步调整血糖住院治疗。患者母亲、舅舅及表哥均有糖尿病,患者母亲体型偏瘦(BMI 18.8 kg/m2),43岁时诊断糖尿病,口服二甲双胍降糖,HbA1c 6.5%,有高脂血症及席汉综合征,应用他汀类药物调脂、激素替代治疗。查体:BMI 19.74 kg/m2,腰围73 cm,臀围91 cm,无胰岛素抵抗体征。应用MPC计算患者PPV为75.5%,基因测序发现患者HNF1α基因突变,母亲存在相同杂合突变。严密血糖监测下调整治疗为格列齐特30 mg,每日1次口服,动态血糖监测葡萄糖平均值8.3 mmol/L,标准差2.5 mmol/L,变异系数30.2%,无低血糖事件,平均葡萄糖波动幅度(MAGE)为6.4 mmol/L。予以加强饮食及运动指导。
HNF1α基因位于染色体12q24.2,其基因突变分布于启动子及10个外显子区,大部分(83%)突变位于外显子1~6[4]。目前认为HNF1α基因突变通过单倍体不足及显性负效应导致HNF1α-MODY的发生,其中前者可能是导致MODY发生的主要原因[5]。HNF1α突变不仅可导致β细胞增殖减少,还能影响葡萄糖转运、糖酵解以及葡萄糖刺激的ATP产生,进而影响ATP敏感的钾离子通道开放,导致细胞膜去极化减弱,电压门控钙离子通道开放受到影响,最终干扰胰岛素分泌,导致MODY的发生[6,7]。目前已存在超过1 200个家庭的400多个HNF1α基因突变[8],白种人中较常见,亚洲人群相对少见。本文报道的例1及例3患者HNF1α基因突变既往已有文献报道,其中例1患者c.865dupC为热点突变,在HNF1α突变中最为常见[2],且易产生自发突变,中国一项研究中该突变占HNF1α基因突变的37.5%[9]。例2患者突变c.961C>A既往未见报道,患者父亲该位点未发生突变。
患者临床特征呈现较大差异,考虑与既往治疗、病程、基因突变的位置及类型有关。3例患者既往治疗方式不一,血糖控制情况与糖尿病病程影响了高糖毒性作用时间,但其中病程最短(1年)的患者胰岛功能较差,糖尿病并发症较多,其临床异质性可能与基因突变的位置及类型关系更密切。在起病方式上,约25%的HNF1α-MODY患者初期可出现典型的"三多一少"症状,但大多数患者无上述临床表现,仅出现餐后血糖升高[10],通常不伴有酮症。本文报道的例1患者以酮症起病,这可能与HNF1α基因下调胰岛β细胞对葡萄糖转运蛋白-2、L-丙酮酸激酶、醛缩酶B、α-酮戊二酸脱氢酶及线粒体解耦联蛋白1等蛋白表达,引起糖利用障碍及生酮增加有关[11]。此外,治疗不当且依从性较差的个体也可能会发生酮症酸中毒[12]。研究提示,起病时有临床症状的个体,血糖、HbA1c及BMI水平更高,高密度脂蛋白-胆固醇(HDL-C)水平更低,且在较短病程后使用胰岛素的频率更高[10]。在诊断年龄方面,HNF1α突变的遗传外显率高,63%的携带者发病年龄小于25岁[8]。影响二聚体化结构域或DNA结合结构域的突变患者起病年龄较低,截短突变较错义突变患者起病年龄更低[4];而宫内暴露(突变由母亲遗传且存在妊娠期高血糖)可导致起病年龄提前约12年[13]。本文报道的患者起病年龄12~26岁不等,例3患者起病年龄最早,12岁起病,其HNF1α基因的二聚体化结构域发生了错义突变c.323T>C,患者母亲存在相同突变。在家族史方面,作为常染色显性遗传病,MODY患者通常有明确的糖尿病家族史,数据提示MODY患者有家族史的概率比1型糖尿病(T1DM)高20倍以上,部分MODY患者可能无糖尿病家族史,考虑可能与以下因素有关:(1)HNF1α-MODY新发突变的概率可能比预期更频繁[14]。(2)患者家属因临床症状及体征轻微未引起重视,暂未诊断糖尿病。本文报道的例1患者无明确的糖尿病家族史,且年轻起病、胰岛功能较差、酮症起病、体型瘦弱等临床表现与T1DM有重叠,为诊断带来了一些挑战。因此,临床上对于无糖尿病家族史、临床表现不典型的"T1DM患者",仍需考虑到MODY的可能性。此外,超重和肥胖的流行也为MODY的诊断带来了一定的挑战,可以出现在任何糖尿病类型中[15],MODY亦不例外,例2患者即表现为超重,BMI 26.31 kg/m2。因此,超重、肥胖、胰岛素抵抗均不能作为MODY的排除条件。
HNF1α-MODY患者胰岛功能较正常人群稍差,但其胰岛功能下降是进行性的,部分患者可出现严重的胰岛素分泌衰竭,例1患者在诊断时已出现胰岛功能明显衰竭,空腹C肽仅210 pmol/L,其严重临床表型考虑与以下因素相关:(1)患者基因突变为零效突变,蛋白功能丧失。(2)患者诊断时间滞后,未及时诊治导致其长时间高血糖水平,葡萄糖毒性进一步促进了胰岛功能衰退。HNF1α突变可引起近端肾小管重吸收葡萄糖减少,肾脏葡萄糖阈值降低,进而出现尿糖阳性,且常早于β细胞胰岛素分泌缺陷[2],3例患者均出现不同程度的尿糖阳性。HNF1α-MODY患者通常伴有低超敏C反应蛋白(hs-CRP)、低载脂蛋白M水平以及低HDL-C水平,但在部分患者,由于同时存在炎性反应或代谢异常,这些经典表现可能不存在[15,16],本文报道的3例患者HDL-C水平均偏低,而例2患者甚至合并高甘油三酯血症。在并发症方面,HNF1α-MODY患者微血管并发症的发生频率与T1DM及2型糖尿病(T2DM)患者相似,例1患者已出现严重糖尿病视网膜病变、糖尿病肾病、糖尿病周围神经病变等并发症。尽早明确诊断,及时采取合理治疗,对血糖控制、延缓并发症的发生发展、改善生活质量十分重要。
在治疗方面,HNF1α-MODY患者大多对低剂量磺脲类药物敏感,例3患者单用格列齐特降糖,例2患者体型超重,应用格列齐特联合二甲双胍降糖,血糖均较前平稳,例1患者因胰岛功能衰竭及手术需求未停用胰岛素治疗。非磺脲类促泌剂对HNF1α-MODY患者也有较好的降糖作用且低血糖风险更低,胰高血糖素样肽-1(GLP-1)受体激动剂及二肽基肽酶-4(DPP-4)抑制剂对HNF1α-MODY患者降糖效果尚可且不增加低血糖事件,钠-葡萄糖协同转运蛋白2(SGLT-2)抑制剂由于其不依赖胰岛素的降糖作用,也可用于HNF1α-MODY患者的联合治疗[17]。部分突变患者可呈现出非典型的药物反应,携带c.1522G>A, c.618G>A及c.376C>G突变的患者对磺脲类药物敏感性较差[18,19,20]。因此,对新发突变患者进行磺脲类药物转化治疗需在严密血糖监测下进行,对磺脲类药物进行次数调整和剂量滴定后如仍出现低血糖现象,可考虑应用非磺脲类短效促泌剂治疗。对于合并超重、脂代谢异常、饮食控制较困难的患者,在治疗方案中保留磺脲类药物的同时,可以考虑联用二甲双胍、GLP-1受体激动剂及DPP-4抑制剂、SGLT-2抑制剂等降糖药物。而对于胰岛功能较差、临床表型偏向T1DM,尤其是有手术需求的患者,不建议停用胰岛素治疗。由于HNF1α-MODY患者胰岛功能进行性减退,随着病程进展,最终需应用胰岛素。尽管考虑患者临床特点及转归的差异与突变位置及类型有关,其影响仍需进一步完善功能试验,尚不能指导具体治疗。鉴于HNF1α-MODY发病人数较少,目前药物治疗经验仍不充足,有待相关研究进一步探讨。
MODY是异质性疾病,同一MODY亚型因突变基因不同,在临床特征及治疗转归上可表现出巨大差异,部分患者表现为非典型症状,这不仅给MODY的诊断带来一定挑战,也要求在治疗上更加注重个体化。
所有作者均声明不存在利益冲突


























