
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
高钙血症是内科急症,如发生高血钙危象(血清钙>4 mmol/L)而未及时诊治,死亡率高达50%[1]。高钙血症的原因很多,而慢性痛风患者由于长期卧床发生高钙血症者并不多见。现将天津医科大学朱宪彝纪念医院痛风科诊治的1例痛风慢性期患者,因关节疼痛,肢体活动障碍,卧床3个月,并不当服用非甾体消炎药(NSAIDS)出现高钙血症及急性肾功能衰竭,报道如下。
杨某某,男,61岁,主因"间断单关节肿痛10余年,加重3个月"于2019.07.21—08.01住院治疗。
患者10余年前饮酒、高嘌呤饮食后出现左足背红、肿、热、痛,活动障碍,24 h达高峰,于当地卫生所诊断为痛风,予以双氯芬酸钠对症治疗,约2 d后缓解。以后每年发作1~2次,诱因均为饮酒、高嘌呤饮食,逐渐累及双足第一跖趾关节、双足背、双踝关节、双膝关节、双腕关节、双肘关节、双手掌指关节。急性期自行服用双氯芬酸钠治疗,2~3 d缓解后停药。缓解期间断服用别嘌醇,每次数天。7年前双足、双手逐渐出现痛风结节。近1年关节疼痛发作频繁,2~3个月发作1次,活动较前明显减少。半年前曾测血肌酐104 μmol/L,3个月前再次因饮酒后出现多关节疼痛,伴有肢体活动受限,自行服用双氯芬酸钠,症状不缓解。2周前自觉双下肢无力,食欲差,于当地医院就诊,查血尿酸729 μmol/L,血肌酐238 μmol/L,给予艾瑞昔布止痛,非布司他降尿酸治疗,症状缓解不明显,疼痛明显时自服双氯芬酸钠2片治疗,每日最大剂量8~10片。患者近3个月因肢体无力,基本为卧床状态,体重下降大约3 kg。既往高血压8年,最高达180/120 mmHg(1 mmHg=0.133 kPa),应用替米沙坦、氨氯地平治疗,血压控制在130/80 mmHg。饮酒史40年,平均白酒400~750 g,近1年每日200 g。吸烟40年,每日30支。母亲死于心脏病,父亲患有糖尿病,死于脑梗死。1弟1姐患有痛风。
查体:神清,血压130/80 mmHg,坐轮椅入病房,被动体位,痛苦面容。皮肤、黏膜无色素沉着,眉毛无稀疏脱落,双侧甲状腺无肿大,无血管杂音。双肺呼吸音清,心率92次/min,律齐,未闻及病理性杂音,腹软,肝、脾未及,双足背动脉搏动可。左足第一跖趾关节可见约5 cm痛风结节,左足第五跖趾关节、右足第一跖趾关节、右足背可见约2 cm痛风结节。双下肢不肿,四肢皮肤弹性差,肌肉轻度萎缩,双上肢肌力Ⅳ级,双下肢肌力Ⅲ级,肌张力正常,双侧感觉无减弱或增强,生理性反射存在,病理性反射未引出,双踝关节、双膝关节、双肘关节、双腕关节皮温略高,活动受限。
入院后完善电解质、肝功能、肾功能、离子系列、血常规检查,血钙4.23 mmol/L、血磷2.02 mmol/L、尿素氮(BUN)28.69 mmol/L、肌酐381.6 μmol/L、血尿酸(SUA)462.6 μmol/L、碱性磷酸酶(ALP)465.9 U/L、谷丙转氨酶(ALT)17.7 U/L、谷草转氨酶(AST)20.2 U/L、甲状旁腺激素(PTH) 1.67 pmol/L (正常值1.6~6.9 pmol/L)、降钙素9.09 ng/L (正常值0~9.52 ng/L)、血尿轻链、尿蛋白电泳、肿瘤标志物8项、甲状腺功能均为正常。随机尿生化:N-乙酰基葡糖苷酶29.8 U/L(正常值0.3~12 U/L),视黄醇结合蛋白1.03 mg/L(正常值0.0~0.7 mg/L),尿转铁蛋白3.93 mg/L,β2微球蛋白1.06 mg/L(正常值0.0~0.3 mg/L),尿微量白蛋白50.4 mg/24 h(正常值0~30 mg/24 h)。尿常规:pH 5.0,尿比重1.025,白细胞30.8/μl,红细胞13.9/μl。辅助检查:双足能谱CT检查示双足多发尿酸盐沉积,多发骨吸收、破坏,伴软组织内多发结节。头颅CT示右侧基底节脑干腔隙灶,脑白质稀疏。超声心动图显示主动脉硬化,左房增大,左室舒张功能减低。腹部B超:肝、胆、胰、脾、双肾正常,甲状腺无异常。下肢动脉彩超:双下肢动脉硬化,部分血管血流速减慢。诊断为慢性痛风石性痛风、痛风性关节炎、痛风结节、急性肾损伤(AKI)、高钙血症、陈旧性脑梗死。入院后停用一切NSAIDS,给予地塞米松抗炎止痛,补液水化,速尿促进钙的排泄,非布司他降尿酸以及改善循环治疗,患者疼痛逐渐缓解,血尿酸、血肌酐、血钙平稳下降。出院时血钙下降到2.72 mmol/L,关节疼痛减轻,肌无力缓解,食欲有所改善。出院后继续给予非布司他降尿酸治疗,甲基强的松龙抗炎止痛、预防痛风急性发作,包醛氧淀粉口服促进含氮物质的排泄。2个月后血肌酐下降到110.34 μmol/L,血钙2.62 mmol/L,患者可下床轻度活动,食欲改善,体重增加2.5 kg。患者肝功能、肾功能、血钙、血磷、尿钙及尿磷、尿常规以及血常规的变化见表1、表2。
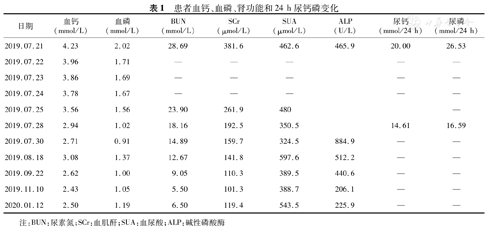
患者血钙、血磷、肾功能和24 h尿钙磷变化
患者血钙、血磷、肾功能和24 h尿钙磷变化
| 日期 | 血钙(mmol/L) | 血磷(mmol/L) | BUN(mmol/L) | SCr(μmol/L) | SUA(μmol/L) | ALP (U/L) | 尿钙(mmol/24 h) | 尿磷(mmol/24 h) |
|---|---|---|---|---|---|---|---|---|
| 2019.07.21 | 4.23 | 2.02 | 28.69 | 381.6 | 462.6 | 465.9 | 20.00 | 26.53 |
| 2019.07.22 | 3.96 | 1.71 | — | — | — | — | — | |
| 2019.07.23 | 3.86 | 1.69 | — | — | — | — | — | |
| 2019.07.24 | 3.78 | 1.67 | — | — | — | — | — | |
| 2019.07.25 | 3.56 | 1.56 | 23.90 | 261.9 | 480 | — | ||
| 2019.07.28 | 2.94 | 1.02 | 18.16 | 192.5 | 350.5 | 14.61 | 16.59 | |
| 2019.07.30 | 2.71 | 0.91 | 14.89 | 159.7 | 324.5 | 884.9 | — | — |
| 2019.08.18 | 3.08 | 1.37 | 12.67 | 141.8 | 597.6 | 512.2 | — | — |
| 2019.09.22 | 2.62 | 1.00 | 9.05 | 110.3 | 389.5 | 440.6 | — | — |
| 2019.11.10 | 2.43 | 1.05 | 5.50 | 101.3 | 388.7 | 206.1 | — | — |
| 2020.01.12 | 2.50 | 1.19 | 6.50 | 119.4 | 543.5 | 225.9 | — | — |
注:BUN:尿素氮;SCr:血肌酐;SUA:血尿酸;ALP:碱性磷酸酶
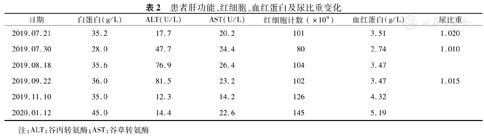
患者肝功能、红细胞、血红蛋白及尿比重变化
患者肝功能、红细胞、血红蛋白及尿比重变化
| 日期 | 白蛋白(g/L) | ALT(U/L) | AST(U/L) | 红细胞计数(×109) | 血红蛋白(g/L) | 尿比重 |
|---|---|---|---|---|---|---|
| 2019.07.21 | 35.2 | 17.7 | 20.2 | 101 | 3.51 | 1.020 |
| 2019.07.30 | 28.0 | 47.7 | 24.4 | 80 | 2.74 | 1.010 |
| 2019.08.18 | 35.6 | 76.9 | 26.4 | 104 | 3.47 | |
| 2019.09.22 | 36.0 | 81.5 | 23.2 | 102 | 3.47 | 1.015 |
| 2019.11.10 | 35.0 | 12.3 | 14.2 | 126 | 4.32 | |
| 2020.01.12 | 45.0 | 14.4 | 22.6 | 145 | 5.19 |
注:ALT:谷丙转氨酶;AST:谷草转氨酶
高钙血症是内科常见的疾病,根据引起高钙血症的原因主要有甲状旁腺相关性、恶性肿瘤相关性、维生素D相关性和高骨转化相关性等[2]。
本例患者血PTH正常低值,降钙素正常,甲状腺B超未发现异常,24 h尿钙明显升高,提示高钙血症导致PTH的抑制,可以排除原发性、继发性、异位以及散发性甲状旁腺功能亢进症导致的甲状旁腺相关性高钙血症。肿瘤标志物、蛋白电泳、血尿轻链κ和轻链λ定量均在正常范围,胸部X线片,骨X线片、腹部B超均未发现异常,不考虑恶性肿瘤或多发性骨髓瘤等肿瘤相关性高钙血症。无结核、肺结节病史,实验室及器械检查未发现结核病、结节病的征象,可以排除结核、肺结节;患者无维生素D摄入史,暂不考虑维生素D相关性高钙血症。高骨转换相关性高钙血症常见于甲状腺功能亢进症、噻嗪类利尿剂及维生素A中毒、肢体制动。患者无甲状腺功能亢进症的病史、症状、体征,甲状腺功能正常,无利尿剂和维生素A使用史,可以排除。患者有10余年痛风病史,已发展到慢性痛风性关节炎,近3个月关节疼痛加重,肢体活动受限,一直处于卧床状态,食欲减退,体重下降,血ALP明显升高,肝功正常,提示骨吸收活跃。因此,考虑此患者高钙血症与长期制动有关。在机体制动的状态下,骨骼机械应力下降,骨形成与骨破坏失耦联,骨破坏大于骨形成,骨钙释放入血。钙主要经肾脏排泄,当肾脏排泄钙的能力不足以代偿释放入血的钙时,就会导致高钙血症的发生[3]。本例患者2次24 h尿钙检查明显高于正常值,入院检查发现血钙显著升高,提示肾脏对钙排泄呈代偿性增多。詹魁骏等[4]报道1例长期卧床导致高钙血症的患者,患者因腰椎骨折,术后卧床1个月,出现高钙血症症状,经给予密钙息、神经内科治疗以及其他对症支持治疗,酸碱失衡纠正,血钙恢复正常。Stewart等[5]横断面研究显示,合并足部或踝关节痛风石的患者,其肌肉力量明显降低,也是发生肌肉萎缩的一个原因。而肌肉是维持骨骼应力的一个重要因素,肌肉力量的减弱加重骨钙流失。Yusuf等[6]发现,随制动时间的延长,患者的平均血钙水平会逐渐升高,而且在第3周时达高峰,而非制动患者的平均血钙水平无明显变化。制动患者高钙血症的发生率也随着制动时间的延长而逐渐升高,在第4周时高钙血症的发生率可高达29.09%,而非制动性患者中无此变化。本例患者由于痛风发作,关节疼痛导致长达3个月的卧床状态,因此导致废用性肌肉的萎缩,骨应力减小,骨转化增强,血ALP显著升高,骨钙流失,血钙升高,该患者入院前出现乏力、纳差等症状,考虑为高血钙导致胃肠道平滑肌蠕动减慢所引起的消化系统表现;之后出现下肢无力,肌肉进一步萎缩,提示高血钙进一步累及神经、肌肉系统。
高钙血症可以导致AKI,严重者甚至可引起致死性肾功能衰竭。高钙血症是急诊患者死亡的独立危险因素[7,8],持续高钙血症在短期内即可引起肾组织学结构的改变,主要累及髓襻升支、远端肾小管和集合管,引起AKI。
高钙血症导致肾损伤的特点是尿浓缩功能损害和肾小球滤过率的下降,急剧发生的高钙血症以肾功能损害为主,称为高钙血症肾病,常表现为可逆的过程。急剧发生重症高钙血症可引发高钙血症性肾危象,表现为以急性肾小管坏死为特征的急性肾衰竭。慢性高钙血症造成的肾损害则表现为伴有肾实质内钙沉积的肾小管功能损害,肾小球滤过率进行性下降[9]。本例患者表现为高钙血症伴AKI,经适当治疗后,当血钙水平逐渐下降为正常时,血肌酐水平也逐渐下降,符合高钙血症肾病的可逆性变化过程。
此外,本患者近期有超剂量服用NSAIDS的病史,而此药具有抗炎、抗风湿、止痛、退热、抗凝等作用,广泛应用于类风湿性关节炎、骨关节炎等疾病治疗当中,抗炎效果理想。但是很多研究者指出NSAIDS不良反应发生率高,可引发消化道、肾脏以及心血管等不良反应,影响治疗效果,甚至威胁患者的生命安全,其中AKI是NSAIDS比较常见的不良反应[10]。
高龄和潜在肾脏疾病史是NSAIDS导致AKI的主要危险因素。有研究表明,原有肾脏疾病者比无肾脏疾病者发生AKI的风险增加3~4倍[11]。Zhang等[12]荟萃分析显示,一般人群NSAIDS导致AKI的风险为1.73倍(95% CI :1.44~2.07),而老年人为2.51倍(95% CI :1.52~2.68),存在慢性肾脏疾病的患者发生AKI的风险为1.63(95% CI :1.72~2.19)。
NSAIDS抗炎的主要作用机制为抑制环氧化酶活性,阻断花生四烯酸生成前列腺素E2、前列环素和血栓素。因此NSAIDS可能通过以下机制导致AKI的发生:(1)NSAIDS导致前列腺素E2的产生减少,使肾血管收缩,从而降低肾脏血流量。(2)NSAIDS晶体沉积导致肾小管阻塞。(3)NSAIDS诱发细胞毒性导致细胞介导的免疫机制导致肾脏间质或基底膜损伤的发生[13,14]。以上病理机制导致肾脏缺血,肾血流量下降,肾小管的坏死以及肾小球的内压升高,从而出现AKI。因此不排除NSAIDS在本例患者AKI发生、发展中也起到一定的作用。NSAIDS导致的AKI大部分患者肾功能可以恢复到AKI前的水平,但亦有以少部分患者发展成慢性肾功能不全,血肌酐逐渐升高。本患者入院后经停用NSAIDS,给予糖皮质激素抗炎、止痛、水化、利尿降血钙等综合治疗,2个月后患者肾功能逐渐恢复到发病前水平,推测AKI的发生为高钙血症和NSAIDS共同作用的结果。
总之,本例患者由于痛风、痛风石导致关节疼痛,肢体长期活动受限,肌肉萎缩,从而出现制动性高钙血症,再加上长期不当服用NSAIDS,共同导致AKI,因此,对于存在骨骼肌肉疾病的患者及长期活动受限者,应注意血钙的检测,及早发现,以免发生意外;同时合理使用NSAIDS,以免造成肾脏的损伤
所有作者均声明不存在利益冲突


























