
分析新型冠状病毒肺炎(简称新冠肺炎)并发气胸患者的临床特点及预后。
回顾性分析黄冈市中心医院2020年1月3日至3月10日收治的7例新冠肺炎并发气胸患者的临床资料,总结临床特点和诊疗情况,分享新冠肺炎的治疗经验。
①一般资料:7例患者中男性5例,女性2例。其中4例无任何基础疾病,1例有糖尿病和高血压病史;1例仅有高血压病史。发生右侧气胸6例,双侧气胸1例。7例患者住院时间较长,均超过4周,且多合并多器官功能不全。②影像学检查:1例在1周内从早期演变为进展期,2周内演变为重症期,4周后并发气胸,2周内气胸吸收;其余6例入院时即表现为进展期,均在1~2周内进展为重症期,多表现为双肺弥漫性实变影、条索影及纤维化,胸膜粘连明显,病灶吸收极缓慢。③治疗:1例重型患者发病4周后并发气胸,给予无创呼吸机辅助通气治疗;其余6例危重型患者给予气管插管机械通气治疗,机械通气到发生气胸时间在3 d内的有5例,11 d后发生的有1例。④转归:未气管插管的1例患者持续给予经鼻高流量氧疗,病情平稳。6例气管插管后并发气胸患者死亡4例,另2例均在胸腔闭式引流2周内成功拔除引流管,病情逐渐稳定。
新冠肺炎并发气胸病情凶险且预后差,应予以足够的重视。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
本院于2020年1月3日开始收治新型冠状病毒肺炎(简称新冠肺炎)患者,至2020年1月22日开始发现有并发气胸的案例出现,现总结确诊为新冠肺炎并发气胸患者的临床特点及诊治情况,报告如下。
2020年1月3日至3月10日本院收治并确诊新冠肺炎并发自发性气胸患者7例,其中男性5例,女性2例;右侧气胸6例,双侧气胸1例;4例无任何基础疾病,1例有糖尿病和高血压病史,1例仅有高血压病史。1例患者发病1 d即入院治疗,入院时为轻型,病情逐渐加重转为重型〔新冠肺炎的确诊及分级依据国家卫生健康委员会(卫健委)实时发布的新冠肺炎诊疗试行方案〕,给予无创呼吸机辅助通气治疗,入院后第35天突发右侧气胸;其余6例患者均在发病1周后入院,入院时已是重型,并逐渐进展为危重型,均给予气管插管机械通气治疗。7例患者治疗时间较长(超过4周),复查血常规、降钙素原(PCT)提示有明显的炎症反应,复查血生化及凝血功能指标多提示合并有多器官功能不全(表1)。
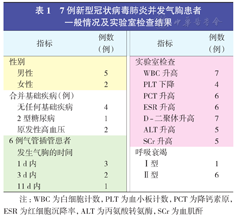
7例新型冠状病毒肺炎并发气胸患者一般情况及实验室检查结果
7例新型冠状病毒肺炎并发气胸患者一般情况及实验室检查结果
| 指标 | 例数(例) | 指标 | 例数(例) | ||
|---|---|---|---|---|---|
| 性别 | 实验室检查 | ||||
| 男性 | 5 | WBC升高 | 7 | ||
| 女性 | 2 | PLT下降 | 4 | ||
| 合并基础疾病(例) | PCT升高 | 6 | |||
| 无任何基础疾病 | 4 | ESR升高 | 6 | ||
| 2型糖尿病 | 1 | D -二聚体升高 | 7 | ||
| 原发性高血压 | 2 | ALT升高 | 5 | ||
| 6例气管插管患者发生气胸的时间 | SCr升高 | 5 | |||
| 呼吸衰竭 | |||||
| 1 d内 | 3 | Ⅰ型 | 1 | ||
| 3 d内 | 2 | Ⅱ型 | 6 | ||
| 11 d内 | 1 | ||||
注:WBC为白细胞计数,PLT为血小板计数,PCT为降钙素原,ESR为红细胞沉降率,ALT为丙氨酸转氨酶,SCr为血肌酐
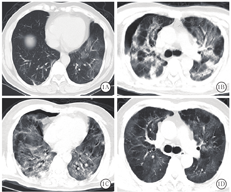
新冠肺炎患者胸部CT表现为:①早期:病变局限,呈斑片状、节段性磨玻璃影,多伴有小叶间隔增厚;②进展期:病灶增多、范围扩大,可累及多个肺叶,部分病灶实变,磨玻璃影与实变影或条索影共存;③重症期:双肺呈弥漫性病变,以实变影为主,合并磨玻璃影,多伴条索影,支气管充气征[1]。本组患者胸部CT显示病灶进展均较快,1例在1周内从早期演变为进展期,2周内演变为重症期,4周后并发气胸,2周后气胸吸收(图1);其余6例患者入院时胸部CT即表现为进展期,均在1~2周内进展为重症期,多表现为双肺弥漫性实变影、条索影及纤维化,胸膜粘连明显,病灶吸收极缓慢(图2)。由于患者病情进展快,病情危重时难以行胸部CT检查,导致影像学资料不齐全。

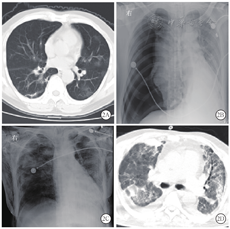

新冠肺炎患者并发气胸时较隐匿,症状不典型,且患者大多处于镇静状态,极易漏诊。1例未行气管插管的患者因剧烈咳嗽后突发心悸、胸闷,行床边胸部影像学检查提示右侧气胸(肺组织压缩20%)。6例行气管插管机械通气治疗的危重型患者气道压均控制在30 cmH2O(1 cmH2O=0.098 kPa)内。发生气胸前,2例患者镇静程度较浅,出现烦躁不安,人机对抗明显;其余4例处于镇静状态,发生气胸时并无明显诱因。发生气胸后患者病情突然变化,血氧饱和度进行性下降,自主呼吸与机械呼吸不合拍,潮气量下降至200 mL以下,难以升至300 mL,呼吸频率加快,随后患侧逐渐出现头颈部及胸壁皮下气肿,触诊有捻发感,叩诊呈鼓音,其中3例患者很快出现心率减慢,血压下降。气管插管后发生气胸时间在3 d内5例,11 d后发生有1例(表1)。
本组患者病情危重,难以外出进行胸部CT检查,且新冠肺炎为传染性疾病,病区较多且分散,难以做到每个病区配备床边数字化X线摄影(DR)机,故6例患者中仅2例及时行胸部X线检查,提示大量气胸1例;1例行床旁肺部超声检查,提示右侧胸腔无胸膜滑动征,M超下呈条码征,未找到"P"点,考虑诊断为大量气胸;其余3例借助5 mL注射器诊断性穿刺帮助诊断(表2)。
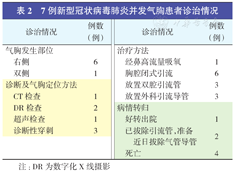
7例新型冠状病毒肺炎并发气胸患者诊治情况
7例新型冠状病毒肺炎并发气胸患者诊治情况
| 诊治情况 | 例数(例) | 诊治情况 | 例数(例) | ||
|---|---|---|---|---|---|
| 气胸发生部位 | 治疗方法 | ||||
| 右侧 | 6 | 经鼻高流量吸氧 | 1 | ||
| 双侧 | 1 | 胸腔闭式引流 | 6 | ||
| 诊断及气胸定位方法 | 放置双腔引流管 | 3 | |||
| CT检查 | 1 | 放置外科引流导管 | 3 | ||
| DR检查 | 2 | 病情转归 | |||
| 超声检查 | 1 | 好转出院 | 1 | ||
| 诊断性穿刺 | 3 | 已拔除引流管,准备近日拔除气管导管 | 2 | ||
| 死亡 | 4 | ||||
注:DR为数字化X线摄影
未行气管插管的1例患者气胸量少,病情稳定,继续给予经鼻高流量氧疗;其余6例患者均行气管插管正压通气,为防止张力性气胸的发生,无论气胸量多少均行胸腔闭式引流治疗。1例经超声检查粗略定位,2例经胸部DR检查定位,其余3例未进行相关影像学检查,而是结合诊断性穿刺(常规穿刺部位选择右侧第2肋间锁骨中线)后置入双腔引流管,导管接水封瓶,见气泡冒出并予以固定。置入引流管后,患者症状有所缓解,其中3例因气体引流不充分,遂用手术刀作一横切口后,以血管钳钝性分离肌层,置入28号胸腔引流管,接胸腔引流瓶,引出大量气体后症状才得以缓解。1例双侧气胸患者,在右侧胸腔置入引流管后症状缓解不明显,左侧胸腔再次置入引流管,气道阻力才逐渐下降,潮气量及血氧饱和度逐渐上升。
未行气管插管的1例患者持续给予经鼻高流量氧疗,病情平稳。6例气管插管后并发气胸患者死亡4例,另2例均在胸腔闭式引流2周内成功拔除引流管,病情逐渐稳定。
本组新冠肺炎并发气胸患者均为重型或危重型,病情进展迅速。特别是6例危重型患者,入院就诊时间晚(发病1周后入院),入院时即为重型,给予积极抗病毒、抗感染、提高免疫等综合治疗,病情进行性进展,逐渐转为危重型;患者住院治疗时间长(均超过4周),最长者超过8周,检查血常规提示白细胞计数(WBC)、中性粒细胞比例及PCT呈进行性升高,提示肺部炎症反应加重。研究表明,新冠肺炎患者可出现细胞因子水平升高,并与疾病严重程度呈正相关,可能与患者存在免疫失衡及其导致的细胞因子释放综合征有关[2]。新冠肺炎患者过度的炎症反应、细胞因子大量释放引起的"细胞因子风暴"是转向危重症的重要转折点[3]。肺泡组织内会出现大量炎性渗出物和随后出现的间质纤维化,患者逐渐出现呼吸困难。患者血气分析提示前期均为Ⅰ型呼吸衰竭,后期为Ⅱ型呼吸衰竭,但患者咳痰量少,可能是气道内大量的黏液难以排出致通气功能障碍。前期肺部出现典型磨玻璃影、浸润影和(或)实变影;后期胸部CT表现为实变影、斑片影、条索影及纤维化,肺部病变广泛,胸膜粘连明显。在严重的肺部炎症反应下,大量痰栓堵塞小气道,广泛的肺纤维化,在剧烈咳嗽或在呼吸机正压通气下容易并发气胸,特别是在人机对抗明显时容易发生[4]。本组6例气管插管患者在机械通气3 d内发生气胸5例,考虑气胸与正压通气有关。
危重型新冠肺炎患者常并发急性呼吸窘迫综合征(ARDS),病情进展迅速,机械通气是目前最主要的抢救措施,因患者肺部病变部位分布不均匀,肺泡压力控制不良,有引发气压伤、容积伤、萎陷伤和生物伤等呼吸机相关性肺损伤的风险[5]。临床医生在使用呼吸机时出于对肺的保护意识,往往采用小潮气量高呼气末正压(PEEP)的保护性通气策略,但PEEP调至多高才能既达到治疗目的,又减少肺损伤发生的概率,仍需不断地摸索。
本组6例危重型患者在机械通气后随即给予静脉穿刺置管,3例于右股静脉穿刺,另外3例于右锁骨下静脉穿刺置管。面对传染性疾病患者,操作者均需佩戴面屏、护目镜,因此视线受到一定影响,而且佩戴多层手套触摸静脉敏感性较差,均可增加静脉穿刺损伤周围肺组织或血管的风险[6]和医源性损伤致气胸发生的概率。
危重型新冠肺炎患者并发气胸的风险高,发生气胸后病情迅速恶化,血氧饱和度急剧下降,随时可能威胁患者生命,需及时进行诊断及处理。但危重型患者往往处于镇静状态,不能及时给医生反馈病情,若在不明原因情况下,患者突然出现潮气量及血氧饱和度进行性下降,需考虑并发气胸的可能。气胸的确诊及定位依赖影像学,但在传染病隔离病区内难以做到每个重症监护病房(ICU)都配备有床旁DR机,并发气胸的诊断往往需依赖临床医生的经验和诊断性穿刺。在无影像学检查准确定位的情况下,临床医生常常会选择在常规穿刺点(第2肋间与锁骨中线交点)进行穿刺引流,因此不一定能准确到达气胸发生的具体位置,无法充分引流,疗效差,导致引流管很难拔除[7]。本组1例气胸患者借助床旁超声检查成功诊断及定位。随着超声仪器和技术的不断发展,超声声像图在显示气胸、肺实质病变的同时,还能显示肺泡内气/水比例的变化[8]。相对CT或DR机,超声检查有一定的局限性,但在其他条件不足时,超声检查也可以起到一定作用。
本组6例并发气胸患者行胸腔闭式引流时,3例请外科医生协助,进行手术切口,置入大口径胸腔闭式引流管,引流通畅,迅速缓解了症状且不易堵管,但损伤较大,操作者暴露时间相对长,且接触患者血液较多,容易被感染;另外3例采用双腔引流管,孔径小、创伤小、操作快,但1例出现引流不通畅及堵管的现象。外科手术切口置管还涉及穿刺包消毒的问题,用过的穿刺包应先清洗,然后用含氯消毒液浸泡消毒,再用两层黄色医疗塑料袋包裹,塑料袋表面用酒精喷洒消毒,放置在专用转运箱内送至消毒配置中心,过程繁琐。权衡利弊,采取哪种引流管更合适也是我们需要思考的问题。
新冠肺炎危重症患者预后较差[9],合并气胸后更加凶险,病死率高,而临床表现较为隐匿,需要有临床经验的医生及时观察并掌握病情变化,快速进行抢救。
中国临床试验注册中心,ChiCTR2000031794
Chinese Clinical Trial Registry, ChiCTR2000031794
所有作者均声明不存在利益冲突



























