
探讨早期(入院72 h内)淋巴细胞动态变化与新型冠状病毒肺炎(新冠肺炎)患者病情严重程度的相关性。
采用回顾性研究方法,对2020年1月17日至2月14日温州市中心医院收治的新冠肺炎患者的临床数据进行收集并统计分析。根据入院首日淋巴细胞有无减少〔淋巴细胞计数(LYM)<0.8×109/L为淋巴细胞减少〕、入院第3天与入院首日LYM差值(ΔLYM)是否小于0将患者分为4组:第1组为入院首日LYM正常、ΔLYM≥0;第2组为入院首日LYM正常、ΔLYM<0;第3组为入院首日LYM降低、ΔLYM≥0;第4组为入院首日LYM降低、ΔLYM<0。将新冠肺炎患者入院后30 d内出现重症(包括重型、危重型)作为研究终点。重型、危重型参考我国《新型冠状病毒肺炎诊疗方案(试行第五版修正版)》分型标准。比较4组患者一般资料、实验室相关指标及进展为重型/危重型的差异;采用Cox回归分析早期淋巴细胞动态变化与发生重型/危重型概率的相关性;并绘制Kaplan-Meier生存曲线来评估不同淋巴细胞分组患者发生重型/危重型的情况。
共纳入104例新冠肺炎患者,发病后30 d内进展为重症21例(占20.2%;重型17例,危重型4例)。4组患者间年龄(F=5.061、P=0.003)、入院首日白细胞计数(WBC,Z=10.850、P=0.013)、入院首日C-反应蛋白(CRP,Z=-4.449、P<0.001)、入院首日LYM(Z=43.132、P<0.001)、入院第3天LYM(Z=40.340、P<0.001)、重型/危重型发生情况(χ2=18.645、P<0.001)差异均有统计学意义。第3组和第4组患者年龄较大;第3组入院首日WBC、LYM最低;第4组入院首日CRP最高,入院第3天LYM最低,出现重型/危重型的患者较多。针对入院后30 d内出现重型/危重型的概率,单因素Cox回归分析显示,第4组发生重型/危重型的概率是第1组的12.7倍〔风险比(HR)=12.732,95%可信区间(95%CI)为3.951~41.025,P<0.001〕;将年龄、CRP、白蛋白(ALB)及淋巴细胞分组纳入多因素Cox回归分析显示,第4组发生重型/危重型的概率是第1组的6.4倍(HR=6.398,95%CI为1.757~23.301,P=0.005);而第2组、第3组发生概率与第1组差异均无统计学意义。Kaplan-Meier生存曲线显示,第4组发生重型/危重型的概率显著高于第1、2、3组(Log-Rank检验:χ2=42.617,P<0.001)。
早期淋巴细胞动态变化与新冠肺炎患者病情严重程度相关;入院首日即出现LYM下降且72 h内持续下降的患者发生重型/危重型的概率较高。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
目前国际临床研究及我国新型冠状病毒肺炎(新冠肺炎)诊疗方案均明确指出,部分新冠肺炎患者淋巴细胞减少[1,2,3,4,5]。甚至有临床研究表明淋巴细胞减少的新冠肺炎患者更是高达70.3%,并发现入院后淋巴细胞的动态变化与病情严重程度相关[1]。两项较大型的临床流行病学研究显示,轻型、普通型新冠肺炎患者占81%~84%[6,7],同时也指出若发展至危重型,病死率可达49%[6],故应早期预测患者预后,及时必要干预介入,以降低病死率。本研究旨在探讨新冠肺炎患者入院72 h内淋巴细胞动态变化与病情严重程度是否存在相关性。
选择2020年1月17日至2月14日本院收治的新冠肺炎患者。
呼吸道分泌物样本新型冠状病毒(2019 novel coronavirus,2019-nCoV)核酸检测阳性[2]。
合并除肺部感染以外的其他部位感染;发病前已出现呼吸困难;发病前合并血液系统疾病、凝血功能异常、休克;无入院首日、入院第3天淋巴细胞数据。
本研究符合医学伦理学标准,并经医院伦理委员会审批(审批号:L2020-04-077),所有治疗及检测均获得过患者的知情同意。
收集患者的一般资料、症状体征、入院72 h内的临床指标〔血常规、血气分析、肝肾功能、C-反应蛋白(C-reactive protein,CRP)等实验室参数及胸部CT〕。根据入院首日淋巴细胞有无减少〔淋巴细胞计数(lymphocyte count,LYM)<0.8×109/L为淋巴细胞减少[1]〕、入院第3天与入院首日LYM差值(ΔLYM)是否小于0将患者分为4组。第1组为入院首日LYM正常、ΔLYM≥0;第2组为入院首日LYM正常、ΔLYM<0;第3组为入院首日LYM降低、ΔLYM≥0;第4组为入院首日LYM降低、ΔLYM<0。根据我国《新型冠状病毒肺炎诊疗方案(试行第五版修正版)》分型标准将患者分为轻型、普通型、重型、危重型[2]。重型患者需符合以下情况之一:①呼吸窘迫,呼吸频率≥30次min;②静息状态下,脉搏血氧饱和度≤0.93;③氧合指数(PaO2/FiO2)≤300 mmHg(1 mmHg=0.133 kPa)。危重型患者需符合以下情况之一:①出现呼吸衰竭,且需要机械通气;②出现休克;③合并其他器官功能衰竭需入住重症监护病房(intensive care unit,ICU)治疗。收集新冠肺炎患者发病后30 d内的临床资料,以患者出现重型或危重型作为研究终点,记录重症(重型/危重型)患者入院至出现重症的时间。
使用SPSS 23.0软件进行数据分析。用Shapiro-Wilk检验评估连续变量是否为正态分布,正态分布且方差齐的计量资料以均数±标准差( ±s)表示,采用单因素方差分析和LSD检验;非正态分布或方差不齐的计量资料以中位数(四分位数)〔M(QL,QU)〕表示,采用Kruskal-Wallis或Wilcoxon非参数检验。计数资料以频数或百分比来描述,采用χ2检验或Fisher精确检验。采用单因素Cox回归分析影响新冠肺炎患者出现重型/危重型概率的临床因素,并使用线性回归中的共线性诊断判断各种因素是否存在多重共线,如果最大方差膨胀系数(variance inflation factor,VIF)>10,则多重共线性被认为是显著的。采用单因素及多因素Cox回归分析不同淋巴细胞分组与新冠肺炎患者出现重型/危重型的相关性,并绘制Kaplan-Meier生存曲线(采用Log-Rank检验)。均为双侧检验,P<0.05为差异有统计学意义。
±s)表示,采用单因素方差分析和LSD检验;非正态分布或方差不齐的计量资料以中位数(四分位数)〔M(QL,QU)〕表示,采用Kruskal-Wallis或Wilcoxon非参数检验。计数资料以频数或百分比来描述,采用χ2检验或Fisher精确检验。采用单因素Cox回归分析影响新冠肺炎患者出现重型/危重型概率的临床因素,并使用线性回归中的共线性诊断判断各种因素是否存在多重共线,如果最大方差膨胀系数(variance inflation factor,VIF)>10,则多重共线性被认为是显著的。采用单因素及多因素Cox回归分析不同淋巴细胞分组与新冠肺炎患者出现重型/危重型的相关性,并绘制Kaplan-Meier生存曲线(采用Log-Rank检验)。均为双侧检验,P<0.05为差异有统计学意义。
共纳入新冠肺炎患者104例,其中男性54例,女性50例;平均年龄(45.0±14.1)岁。104例患者发病后30 d内进展为重型17例(16.3%),危重型4例(3.8%)。这21例重型/危重型患者入院至出现重症的中位时间为9(6,13)d。另外,出现肝功能异常(转氨酶高于正常参考值2倍以上)23例,白细胞减少症5例,血小板减少2例,低白蛋白血症4例。截至2020年3月5日,所有患者均已治愈出院,无死亡。
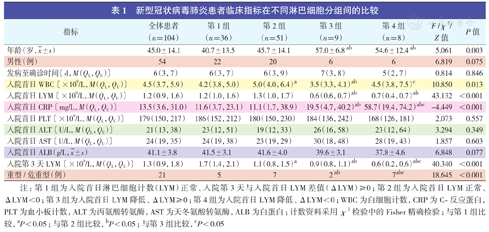
新型冠状病毒肺炎患者临床指标在不同淋巴细胞分组间的比较
新型冠状病毒肺炎患者临床指标在不同淋巴细胞分组间的比较
| 指标 | 全体患者(n=104) | 第1组(n=36) | 第2组(n=51) | 第3组(n=9) | 第4组(n=8) | F /χ2/Z值 | P值 |
|---|---|---|---|---|---|---|---|
年龄(岁, ±s) ±s) | 45.0±14.1 | 40.7±13.5 | 45.7±14.1 | 57.0±6.8 ab | 54.6±12.4 ab | 5.061 | 0.003 |
| 男性(例) | 54 | 22 | 20 | 6 | 6 | 6.819 | 0.075 |
| 发病至确诊时间〔d,M(QL,QU)〕 | 6(3,7) | 6(3,7) | 6(3,9) | 7(3,8) | 5(2,7) | 0.814 | 0.846 |
| 入院首日WBC〔×109/L,M(QL,QU)〕 | 4.5(3.7,5.9) | 4.2(3.8,5.0) | 5.0(4.0,6.4) a | 3.5(3.3,4.1) ab | 4.5(3.8,7.5) c | 10.850 | 0.013 |
| 入院首日LYM〔×109/L,M(QL,QU)〕 | 1.2(0.9,1.6) | 1.2(1.0,1.6) | 1.3(1.0,1.7) | 0.6(0.6,0.7) ab | 0.7(0.4,0.7) ab | 43.132 | <0.001 |
| 入院首日CRP〔mg/L,M(QL,QU)〕 | 13.5(3.6,31.0) | 11.6(3.7,23.1) | 11.1(1.7,38.9) | 19.5(4.7,40.2) ab | 58.7(19.4,74.2) abc | -4.449 | <0.001 |
| 入院首日PLT〔×109/L,M(QL,QU)〕 | 179(150,217) | 186(152,212) | 180(150,230) | 184(136,242) | 168(126,181) | 2.073 | 0.557 |
| 入院首日ALT〔U/L,M(QL,QU)〕 | 21(13,38) | 23(12,51) | 19(12,33) | 26(16,58) | 23(12,64) | 3.294 | 0.349 |
| 入院首日AST〔U/L,M(QL,QU)〕 | 24(19,35) | 24(19,38) | 23(19,29) | 30(18,48) | 28(19,43) | 1.857 | 0.603 |
入院首日ALB(g/L, ±s) ±s) | 41.1±3.8 | 41.5±3.1 | 41.6±4.0 | 39.6±3.1 | 37.8±4.6 | 6.848 | 0.077 |
| 入院第3天LYM〔×109/L,M(QL,QU)〕 | 1.3(0.9,1.8) | 1.7(1.4,2.1) | 1.1(0.8,1.5) a | 0.9(0.8,1.1) ab | 0.6(0.2,0.6) abc | 40.340 | <0.001 |
| 重型/危重型(例) | 21 | 5 | 7 | 2 ab | 7abc | 18.645 | <0.001 |
注:第1组为入院首日淋巴细胞计数(LYM)正常、入院第3天与入院首日LYM差值(ΔLYM)≥0;第2组为入院首日LYM正常、ΔLYM<0;第3组为入院首日LYM降低、ΔLYM≥0;第4组为入院首日LYM降低、ΔLYM<0;WBC为白细胞计数,CRP为C-反应蛋白,PLT为血小板计数,ALT为丙氨酸转氨酶,AST为天冬氨酸转氨酶,ALB为白蛋白;计数资料采用χ2检验中的Fisher精确检验;与第1组比较,aP<0.05;与第2组比较,bP<0.05;与第3组比较,cP<0.05
4组患者间年龄,入院首日白细胞计数(white blood cell count,WBC)、LYM、CRP,入院第3天LYM及入院后30 d内出现重型/危重型的情况差异均有统计学意义(均P<0.05)。其中,第3组、第4组年龄较大;第3组入院首日WBC、LYM最低;第4组入院首日CRP最高,入院第3天LYM最低,出现重型/危重型的患者较多。
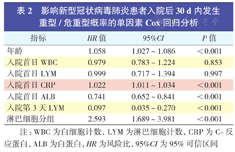
影响新型冠状病毒肺炎患者入院后30 d内发生重型/危重型概率的单因素Cox回归分析
影响新型冠状病毒肺炎患者入院后30 d内发生重型/危重型概率的单因素Cox回归分析
| 指标 | HR值 | 95%CI | P值 |
|---|---|---|---|
| 年龄 | 1.058 | 1.027~1.086 | <0.001 |
| 入院首日WBC | 0.979 | 0.783~1.224 | 0.853 |
| 入院首日LYM | 0.999 | 0.717~1.394 | 0.997 |
| 入院首日CRP | 1.022 | 1.011~1.034 | <0.001 |
| 入院首日ALB | 0.741 | 0.652~0.841 | <0.001 |
| 入院第3天LYM | 0.097 | 0.035~0.270 | <0.001 |
| 淋巴细胞分组 | 2.593 | 1.689~3.981 | <0.001 |
注:WBC为白细胞计数,LYM为淋巴细胞计数,CRP为C-反应蛋白,ALB为白蛋白,HR为风险比,95%CI为95%可信区间
将单因素分析中差异有统计学意义的指标及临床上可能与新冠肺炎患者预后相关的临床指标〔白蛋白(albumin,ALB)〕进行单因素Cox回归分析,结果显示,年龄、入院首日CRP和ALB、入院第3天LYM、淋巴细胞分组差异均有统计学意义(均P<0.01)。
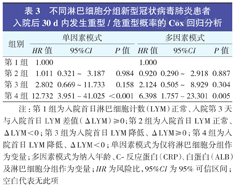
不同淋巴细胞分组新型冠状病毒肺炎患者入院后30 d内发生重型/危重型概率的Cox回归分析
不同淋巴细胞分组新型冠状病毒肺炎患者入院后30 d内发生重型/危重型概率的Cox回归分析
| 组别 | 单因素模式 | 多因素模式 | ||||
|---|---|---|---|---|---|---|
| HR值 | 95%CI | P值 | HR值 | 95%CI | P值 | |
| 第1组 | 1.000 | 1.000 | ||||
| 第2组 | 1.011 | 0.321~ 3.187 | 0.984 | 0.920 | 0.290~ 2.918 | 0.887 |
| 第3组 | 2.802 | 0.669~11.733 | 0.158 | 2.124 | 0.505~ 8.929 | 0.304 |
| 第4组 | 12.732 | 3.951~41.025 | <0.001 | 6.398 | 1.757~23.301 | 0.005 |
注:第1组为入院首日淋巴细胞计数(LYM)正常、入院第3天与入院首日LYM差值(ΔLYM)≥0;第2组为入院首日LYM正常、ΔLYM<0;第3组为入院首日LYM降低、ΔLYM≥0;第4组为入院首日LYM降低、ΔLYM<0;单因素模式为仅将淋巴细胞分组作为变量;多因素模式为纳入年龄、C-反应蛋白(CRP)、白蛋白(ALB)及淋巴细胞分组作为变量;HR为风险比,95%CI为95%可信区间;空白代表无此项
第4组新冠肺炎患者入院30 d内发生重型/危重型的概率为第1组的12.7倍(P<0.001);而第2组、第3组发生概率与第1组差异无统计学意义。
通过共线性诊断发现,入院第3天LYM和淋巴细胞分组的VIF为14.426,考虑两者具有共线性,故未将入院第3天LYM纳入淋巴细胞分组的多因素Cox回归分析。综合上述,将年龄、CRP、ALB和淋巴细胞分组纳入多因素Cox回归分析显示,第4组入院30 d发生重型/危重型的概率为第1组的6.4倍(P=0.005);而第2组、第3组发生概率与第1组差异无统计学意义。


注:第1组为入院首日淋巴细胞计数(LYM)正常、入院第3天与入院首日LYM差值(ΔLYM)≥0;第2组为入院首日LYM正常、ΔLYM<0;第3组为入院首日LYM降低、ΔLYM≥0;第4组为入院首日LYM降低、ΔLYM<0
入院后30 d内第4组累积发生重型/危重型的概率显著高于第1、2、3组(Log-Rank检验:χ2=42.617,P<0.001),且全部发生在入院后18 d内。
本研究结果显示,入院首日LYM降低且持续下降(第4组)的8例新冠肺炎患者中有7例进展为重型/危重型;入院首日LYM降低但入院第3天LYM较入院首日未降低的新冠肺炎患者(第3组)与入院首日LYM正常的患者(第1组和第2组)出现重型/危重型的概率差异均无统计学意义。说明入院后淋巴细胞动态变化与新冠肺炎患者病情严重程度相关,这与Wang等[1]的临床研究结果是相似的。有研究表明,新冠肺炎患者入院首次LYM与预后呈相关性[8,9,10,11,12,13]。Zhang等[14]认为淋巴细胞减少症可能是新冠肺炎的潜在诊断指标。一项针对452例新冠肺炎患者(包含286例重型/危重型患者)淋巴细胞亚群的研究结果显示,重型/危重型患者辅助性T淋巴细胞明显减少[15]。Xu等[16]对新冠肺炎死亡患者尸体解剖的病理检查结果显示,肺组织间质中淋巴细胞聚集明显,其可能与外周血淋巴细胞减少相关。
Gong等[17]认为新冠肺炎患者肺损伤及其他器官损伤与细胞因子风暴综合征(cytokine storm syndrome,CSS)密切相关,其细胞因子由持续被激活和繁殖的淋巴细胞及巨噬细胞大量产生。目前仅发现入住ICU的新冠肺炎患者表现出较高的细胞因子水平,如白细胞介素(interleukins,IL-2、IL-7、IL-10)等[15]。史晓朋等[18]发现,IL-6、CD4+水平与新冠肺炎病情严重程度密切相关,当IL-6≥6.02 ng/L且CD4+<355个/μL时提示预后不佳。另外临床研究表明,中性粒细胞/淋巴细胞比值(neutrophil/lymphocyte ratio,NLR)与病毒性和细菌性肺炎的预后相关[19];且Liu等[5]研究发现,NLR是新冠肺炎患者预后的独立预测因子;EL-Emshaty等[20]认为NLR与CRP相关(r=0.710,P=0.000);本研究显示,CRP是新冠肺炎病情严重程度的高危因子,但此次未将NLR纳入研究。
本研究中重型/危重型新冠肺炎患者占20.2%(21/104),其入院至出现重症的中位时间为9(6,13)d;重症患者以呼吸困难为主,达81.0%(17/21)。另一项国内临床研究显示,新冠肺炎患者发生呼吸困难的比例达66.7%[21]。Wang等[1]研究显示,入住ICU的36例新冠肺炎患者首次出现症状到出现呼吸困难的中位时间为5 d,到出现急性呼吸窘迫综合征的中位时间为8 d。另外,本研究中新冠肺炎患者发生肝功能异常(转氨酶高于正常参考值2倍以上)的比例较高,达22.1%(23/104);另一项研究显示,入住ICU的30例新冠肺炎患者1周内均出现不同程度的肝功能损伤[21]。新冠肺炎患者1周内发生呼吸困难(甚至呼吸衰竭)、肝功能损伤的可能性极大,故早期评估新冠肺炎患者病情严重程度是必要的,以便早期干预,改善预后。
本研究显示,入院首日LYM降低的患者年龄明显大于LYM正常者,考虑年龄较大的患者发生淋巴细胞减少的可能性大,这与其他临床研究结论相似[1,3]。许靖等[13]研究认为,年龄≥60岁为新冠肺炎的高危因素,故需加强对高龄患者的重视。
综上,本次回顾性分析104例新冠肺炎患者入院时的淋巴细胞及其72 h内的动态变化,结果表明,早期淋巴细胞动态变化与患者病情严重程度相关,入院首日即出现LYM下降且72 h内持续下降的患者发生重型/危重型的概率较高。考虑淋巴细胞获得容易,且仅为单个因素,在临床上评估患者预后较为简单、可操作性强。但本研究为单中心研究,其结论仍需更大样本的临床研究进一步验证。
所有作者均声明不存在利益冲突



























