
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
Ⅰ.导言
Ⅱ.UEA的比较
Ⅲ.UEA成像的建议
Ⅳ.临床应用
Ⅳ.A.左室容量、LVEF和RWM定量测定的更新
Ⅳ.B.心腔内异常的更新
Ⅳ.C.负荷超声心动图
Ⅳ.D.血管显像:颈动脉、股动脉、主动脉和内移植物
Ⅳ.E.增强超声心动图在重症和急诊中的应用
Ⅳ.F.UEA在先天性心脏病和儿科超声中的应用
Ⅴ. 成人UEA安全性与适应证的更新
Ⅵ.超声心动图室UEA的使用方法
Ⅵ.A.医师
Ⅵ.B.超声医师
Ⅶ.新兴应用
Ⅶ.A.声学溶栓
Ⅶ.B.分子显像
Ⅶ.C.靶向药物和基因递送
Ⅶ.D.诊断性UTMD改善血流灌注
Ⅷ.UEA的成本效益
Ⅷ.A.降低患者成本
Ⅷ.B.改善阳性预期值
Ⅷ.C.改进患者的急诊评估
Ⅸ.超声心动图使用UEA建议小结及其他资源
2D:二维
3D:三维
ASE:美国超声心动图学会
CAD:冠状动脉疾病
CHD:先天性心脏病
CMRI:心脏磁共振显像
COR:推荐等级
CPT:当代操作术语
CT:计算机断层显像
DSE:多巴酚酊胺负荷超声心动图
DUS:诊断超声
ED:急诊科
FDA:美国食品药品管理局
ICU:重症监护病房
LOE:证据水平
LVEF:左心室射血分数
LVO:左心室显影
MBV:心肌血容量
MCE :心肌声学造影
MI:机械指数
MP:心肌灌注
OR:比数比
PAD:外周动脉疾病
RCT:随机对照临床试验
RTMCE:实时心肌声学造影
RWM:节段性室壁运动
SPECT:单电子发射计算机断层显像
TEE:经食管超声心动图
TTE:经胸超声心动图
UEA:超声增强剂
UTMD:超声靶向微泡破坏
VLMI:极低机械指数
超声增强剂(UEA)的应用业已成为超声心动图检查不可或缺的组成部分。自2008年美国超声心动图学会(ASE)有关超声造影剂临床应用的共识声明发表以来[1],若干重要的发展推动了对原有文件的必要修改,形成新的指南文献。
1.为减少误解,将"超声造影剂"(以微泡为主要成分增强超声信号的制剂)更名为"超声增强剂"[2,3,4,5]。本写作组认为这一新的术语有助于患者和医师将UEA与碘(或钆)造影剂的区分,但在接受超声心动图造影和心肌声学造影(MCE)检查时,两者均可使用。
2.跨学科认证委员会要求在特定情况下使用UEA应有明文规定(第1.6.2.4B节,2017.6.1更新)[6]。
3.UEA在若干不同的临床情况下(负荷超声心动图、肺动脉高压、心内分流),以及急诊科(ED)、重症监护、儿科等应用的安全性均有文献支持。倾向匹配研究不但记载了UEA的安全性,也证明了早期应用UEA在改善患者预后方面的潜在价值及重要性(表1)。在大型单中心和多中心的研究支持下,美国食品及药品管理局(FDA)已取消了UEA在肺动脉高压、危重患者中应用的黑框警告。最近,FDA也取消了对其在已知和疑似右-左分流患者中应用的警告。
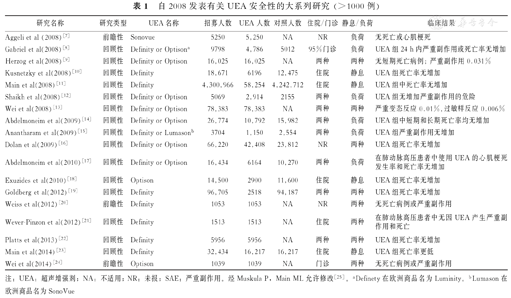
自2008发表有关UEA安全性的大系列研究 (>1000例)
自2008发表有关UEA安全性的大系列研究 (>1000例)
| 研究名称 | 研究类型 | UEA名称 | 招募人数 | UEA 人数 | 对照人数 | 住院/门诊 | 静息/负荷 | 临床结果 |
|---|---|---|---|---|---|---|---|---|
| Aggeli et al (2008)[7] | 前瞻性 | Sonovue | 5250 | 5,250 | NA | NR | 负荷 | 无死亡或心肌梗死 |
| Gabriel et al(2008)[8] | 回顾性 | Definity or Optisona | 9798 | 4,786 | 5012 | 95%门诊 | 负荷 | UEA组24 h内严重副作用或死亡率无增加 |
| Herzog et al(2008)[9] | 回顾性 | Definity or Optison | 16,025 | 16,025 | NA | 两种 | 两种 | 无短期死亡病例;严重副作用0.031% |
| Kusnetzky et al(2008)[10] | 回顾性 | Definity | 18,671 | 6196 | 12,475 | 住院 | 静息 | UEA组死亡率无增加 |
| Main et al(2008)[11] | 回顾性 | Definity | 4,300,966 | 58,254 | 4,242,712 | 住院 | 静息 | UEA组中死亡率无增加 |
| Shaikh et al(2008)[12] | 回顾性 | Definity or Optison | 5069 | 2,914 | 2155 | 两种 | 负荷 | UEA组无增加严重副作用的危险 |
| Wei et al(2008)[13] | 回顾性 | Definity or Optison | 78,383 | 78,383 | NA | 两种 | 两种 | 严重变态反应0.01%,过敏样反应0.006% |
| Abdelmoneim et al(2009)[14] | 回顾性 | Definity or Optison | 26,774 | 10,792 | 15,982 | 两种 | 负荷 | UEA组中短期和长期死亡率均无增加 |
| Anantharam et al(2009)[15] | 回顾性 | Definity or Lumasonb | 3704 | 1,150 | 2,554 | 两种 | 负荷 | UEA组严重副作用无增加 |
| Dolan et al(2009)[16] | 回顾性 | Definity or Optison | 66,220 | 42,408 | 23,812 | NR | 两种 | UEA组死亡率无增加 |
| Abdelmoneim et al(2010)[17] | 回顾性 | Definity or Optison | 16,434 | 6164 | 10,270 | 两种 | 负荷 | 在肺动脉高压患者中使用UEA的心肌梗死发生率和死亡率无增加 |
| Exuzides et al(2010)[18] | 回顾性 | Optison | 14,500 | 2900 | 11,600 | 住院 | 静息 | UEA组死亡率无增加 |
| Goldberg et al(2012)[19] | 回顾性 | Definity | 96,705 | 2518 | 94,187 | 两种 | 两种 | UEA组死亡率无增加 |
| Weiss et al(2012)[20] | 前瞻性 | Definity | 1053 | 1053 | NA | NR | 两种 | 无死亡病例或严重副作用 |
| Wever-Pinzon et al(2012)[21] | 回顾性 | Definity | 1513 | 1513 | NA | 住院 | 两种 | 在肺动脉高压患者中无因UEA产生严重副作用和死亡 |
| Platts et al(2013)[22] | 回顾性 | Definity | 5956 | 5956 | NA | 两种 | 两种 | UEA组死亡率无增加 |
| Main et al(2014)[23] | 回顾性 | Definity | 32,434 | 16,217 | 16,217 | 住院 | 静息 | UEA组死亡率更低 |
| Wei et al(2014)[24] | 前瞻性 | Optison | 1039 | 1039 | NA | 门诊 | 两种 | 无死亡病例或严重副作用 |
注:UEA:超声增强剂;NA:不适用;NR:未报;SAE:严重副作用。经Muskula P,Main ML允许修改[25]。aDefinety在欧洲商品名为Luminity。bLumason在欧洲商品名为SonoVue
4.大量临床试验已证明UEA在负荷超声心动图中应用的安全性和有效性(潘生丁、腺苷、瑞加德松、踏车和踏板),而且证明了在静息状态下的节段性室壁运动(RWM)和心肌灌注对预测患者后果有明显的附加价值(表2)。
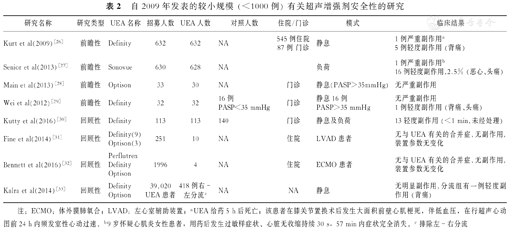
自2009年发表的较小规模 (<1000例) 有关超声增强剂安全性的研究
自2009年发表的较小规模 (<1000例) 有关超声增强剂安全性的研究
| 研究名称 | 研究类型 | UEA名称 | 招募人数 | UEA人数 | 对照人数 | 住院/门诊 | 模式 | 临床结果 |
|---|---|---|---|---|---|---|---|---|
| Kurt et al(2009)[26] | 前瞻性 | Definity | 632 | 632 | NA | 545例住院87例 门诊 | 静息 | 1例严重副作用a5例轻度副作用 (背痛) |
| Senior et al(2013)[27] | 前瞻性 | Sonovue | 630 | 628 | NA | 负荷 | 1例严重副作用b16例轻度副作用,2.5% (恶心、头痛) | |
| Main et al(2013)[28] | 前瞻性 | Optison | 33 | 30 | NA | 门诊 | 静息(PASP>35mmHg) | 无严重副作用 |
| Wei et al(2012)[29] | 前瞻性 | Definity | 32 | 32 | 16例PASP<35 mmHg | 门诊 | 静息16例PASP>35 mmHg | 无严重副作用1例轻度副作用 (背痛、头痛) |
| Kutty et al(2016)[30] | 回顾性 | Definity | 113 | 113 | 140 | 门诊 | 静息及负荷 | 13轻度副作用 (<1 min,未经处理) |
| Fine et al(2014)[31] | 回顾性 | Definity(9)Optison(3) | 251 | 10 | NA | 住院 | LVAD 患者 | 无与UEA有关的合并症,无副作用,装置参数无变化 |
| Bennett et al(2016)[32] | 回顾性 | PerflutrenDefinityOptison | 1996 | 4 | NA | 住院 | ECMO 患者 | 无与UEA有关的合并症,无副作用,装置参数无变化 |
| Kalra et al(2014)[33] | 回顾性 | DefinityOptison | 39,020UEA患者 | 418例右-左分流c | NA | NA | 静息 | 无明显副作用,分流组有一例轻度副作用 (背痛) |
注:ECMO:体外膜肺氧合;LVAD:左心室辅助装置;aUEA给药5 h后死亡;该患者在膝关节置换术后发生大面积前壁心肌梗死,伴低血压,在行超声心动图前24 h内频发室性心动过速。b9岁怀疑心肌炎女性患者,用药后发生过敏样症状、心脏无收缩持续30 s,57 min内症状完全消失。c排除左-右分流
5.UEA在心肌灌注(MP)显像的应用日益增加,特别是负荷超声心动图,ED胸痛的检查,及心内占位的评估[25,34,35]。美国医学会当代操作术语(CPT)专家组已批准"心肌灌注造影超声心动图"为Ⅲ类(新兴技术)CPT代码(+0439T);在静息或负荷超声检查时,为估价心肌缺血或存活心肌而使用血流灌注显像时,应与下列代码合用:93306、93307、93308、93350和93351,自2016年7月1日生效。虽然这一Ⅲ类代码还不能在美国老年医疗中心报销,但这一批准表明了UEA评估MP在若干临床情况下明显的附加价值。
6.大量已发表的数据证实,UEA可改善各种临床情况下的声窗不佳患者的早期预后,有益于成本效益[5,25]。
7.美国FDA已批准新型UEA的使用(表3)。UEA也已被其他北美及南美国家批准。超声厂家对左心室显影(LVO)和低机械指数的参数进行了修改,以获得最佳超声增强效果[36]。表4给出特定仪器的调节指导,以优化左心室的RWM和MP分析。
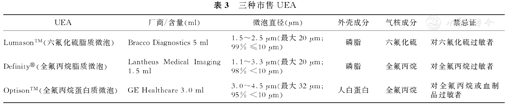
三种市售UEA
三种市售UEA
| UEA | 厂商/含量(ml) | 微泡直径(μm) | 外壳成分 | 气核成分 | 禁忌证 |
|---|---|---|---|---|---|
| Lumason™(六氟化硫脂质微泡) | Bracco Diagnostics 5 ml | 1.5~2.5 μm(最大20 μm;99% ≤10 μm) | 磷脂 | 六氟化硫 | 对六氟化硫过敏者 |
| Definity®(全氟丙烷脂质微泡) | Lantheus Medical Imaging 1.5 ml | 1.1~3.3 μm(最大20 μm;98% <10 μm) | 磷脂 | 全氟丙烷 | 对全氟丙烷过敏者 |
| Optison™(全氟丙烷蛋白质微泡) | GE Healthcare 3.0 ml | 3.0~4.5 μm(最大32 μm;95% <10 μm) | 人白蛋白 | 全氟丙烷 | 对全氟丙烷或血制品过敏者 |
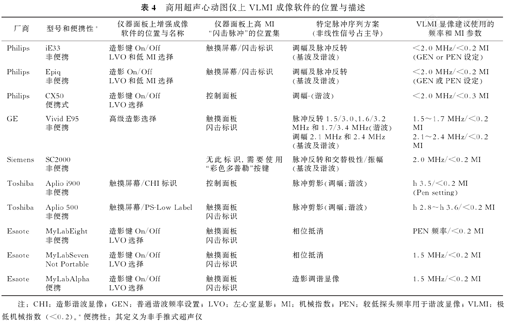
商用超声心动图仪上VLMI成像软件的位置与描述
商用超声心动图仪上VLMI成像软件的位置与描述
| 厂商 | 型号和便携性* | 仪器面板上增强成像软件的位置与名称 | 仪器面板上高 MI"闪击脉冲"的位置集 | 特定脉冲序列方案(非线性信号占主导) | VLMI显像建议使用的频率和MI参数 |
|---|---|---|---|---|---|
| Philips | iE33非便携 | 造影键On/Off LVO和低MI选择 | 触摸屏幕/闪击标识 | 调幅及脉冲反转(基波及谐波) | <2.0 MHz/<0.2 MI(GEN or PEN设定) |
| Philips | Epiq非便携 | 造影On/Off LVO和低MI选择 | 触摸屏幕/闪击标识 | 调幅及脉冲反转(基波及谐波) | <2.0 MHz/<0.2 MI(GEN或PEN设定) |
| Philips | CX50便携式 | 造影键On/Off LVO选择 | 控制面板 | 调幅-(谐波) | <2.0 MHz/<0.3 MI |
| GE | Vivid E95非便携 | 高级造影选择 | 触摸面板闪击标识 | 脉冲反转1.5/3.0、1.6/3.2 MHz和1.7/3.4 MHz(谐波)调幅2.1 MHz和2.4 MHz(基波及谐波) | 1.5~1.7 MHz/<0.2 MI2.1~2.4 MHz/<0.2 MI |
| Siemens | SC2000非便携 | 无此标识,需要使用"彩色多普勒"按键 | 脉冲反转和交替极性/振幅(基波及谐波) | 2.0 MHz/<0.2 MI | |
| Toshiba | Aplio i900非便携 | 触摸屏幕/CHI标识 | 控制面板 | 脉冲剪影(调幅;谐波) | h 3.5/<0.2 MI(Pen setting) |
| Toshiba | Aplio 500非便携 | 触摸屏幕/PS-Low Label | 触摸面板闪击标识 | 脉冲剪影(调幅;谐波) | h 2.8~h 3.6/<0.2 MI |
| Esaote | MyLabEight非便携 | 造影键On/Off LVO选择 | 触摸面板闪击标识 | 相位抵消 | PEN 频率/<0.2 MI |
| Esaote | MyLabSevenNot Portable | 造影键On/Off LVO选择 | 触摸面板闪击标识 | 相位抵消 | 1.5 MHz/<0.2 MI |
| Esaote | MyLabAlpha便携 | 造影键On/Off LVO选择 | 触摸面板闪击标识 | 造影调谐显像 | 1.5 MHz/<0.2 MI |
注:CHI:造影谐波显像;GEN:普通谐波频率设置;LVO:左心室显影;MI:机械指数;PEN:较低探头频率用于谐波显像;VLMI:极低机械指数(<0.2)。*便携性:其定义为非手推式超声仪
在收集分析大量患者参与的前瞻性随机研究、meta分析、注册数据、以及静息和负荷超声的多中心有效性对比研究中,本写作组建议采用推荐类别(COR)和证据等级(LOE)的方式来制定使用UEA的诊断策略。根据2015年美国心脏病学会/美国心脏协会制定的临床实践指南作出推荐如下[37]:
COR
Ⅰ类(强烈推荐):益处远大于风险,应当执行。
Ⅱa类(中等推荐):益处大于风险,执行可能很有用。
Ⅱb类(一般推荐):益处略大于风险,执行或许合理。
Ⅲ类:执行无益处,甚至有害。
LOE
A级:一项以上高质量的随机对照试验(RCT)证据,高质量RCT的meta分析,或一项或多项由高质量注册数据证实的RCT。
B-R级:一项或多项中等质量RCT或中等质量RCT的meta分析。
B-NR级:一项或多项中等质量且设计合理的非随机试验,或此类研究的meta分析。
C-LD级:随机或非随机观察性试验,或注册研究,或此类研究的meta分析,其在设计、执行等方面存在局限性。
C-ED级:根据临床经验得到的共识。
这次更新的重点是介绍已发表的新数据,并将这些数据与2008年共识及2014年ASE超声技师指南结合起来[1,38],给出在不同临床情况下使用UEA的具体建议。
FDA现行关于UEA使用标示的要点
FDA批准UEA在心血管疾病中的唯一应用为LVO。不过,鉴于重要科学文献的支持及2015年临床实践指南,UEA在其他超适应证应用(如MP、儿科、血管应用及负荷超声心动图)在本文件中也得到推荐[37]。经批准的UEA使用的适应证是由每个国家管辖,本文件的社会认可并不意味着另有规定。
与超声散射性很弱的红细胞不同,UEA微泡是可压缩的,且密度不同。微泡这一独特的物理特性对理解它在超声能量作用下的表现非常重要。目前在世界范围可用于心脏显像的UEA有三种:Optison、Definity (欧洲称Luminity)和Lumason (美国以外称SonoVue)。Optison仅在美国和欧洲使用,而Definity在美国、加拿大、欧洲、澳大利亚和部分亚洲地区销售。Lumason被批准在北美、新西兰、欧洲、巴西和亚洲使用[5]。微泡的大小足以通过肺循环(直径1.1~4.5 μm)。所有UEA都含有高分子量气体,其溶解性和弥散性很差,故可提高持久性。Optison和Definity含有全氟丙烷,主要区别在于外壳的构成。Optison的外壳为人白蛋白,而Definity的外壳为磷脂。Lumason含有六氟化硫,外壳为磷脂(表3)。而Lumason和Definity在具体的脂肪酸链长、电荷,以及聚乙二醇间隔的构成和长度上有所不同[3,4]。Optison和Definity使用前需冷藏,而Lumason为干粉制剂,不需冷藏。每种制剂的制备不同:Definity需要机械振荡器激活,Optison需要手工重悬微泡,Lumason则需手摇振荡。
Opison给药的浓度为10%,Definity为3%~5%,均用生理盐水稀释 (附录)[38]。在美国使用Lumason一般是用0.5 ml静脉推注,然后5~10 ml盐水缓慢冲洗,以避免产生左室腔阴影。因Lumason一支为5 ml,如需要可反复静脉推注,以维持心腔均匀显影。
另外还有不常用或改进中的UEA。Sonazoid是一种以磷脂酰丝氨酸为外壳、含有全氟丁烷的微泡,在日本和韩国批准用于肝脏和乳腺肿瘤的显像。2014年挪威也批准其在肝脏局灶病变中使用[4]。
目前FDA批准在美国成人中静脉使用UEA以增强LVO,而Lumason也可用于儿科和肝脏显像。虽然UEA还未批准应用于负荷试验,但已有报道显示UEA可以改善静息和负荷试验中RWM异常的发现[38]。所有这三种UEA均证实极为安全[34]。
目前市售UEA的要点
所有目前批准的市售UEA均含有高分子量气体,被包裹于柔性外壳内。
所有UEA均可通过肺循环和全身毛细血管网,其直径为1.1~4.5 μm。
UEA的持久性取决于微泡大小、气体构成(弥散性和溶解度)、药代动力学、外壳的性质。
三种UEA(Optison, Definity, Lumason)被FDA批准的适应证为LVO。所有在心血管疾病中的其他应用都是超适应证使用。Lumason已获批准可用于成人和小儿的肝脏成像,也可用于评估膀胱输尿管反流。
UEA产生的信号取决于发射超声的机械指数(MI)。MI与超声峰值负压呈正比,而与发射频率的平方根呈反比。当极低机械指数(VLMI),即<0.2时,微泡以非对称的方式开始振动,表现为扩展相大于压缩相,产生非线性声学信号。如发射波幅度进一步增加,微泡振动加剧,可引起微泡外壳破裂,有效释放游离气体,溶入血循环。另外,气体在微泡压缩的过程中可被排出,称之为声学驱动弥散。非线性声学信号对有效区分周围组织与微泡信号至关重要[25,35]。
根据2014年ASE超声技师指南[38],VLMI指多脉冲消除序列技术,在MI<0.2时最为有效;低MI指MI<0.3的谐波显像技术,中等MI指MI为0.3~0.5的谐波显像技术,任何超过0.5的MI称为高MI。几乎所有市售超声显像仪均配有实时VLMI技术。这些脉冲序列方案可明显增强微泡在左室腔和心肌内的显示,改善RWM和MP分析。多脉冲VLMI显像的脉冲序列示意图已发表于2014年ASE超声技师指南的表1和图1[38]。脉冲反转(或称相位反转)是一种组织消除技术,可以传递极性交替(相位)的超声脉冲。虽然脉冲反转技术通过接收二次谐波,可以很好地抑制周围非心脏组织信号,提高图像的分辨力,但可以产生明显的信号衰减,特别是在心尖切面的心底心肌节段,衰减更为明显,部分原因是过滤了较高频率的谐波信号。功率调制(或称调幅)可发现基波以及谐波的非线性活动,当MI<0.2时,这些非线性活动几乎完全来自微泡的作用。此技术也称多脉冲消除技术,它改变每一脉冲的功率或幅度,而非极性。例如,当MI为0.05时,微泡和组织对超声脉冲的反应都是线性的,而当能量提高一倍时(0.1 MI),组织的反应仍然是线性的,但微泡的反应则是非线性的。来自两个不同脉冲(两倍幅度的0.05 MI和0.1 MI)的线性反应可互相减除,只显示来自微泡的非线性行为。虽然这种顺序方案可增强造影效果,但与脉冲反转或相位反转显像(仅检测较高频率的谐波反应)相比,理论上可能降低分辨力和图像质量。厂商也通过脉冲间相位和调幅,结合多脉冲技术这一较复杂的方式,进一步增强微泡在VLMI时的非线性活动,消除周围组织的线性反应。由于所需MI更低,VLMI与B-型低MI谐波显像相比,可以得到更好的组织消除,更强的信噪比,以及更少的微泡破坏[25]。VLMI显像技术总体的临床效应是提供较高空间分辨力、合理的时间分辨力,可以同时评估MP和RWM,这在检测冠状动脉疾病(CAD)特别重要(视频1和2,在www.onlinejase.com获取)。由于在基础频率下检测非线性活动,结合功率调制及脉冲间相位和振幅调制的脉冲序列方案,使衰减大为减少,微泡信号加强,心尖和心基底部节段显影大为改善(视频3和4,在www.onlinejase.com获取)。有关图像质量优化的具体说明,请参阅2014年ASE超声技师指南中的表2[38]。


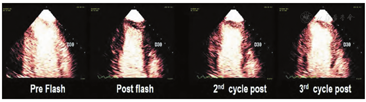
由于微泡的破坏和漩涡状伪像,操作时应当避免使用连续性中等MI(0.3~0.5 MI)或高MI。不过,间歇性(5~15帧)高MI"闪击脉冲"(0.8~1.2 MI),在VLMI显像时可用于清除心肌内造影,增强心内膜边界的显影。如后文所述,结合高MI闪击后心肌再灌注的速率与平台期心肌造影强度,可用于估测MP[35,36]。
正如2008年ASE共识声明[1]以及2014年ASE超声技师指南[38]所概括的,UEA可增强左心和右心的多普勒信号,这在成人和儿科患者中均非常有用。虽然没有新的正式临床研究,但本指南委员会仍然强烈推荐使用UEA来增强三尖瓣反流的峰速射流信号(用于估计右心室压力),以及瓣膜狭窄的峰速测量。由于多普勒发现微泡的阈值远低于微泡显影的阈值,因此,UEA可应用于多普勒显像。当进行这些测量时,多普勒增益信号应调低至可降低"微泡噪声",增加多普勒分辨率的水平。正如2008年指南所强调,应在降低增益的情况下测量增强最明确的多普勒频谱以降低晕状伪影。
要点和建议
无论是否结合间歇性高MI闪击脉冲去除心肌内增强剂,在使用UEA评估RWM(视频1,在www.onlinejase.com获取)以及LVEF的定量测定时,均应使用VLMI多脉冲显像技术(LVEF;COR IIa, LOE B-R)。
通过间歇性高MI闪击脉冲去除心肌内增强剂,分析心肌再灌注动力学和平台期心肌造影强度,VLMI多脉冲显像技术在评估MP(视频2-4;在www.onlinejase.com获取)时也非常有用(COR IIa, LOE B-R)。
三尖瓣反流显示不佳时,UEA可用于增强反流的多普勒信号;UEA也可用于瓣膜狭窄相关的多普勒频谱增强(COR I, LOE C-EO)。
厂商应为用户提供仪器内置的特定造影程序信息,以及操作方法,包括如何应用间歇性高MI闪击脉冲(MI>0.5)消除心肌增强,并增强心内膜边界描记。表4列出目前市售最新版本超声心动图仪VLMI显像预设在仪器面板上的位置。
自2008年ASE共识发表以来[1],大量文献强化了现有的临床应用,并强调了新领域的应用[16,18,23,26,27,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,61,62,63,64,65,66,67,68]。本节将介绍UEA在这些特定应用的最新信息和使用建议。
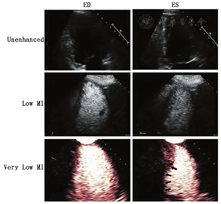
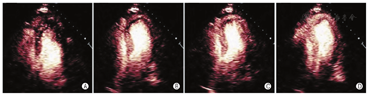
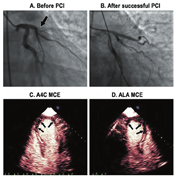
根据最近ASE/欧洲心血管影像协会关于左室腔的定量建议,容量测定时应该基于致密心肌和左室腔界面的描记[69]。但是心尖部的肌小梁结构、邻近肺组织及其干扰产生的伪像,对界面的描记造成困难。输注UEA后,左心室含有造影剂的血流充盈在左室肌小梁与致密心肌之间的腔隙,使得测量更精确,重复性也更好。以上三种市售的造影剂在LVO中的应用都进行过大型多中心的广泛研究[2,3,4]。
确定左室大小正常值对于一些临床疾病谱,如心肌病和瓣膜病的预后判断非常重要。左室容量的定量不是一项简单的工作,它取决于许多因素,包括所研究的人群和显像方法。目前ASE关于心腔定量指南,提供了从胸骨旁长轴切面测量左室内径及容量的推荐标准,并可根据体表面积进行校正[69]。如果这些信息因内膜显示质量不佳而难以获得,则建议使用UEA。与双平面造影测量的容量相比,左室内径测量可能低估左室的扩张程度[70]。此外,常规二维超声心动图(2D)可能由于图像短缩、未纳入左室致密化不全的肌小梁、心内膜显示不佳,造成左室容量的低估。使用UEA可测量左室真实的长轴,发现肌小梁间隙容积,并描记清晰的心内膜,从而准确追踪心内膜边界,克服上述技术缺陷(图1),其与心脏磁共振显像(CMRI)的结果相关紧密。常规超声心动图所测量的左室容量也始终低于CMRI所测量的左室容量[40]。最近,一项多中心研究表明使用UEA所测得的舒张末期容量明显大于未用UEA组,且在2D和三维(3D)超声心动图中的结论相同[40]。不过,由于在正常人群中进行大型UEA研究难以实施,超声心动图造影的左室容量正常值尚未确立。一项早期研究中使用UEA进行女性乳腺癌化疗前的超声心动图检查,发现51% 患者舒张末期容量异常,而在未使用造影剂时2D容量测值在正常范围[70]。由于使用UEA后左室容量测值的正常范围发生了改变,作者提出舒张末期容量的上限值在女性为83 ml/m2,男性为98 ml/m2[70]。相比未使用UEA,将使用UEA测得的均值±2倍标准差作为正常值,与CMRI的符合率更好。本写作组强调,有必要进行大型前瞻性研究,以确定使用UEA结合VLMI显像测量左室容量的范围。
LVEF的定量评估对下列情况特别重要:除颤或再同步化治疗术前、化疗制剂心脏毒性的随访、瓣膜疾病介入治疗术前(主动脉和二尖瓣反流)的评估。在这些情况中,测量的重复性至关重要。几项研究证明:使用CMRI作为金标准时,相比未使用UEA,使用UEA测量的LVEF更为准确。多中心研究表明,与未用UEA比较,使用UEA后的观察者间变异明显降低,其组内相关系数与CMRI相似[40,71]。虽然3D超声在未使用UEA时,可以增加系列射血分数测量的重复性和可靠性(如在癌症化疗病例),但在使用UEA后,并未进一步提高再测试的变异性[72]。不过,目前3D仪器上尚无VLMI显像技术。
RWM的评估极易出现明显的观察者间变异。室壁运动本身就是一种没有金标准的主观判断,部分取决于图像质量,且特别强调在整个收缩期识别心内膜的重要性。值得提及的是,估价室壁增厚在室壁运动的评估中也同样重要。因此,心内膜和心外膜都要很好地识别。一项多中心研究证明,与未使用UEA和CMRI比较,使用UEA评估RWM的观察者之间的一致性最高[73]。同一研究发现,相比CMRI,使用UEA评估RWM的一致性优于未使用UEA[40]。在此研究中,未发现3D UEA在评估RWM异常方面优于2D UAE超声心动图。同样,在图像不佳和肥胖患者进行负荷超声时,使用UEA可以改善左室节段的显像、增加阅图的信心、提高敏感性和特异性[58]。本写作组并不建议在胸部畸形或肺部过度扩张而不能显示心脏的情况下使用UEA,但在适当切面可以获得而心内膜显示不佳时,应使用UEA进行RWM评估。
要点和建议
根据2008年ASE指南,在常规静息超声心动图需要评估左室功能(LVEF和RWM)时,若2个及以上节段不能适当显示,或需要精确评估RWM时,应使用UEA(COR I, LOE A)。
在测量容量和射血分数时,可考虑使用VLMI显像结合间歇性(5~10帧)高MI(0.8~1.2)"闪击"清除心肌内增强剂,改善心内膜边界的显示(COR IIa, LOE C-EO)。
若LVEF对某些临床情况的预后评估和处理非常重要时,均应使用UEA。应结合VLMI和低MI显像技术以提供最佳LVO。
由于使用UEA获得的左室容量一般要高于未用UEA的容量,在测量左室容量的正常范围时,应用2015年ASE室腔定量指南要慎重。虽然LVEF的正常范围没有不同,但在使用UEA时,应建立新的舒张末期和收缩末期容量的正常范围。
根据2014年超声技师指南第三节[38],在VLMI显像时,推荐使用连续缓注或低剂量(≤0.5 ml)伴缓慢盐水冲洗(10~20 s),以尽量减少心尖部的微泡破坏和基底部的声衰减。
以前发表的指南文件中,在心内异常的某些特定领域已建议使用UEA。2016年ASE关于使用超声心动图评估心源性栓塞的指南就已推荐使用UEA,以"协助界定心内血栓和占位的边缘、检查其内部的血管形成"。在发现左房和心耳血栓(稍后讨论)、鉴别无血管的血栓与有血管的肿瘤方面,将UEA视为"潜在有用的"应用[74]。2011年ASE关于肥厚型心肌病患者多种心血管显像的临床建议,在怀疑心尖肥厚时,应行经胸超声心动图+静脉注射UEA,以明确心肌肥厚的范围,并对并发的潜在的心尖室壁瘤和血栓进行诊断[75]。该文件还概述了关于穿隔支注射UEA、划定每一穿隔支灌注区的具体方案(第G.ii节)。其他已发表的临床研究强调了这些具体应用,并支持拓宽UEA应用指南。
心内血栓具有极高的临床危险性,包括可能造成灾难性后果的全身栓塞。同样,抗血栓制剂也可带来重大风险,使用时必须权衡利弊。因此,精准诊断和处理心内血栓至关重要。虽然其他影像方法有了长足的进展,但对于有心内血栓倾向的患者,超声心动图仍然是诊断和风险分层的最初手段。UEA有助于发现左室血栓,其表现为心腔内的"充盈缺损"(视频5;在www.onlinejase.com获取)。而且,超声血流灌注显像可评估左室占位的组织特性,将无血管的血栓与有血管的肿瘤鉴别开,进一步提高超声心动图的诊断能力[38]。CMRI延迟增强显像诊断左室血栓的敏感性和特异性最高,而超声造影则是更具临床可行性的初步检查手段。不过,如VLMI+UEA未能检出心内血栓而临床又高度怀疑时,应考虑CMRI。
二维超声心动图能提供实时、高空间分辨率和高时间分辨率的图像,通常是心内占位最初的主要影像诊断方法。尽管已有许多超声心动图标准用于确定心内占位,但误诊、或分类错误时有发生,导致不必要的手术和不适当的抗凝疗法。通过合理的使用UEA,显示心内占位的特征,整合所有信息确定病因,是避免误诊的极具潜力的方法。心内占位可以是心脏结构的正常变异,如假腱索、附属乳头肌、粗大肌小梁等,也可以是病理性的,如血栓、赘生物、肿瘤等。任何疑有心内占位的情况,如基本图像显示不清,可使用UEA改善结构的显示,以证实或排除心内占位的存在[76]。正如普通超声心动图,超声造影可能需要非标准切面和较长的图像回放,去识别并描述心内血栓和占位的特征。
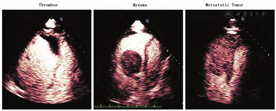
在进行超声灌注显像时使用VLMI间歇性闪击(high-MI)技术,可以显示心脏占位的血管特征,帮助鉴别其为血流丰富的恶性肿瘤还是良性肿瘤,或血栓[76]。不同类型心脏占位灌注(增强)程度的定性和定量差异,以及与邻近心肌的对比,均可为这种血管特征提供鉴别依据。定性的方法包括肉眼判断高MI闪击后包块内增强剂恢复的速率,可分为:无增强、部分或不完全增强、完全增强[76]。大多数恶性肿瘤都分布有异常新生血管以供应肿瘤细胞的快速生长,通常以密集、扩张的血管形式出现[77]。因此,肿瘤的完全增强或过度增强(对比周围心肌)提示多血管肿瘤的存在,而多血管肿瘤通常是恶性的[77]。间质肿瘤的血液供应不足,呈部分增强(如黏液瘤)(视频5和图2;在www.onlinejase.com获取),而血栓或乳头状弹性纤维瘤一般无血管分布,无增强[78]。增强程度与病理诊断或抗凝治疗后团块的消退相关[77],然而,潜在的缺点是可能导致远场无血管结构呈部分增强。因此,建议灌注成像应在可近场观察高MI闪击后微泡再灌注的切面进行。自2008年ASE共识发表以来的几项研究也证实了VLMI结合高MI闪击时不同病理类型心内占位的最大声强和再灌注速度之间的差异[79,80]。

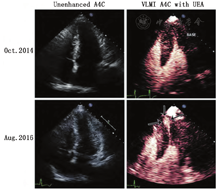
肥厚型心肌病患者心尖变异发生率约7%,但由于心尖部的不完全显影,常规TTE可能无法检测。当怀疑心尖肥厚型心肌病但图像不能清晰显示或无法排除时,应进行超声造影检查。如果存在心尖肥厚型心肌病,增强图像上可见左室腔舒张期呈特征性锹样改变,伴有明显心尖心肌室壁增厚[1]。心尖肥厚相关的并发症也易于发现,如心尖室壁瘤和血栓形成(图3,视频6;在www.onlinejase.com获取)。近来发现心尖室壁瘤与不良心血管事件有关,如心律失常和血栓栓塞[81]。然而,近期一项超声心动图造影与CMRI比较研究发现超声诊断时也可能会遇到一些陷阱,导致超声心动图检查结果呈假阴性,例如较小的心尖室壁瘤,或者未优化造影成像专用的设备设置[82]。由于VLMI成像对心尖部的描记较好,因此建议采用UEA结合VLMI成像技术常规评估肥厚性心肌病(视频6;在www.onlinejase.com获取)。通过调整心尖部的发射聚焦可能会降低扫描线的密度,减少UEA的破坏,进一步提高心尖部的图像分辨率。

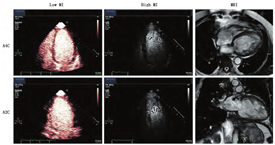
致密化不全心肌病是一种不常见但却逐渐被大家认识的疾病,会导致心力衰竭、心律失常、心脏栓塞事件及死亡。原因是心肌结构改变,表现为心肌节段性室壁运动减弱伴有两层结构的心肌肥厚:通常是一层致密化的薄的心外膜下的心肌及一层厚的不致密的心内膜下的心肌。当怀疑左室致密化不全但传统的二维成像无法充分显现时,非致密层特征性的深小梁间隐窝可通过左室小梁之间对比剂填充进行判断(图4)。在这种情况下,推荐应用谐波中等强度MI成像(如增至0.3~0.5)而非常规的低MI成像,从而可以更清晰地显示肌小梁的结构[1,38]。实时帧速下较高的机械指数可以在再灌注之前将肌小梁之间的低速微泡破坏,而保证左室腔内高速微泡的再灌注,从而更好地描记致密化不全层(图4)。

左心室室壁瘤是心肌梗死后的一种常见的无症状并发症,是左室心尖最常见的异常,其超声心动图特征是室壁变薄,心尖扩大,常伴有心尖室壁运动减弱或反向运动,可累及室壁的全层。这些特征在超声心动图中很容易看到。若心尖未完全显影且未使用UEA时,心尖部室壁瘤或许无法检出。左室假性室壁瘤、游离壁破裂和心肌梗死后室间隔缺损对患者构成威胁生命的危险,通常也易被常规超声心动图成像发现。然而,由于解剖和(或)体位以及临床条件(如重症监护室中仰卧和插管)等限制了最佳的心尖部显影,患者可能需进行心脏超声造影。UEA的使用对于其鉴别诊断以及进一步检测相关并发症(如左室血栓)至关重要[1]。
虽然振荡生理盐水增强剂可以用来观察右心室异常,但是对比效果持续时间很短。当需要持续增强右心室心内膜边界时,市售UEA可被用来显示右心室形态的各种异常,包括局部RWM异常、肿瘤和血栓。UEA还可用于从正常结构中区分这些异常,如心肌小梁或调节带[1]。胸骨旁切面或改良心尖四腔切面可能是将右心室置于近场的最佳切面。
UEA还被用来更清楚地显示心房的解剖特征(特别是左心耳),有助于区分血栓、伪影、密集自发显影或正常的解剖结构[83]。其中,血栓与伪影的鉴别在心脏复律患者术前TEE检查中尤为重要。一项100例房颤患者接受复律前TEE检查的前瞻性研究表明,UEA能够更好地识别左心耳的充盈缺损与伪影,从而提高心脏复律术前排除血栓的可信度[83]。另一项180例接受心脏复律的房颤患者前瞻性病例对照研究中,术前使用UEA进行TEE检查组未发生栓塞事件,而对照组出现了3例栓塞[84]。作者认为在计划进行心脏复律的房颤患者中,使用UEA有助于优化TEE成像,排除心房血栓,并可能降低栓塞不良事件的发生率。这些研究中没有提供特定的超声机械指数设置,但MI<0.5和谐波模式可能是在TEE中使用UEA描记的最佳模式。
UEA评估左心室异常及心内占位要点和建议
常规超声心动图不能排除有无左室血栓时,应使用UEA(COR I,LOE B-NR)。
常规超声心动图不能充分评估的左心室结构异常(致密化不全心肌病、心尖肥厚和室壁瘤)时,应考虑使用UEA(COR IIA,LOE B-NR)。
不能明确或排除有无左心室假性动脉瘤时,应使用UEA(COR I,LOE B-NR)。
应考虑使用UEA结合VLMI成像通过评估血管分布,对心内占位进行鉴别诊断(COR IIA,LOE B-NR)。
TEE期间发现左心耳有明显的自发显影或常规超声心动图无法充分显像时,应考虑使用UEA(COR IIA,LOE B-NR)。
已证实,应用低机械指数谐波成像技术进行LVO对于更准确和有效的负荷超声心动图检查是不可或缺的[85]。在运动和多巴酚丁胺负荷超声心动图(DSE)过程中使用UEA可以更好地提高成像窗欠佳患者的图像质量,从而提高敏感性、特异性和诊断的准确性[1]。这种准确性的提高归功于其能够观察所有室壁节段,使其等同于在最优图像质量的非增强显影时可观察到所有室壁节段[16]。在839名接受负荷超声心动图检查的患者中,在负荷超声心动图过程中使用UEA和VLMI成像模式提高了静息和峰值负荷状态下心内膜边界的检出,达到99.3%的有效诊断率,从而提高了可重复性和阅片人的信心[86]。尤其是当非增强图像置信度较低或者存在多于2个节段在没有造影帮助下无法看清时,这已经转化为对准确性的显著影响[85]。
当2个或更多的节段不能充分显示时,从静息状态开始并在峰值负荷状态下应用对比图像增强的临床决策方法可以减少成本,且可通过异常检查结果预测死亡率和不良事件。与运动心电图和核素显像相比,UEA的使用可减少更多下游测试,显著降低成本[68]。
虽然在2008年的ASE专家共识声明中就已经提到了VLMI多脉冲序列方案在多数系统上都可用[1],但最近才有制造商开始将它们用于LVO。VLMI技术最初是为心肌灌注评估而设计的,但它们对于微泡检测的敏感性和无漩涡伪影的心尖部心腔的完整造影显示对负荷LVO成像有很大的帮助。多中心和前瞻性单中心研究均证实了VLMI成像可以有效地检出RWM异常[16,45,66]。除了增强敏感性和心尖部的勾勒之外,VLMI技术还可检测负荷试验时透壁室壁增厚无法检出异常的心内膜下室壁增厚异常情况[42,66]。结合LVO以及高机械指数脉冲破坏后的心外膜层再充填过程有助于勾勒心内膜边缘和分析该处室壁增厚(图5和视频7;在www.onlinejase.com获取)。将UEA与VLMI成像用于室壁增厚和缺血的评估,并结合多巴酚丁胺负荷超声心动图对左束支传导阻滞患者进行常规评估,被证明可提高CAD的检出,并可独立预测死亡率和心血管事件[67]。
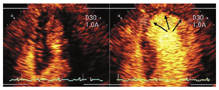

很明显,这些研究基础显示UEA提高了静息和负荷成像过程中RWM分析的诊断准确性。VLMI成像对于RWM分析来说似乎是最佳的,原因在于灌注数据带来的增量价值,有助于区分因心内膜下缺血引起的轻微的室壁增厚异常。这似乎对所有冠脉支配区域都有帮助,尤其是通常难以显影的节段(图6,视频4和7;在www.onlinejase.com获取)。由于冠脉支配区域的疾病可能只影响心尖或胸骨旁切面的某个特定节段,因此当任何节段无法充分可视化时,写作组建议应用UEA进行LVO检查。

心肌灌注成像已被用于评估心肌局部缺血和存活心肌等多种场合。静脉输注或小剂量注射UEA的VLMI成像已被用于在20~30 Hz的帧频下检查心肌血流量和容积,这被称为实时心肌声学造影(RTMCE)。给予简短的高机械指数脉冲以清除心肌造影剂,然后在收缩末期图像上分析再填充过程(视频8和9;在www.onlinejase.com获取),这一技术已在多巴酚丁胺或踏板、踏车运动负荷试验中临床应用于数千名患者[16,42,45,46,49,57,65,66]。
在进行DSE检查时,与单纯的室壁运动分析相比,心肌灌注分析提高了CAD的检出率。这似乎与缺血级联瀑布有关,在需氧增多性缺血期间,灌注异常出现在室壁运动异常之前[34]。正如前一节所述,导致VLMI成像灵敏度提高的另一因素是在使用灌注增强时检测心内膜下室壁增厚异常(图5)。这主要见于DSE检查中[42,45,66],虽然室壁增厚率可能看起来正常,但是心内膜下灌注缺损可揭示心内膜下室壁增厚异常(视频7;在www.onlinejase.com获取)。
VLMI成像应用20~30 Hz帧频可使受过基本超声心动图技术培训的技师和内科医生适应使用这种技术,无论他们是用UEA来增强RWM分析,还是用来评估整体收缩功能,或分析血流灌注。与放射性核素成像或正电子发射断层扫描相比,灌注超声心动图的空间分辨率更高,可以提高静息状态和负荷状态下对心肌缺血的检测。对于静息时非缺血性RWM异常,例如心室起搏节律或左束支传导阻滞的患者,灌注超声也有一定的作用[48]。在局部室壁运动分析中添加灌注信息可以更好地明确CAD的范围及程度,并且比单独使用室壁运动分析更好地识别出后续心脏事件的风险[45]。
在冠脉造影直径狭窄率50%~80%的中度狭窄患者中,需氧负荷期间的灌注异常与使用侵入性血流动力学测量的血流储备分数(FFR)结果进行相关分析[65],显示其相关性不好,反映了两种技术测量的差异。血流储备分数是在导管室通过测量充血负荷时跨狭窄部位的压力梯度来确定的,并没有考虑到毛细血管阻力的影响,而毛细血管阻力已被证实是在负荷试验期间冠状动脉血流的主要调节因子[87]。由于RTMCE测量的是毛细血管的血流速度和血容量,在管腔狭窄50%~80%范围内发生显著的充血负荷变化前,就可能存在负荷诱发的RTMCE异常。这些差异似乎有临床意义[65],需要进一步研究其对预后的影响。
自从2008年ASE超声造影指南发表以来,与单纯室壁运动分析相比灌注成像在预测患者预后方面的增量价值已经在踏车运动超声心动图[46]、平板运动超声心动图[45]和DSE中得到了证实[16,45]。这包括对比RTMCE与传统负荷超声心动图(UEA仅用于目前FDA批准的适应证)的随机临床试验。在每一种负荷试验情况下,进行连续输注微泡的过程中,大量无室壁运动异常的患者中出现了延迟再灌注的情况,这一指标可以独立预测随后的死亡和非致死性心肌梗死。
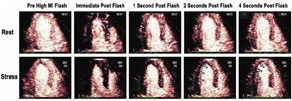
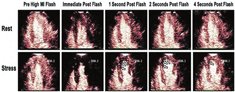
自2008年ASE共识声明发表以来,许多相关研究报道了RTMCE在灌注成像评估中的可行性、安全性、诊断和预后准确性,特别是在血管扩张剂负荷超声心动图,加强了血管扩张剂负荷方式与RTMCE结合使用的证据[27,39,41,43,47,48,50,51,52,53,55,56,64]。与正性肌力负荷相比,血管扩张剂负荷灌注成像可提供同等的检测CAD的信息,而且具有操作迅速和由于心率较低(通常不超过100次/min)而可能具有更好图像质量和较少心脏平移运动的优点(图7)。

然而,常规检测负荷诱发的RWM异常在某些情况下可能不太敏感,因为这种负荷模式不依赖于心肌需氧量。几种血管扩张剂已用于RTMCE的研究,即腺苷[16,43,47,50,51]、潘生丁[26,27,41,43,48,52,53,55]以及最近的瑞加德松(regadenoson)[54,64]。腺苷和潘生丁是灌注成像中最常用的血管扩张剂,两种药物都非选择性的直接或间接地活化所有四种腺苷受体亚型(A1,A2A,A2B和A3),这可能导致胸痛、轻度呼吸困难、低血压、支气管痉挛以及少见的可逆性房室结阻滞。瑞加德松是一种有效的选择性A2A激动剂,以400 μg静脉推注给药,具有快速起效(30 s内)和足够的作用持续时间以允许足够的时间进行图像采集(达4 min),并且副作用较小,它可能会成为灌注成像的首选血管扩张剂之一(图8)。来自灌注数据的信息对于所有这些血管扩张剂是等同的,因此可以根据当地的药物可用性、成本、副作用和感知的实际优点或缺点来定制每种血管扩张剂的选择。

一些血管扩张剂可以不同的剂量使用,这取决于是否只需要灌注信息还是也需负荷后室壁运动的信息。例如,潘生丁可以在4 min内施用至0.56 mg/kg的总剂量以实现评估灌注功能,而用该技术精确检测局部室壁运动异常则需要更长的输注时间和更高的剂量。
大规模多中心试验使用上述潘生丁的单纯血管扩张剂量RTMCE和单光子发射计算机断层扫描(SPECT)在检测CAD方面进行了比较[27,41]。第一项此类试验显示了RTMCE检测CAD具有等效敏感性和特异性,但在随后进行的一项较大试验中,所有图像均以盲法原则在其他中心阅读,该试验发现当使用冠状动脉造影作为参考标准时,MCE的敏感性优于SPECT。MCE优越的敏感性似乎体现在:①与SPECT相比,MCE具有更好的空间分辨率[48];②血管扩张剂负荷SPECT仅评估毛细血管血容量,而MCE同时检测毛细血管血容量和毛细血管血流速度[88]。而后者正成为CAD一个更敏感的标记物。与SPECT相比,早期检查血管扩张剂负荷RTMCE的预后价值的回顾性研究阐明RTMCE有更高的预测价值[39]。为了在血管扩张剂负荷期间同时评估灌注和功能,需要高剂量血管扩张剂(0.84 mg/kg在6 min内输注)。根据20多年来发表的研究成果,包括几千名患者(主要是欧洲研究),高剂量潘生丁(有或无阿托品共同给药)用于局部室壁运动评估对CAD的诊断和预后价值已经达成共识。因此,当使用RTMCE同时评估灌注和功能,经验性以高剂量潘生丁进行。在这种情况下,研究一致表明,与单独使用局部室壁运动分析相比,增加灌注分析可提高CAD检测的总体准确性,对检测出冠脉造影中度(50%~70%)狭窄具有更大的诊断获益。精确度的提高主要得益于敏感性的提高。与需求负荷类似,敏感性的改善似乎与缺血性瀑布的级联效应相关[6]。此外,静息非缺血性室壁运动异常(如左束支传导阻滞)的特异性患者群[48],与放射性核素显像相比,RTMCE能够提高对缺血的检测,因此可能特别适用于此类患者,以及起搏心律患者。腺苷和瑞加德松都是非常有效的血管扩张剂,其诱导的缺血相关RWM异常以检测CAD的准确性似乎相似[47,54]。
从预后的角度来看,单中心研究清楚地表明潘生丁增加预后的价值[55,67,71],并且在一项研究中,腺苷[89]灌注成像预测心脏联合终点优于单独使用局部室壁运动分析。一项>1 000名患者随访> 2年的研究显示,硬心脏事件(死亡或心肌梗死)也可能比单独使用局部室壁运动分析评估有更好的预测价值[55,67]。在这些情况下,相当大比例的患者虽不存在局部室壁运动异常,但观察到缓慢推注或连续输注UEA期间的延迟再充填,这种现象似乎对预测随后的死亡和非致死性心肌梗死具有独立的预后价值。应用大剂量潘生丁灌注负荷超声心动图的1 300名患者的5年随访数据表明,灌注与局部室壁运动分析相结合可获得更多的预后信息[90]。
当使用血管扩张剂负荷时,使用高机械指数闪击破坏再充填技术是必不可少的,并且该技术可能比在需求负荷时更重要,由于氧耗显著增加,即使不用这种闪击-再充填技术,灌注缺损也可变得很明显。使用血管扩张剂负荷的RTMCE可用定量技术进行评估,并允许测定心肌血流量及其负荷/静息比值(血流储备),尽管对于该技术的可行性存在一些争议,总体认为其与其他可选择的技术相当[43,44,51]。
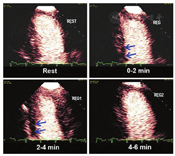
视觉定性分析更容易学习和减少劳动强度(图7和图8,视频10;可从www.onlinejase.com获得)。以下经验法则可用于结果判读:使用2D超声探头进行静息再充填应该在高机械指数脉冲闪击破坏后5 s内,在负荷状态下应2 s内再充填(视频6和7;在www.onlinejase.com获取)[1]。
在进行心肌增强超声心动图灌注成像时,如评估再灌注治疗对心肌梗死的疗效或评估心肌存活情况,会出现"有或无"两种灌注情况。对于这些情况,我们只需要评估微血管是否完整[91,92]。在MCE中,通过团注和连续输注UEA已经可以进行心肌血流量和容量的定量评估。测量快速团注UEA后首过的技术,联合其他无创成像技术,已经应用于MCE[93]。然而,这种方法并不推荐用于MCE,因为难以做到:①在造影剂首次通过心脏时对整个心脏进行成像;②充分考虑到在造影剂从静脉转运至全身时的扩散与分布。为此,我们对MCE的灌注成像技术进行了改进,测量灌注成像的两个主要参数:①灌注活跃的微血管单位的实时数量(微血管血流量[MBV]),②通过这些微血管的血流速率[94],这些参数的测量依赖于超声能量可影响微泡完整性这种独特能力[94,95]。大于0.8的高机械指数可破坏微循环内的微泡,从而消除它们的增强信号。微泡再入微循环的局部时间强度分析可评估微泡再填充的速率和程度,这分别反映了微循环通过速率和心肌血流量(MBV)(图9)。这个方法推荐使用于:①通过连续注射来维持循环中稳定的微泡浓度;②仅使用几个高能量的"闪击"信号(避免影响循环的浓度);③仅分析心脏收缩末期图像帧(消除来自心肌内大血管的信号)[96,97]。写作组发现,小剂量单次注射UEA并进行缓慢盐水冲洗,在注射后的一段时间内微泡浓度符合稳态动力学,且在临床中已用于检测信号再填充和MBV[53,55]。去除本底影响的信号强度数据可以拟合成指数方程:Y=A[1-e(-βt)],其中y是闪击脉冲后任何时间t时的造影剂信号强度,A是造影剂到达平台期的信号强度,反映相对MBV,速率常数β(s-1)反映微泡通过微循环的速率[94]。血容量和血流速度的乘积(A·β)是心肌血流量的半定量指数,而绝对血流量可以通过将A值以血池信号标化得到绝对的MBV。
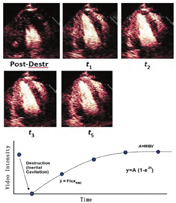

定量分析血流量或者血流储备已通过与正电子放射断层造影术、定量冠状动脉造影、多普勒血流导丝和SPECT技术对比验证[51,98,99,100]。通常认为,β值在检测缺血时比A值具有更好的辨识价值,因为在疾病过程中β值能在更早期发生变化而A值测量时伪影(例如衰减)的可能性更大(图10)[101]。通过上述参数的分析对心肌灌注进行全面的定量评估,通常会涉及绘制大的感兴趣区域,而区域选择依据为冠状动脉主要灌注区域或者推荐的心肌节段模型。

一个重要的局限性是,一个节段内的小面积重度缺血可能与一个更大节段的轻度缺血得到相同的数据。因此,建议进行数据定量分析时同时对灌注异常的空间范围进行定性评估,评估内容为涉及节段的数量以及血流量异常为透壁性亦或心内膜下。
已证实,与血管造影或其他非侵入性成像技术相比,定量或半定量负荷-静息MCE对于CAD具有更良好的诊断性能[100,101,102],meta分析显示其敏感性和特异性超过80%[43]。对于LVEF降低的心力衰竭患者,定量MCE能够区分缺血性和非缺血性病因[103]。定量MCE还可以为缺血性心脏病、确诊或疑诊CAD和正常左心室功能的患者提供预后信息,并优于定性分析[89],且已用于评估非缺血性和高血压性心肌病、应激性心肌病患者的微血管功能障碍,以及为胸痛和负荷试验阳性但冠状动脉造影无梗阻的CAD患者提供预后信息[62,104,105,106]。
对于CAD的检测,平台期强度比(负荷/静息)没有用处,但a·β比或A·β比≥2在区分正常和异常心肌血流储备方面似乎具有相同的预测价值[43]。尚不清楚该指标对检出非心外膜冠脉CAD的微循环障碍患者是否具有预测价值。
使用UEA进行负荷超声心动图成像要点和建议
在任何冠状动脉区域内,无法使用静息超声心动图观察足够的节段时,应使用UEA(COR I,LOE A)。
VLMI成像是首选的成像模式,应使用间歇性高机械指数脉冲(MI 0.8~1.0时5~15帧)以获得均匀的LVO并分析局部室壁运动(COR IIa,LOE B-R)。
以3~5 ml/min的稀释UEA(Definity为3%~5%,Optison为10%)连续注射或小剂量单次注射(Definity为0.1~0.2 ml,Lumason或Optison为0.3~0.5 ml) 进行造影时,应在10 s内应用5~10 ml生理盐水冲洗来减少声影,并在图像采集期间保持稳态浓度的微泡(COR I,LOE EO)。
尽管使用UEA进行灌注成像是超适应证应用,但是由经过培训的人员在正确的环境下使用时,可以提高心肌缺血和存活心肌的检测。
如果进行心肌灌注成像,VLMI灌注成像应在需求负荷下使用实时高机械指数闪击破坏再充填技术,同时进行灌注和室壁运动评估(COR IIa,LOE B-R)。
在DSE期间应考虑使用RTMCE结合RWM分析及灌注分析,最大限度地提高检测CAD和预测临床预后的敏感性和准确性(COR IIa,LOE B-R)。
使用标准剂量(0.56 mg/kg)或高剂量(0.84 mg/kg潘生丁)血管扩张剂进行RTMCE时应评估心肌灌注和局部室壁运动以最大化CAD检测的敏感性(COR IIa,LOE B-NR)。
使用腺苷和瑞加德松时应进行RTMCE以最大化局部室壁运动和心肌灌注检查的敏感性和特异性(COR IIa,LOE B-NR)。
在静脉输注或小剂量反复静脉团注UEA后观察到均匀的心肌造影时,应调整高机械指数脉冲以清除心肌造影信号,同时不会有过多的心腔微泡被破坏。高机械指数的脉冲应该为0.8~1.2。应该调整闪击帧的数量以清除心肌造影剂,同时最大限度地减少心腔内破坏。
在任何形式的负荷成像过程中,二维成像平面的再充填应该是一致的,并且静息状态在5 s内、负荷状态下在2 s内再充填。图11显示了高机械指数脉冲后正常的静息状态和负荷后的再充盈情况。图12和图13是在多巴酚丁胺负荷期间不同冠状动脉区域中诱导的心肌灌注缺损的示例。
定量MCE似乎在成像分析外具有附加价值,可用于检测由于CAD而导致的心肌血流异常,但需要专门的软件,能够在短暂的高机械指数脉冲破坏后分析收缩末期心肌再充填过程。只有市场上出现了有用且易于获得的软件时,才推荐用于临床应用。写作组建议所有供应商在其系统上开发定量软件,以分析任何选定区域内的高机械指数脉冲后的再充填速率和平台期强度。



第4~7条建议适用于已接受UEA灌注成像技术培训的人员
UEA在血管成像的应用继续快速增长(表5),包括颈动脉、外周动脉、主动脉、人工血管和血管内移植物的成像[107,108]。与心脏应用类似,微泡可以充当血池增强剂以更好地观察血管结构和血流(通过B型灰度成像和彩色与频谱多普勒技术)以及对滋养血管的灌注成像、动脉粥样硬化斑块新生血管和外周肌肉灌注成像。

当前和新兴的血管相关应用
当前和新兴的血管相关应用
| 颈动脉 | 管腔显影,以更好地描绘斑块的特点,包括溃疡和管腔通畅(没有完全闭塞)评估滋养血管和颈动脉斑块新生血管(新兴) |
| 股动脉 | 流入股动脉假性动脉瘤血流的鉴别及经皮凝血酶栓塞指导 |
| 外周动脉疾病 | 外周动脉疾病患者骨骼肌灌注和血流储备的量化(新兴) |
| 主动脉病理学和移植物 | 在怀疑主动脉夹层的情况下识别内膜瓣,并划定真假腔;鉴别移植物渗漏/假性动脉瘤 |
| 主动脉腔内血管移植物 | 血管内主动脉修复术后内漏的检测(新兴) |
在大多数情况下,对于颈动脉的标准超声成像来说,不需要UEA来确定狭窄严重程度。然而,当超声成像不理想时,颈动脉腔的对比增强可能有助于更好地描绘斑块和溃疡,并有助于确定病变的严重程度。具体而言,UEA在选择病例中可用于区分严重狭窄病变和完全性颈动脉闭塞(视频11;在www.onlinejase.com获取),从而影响患者的治疗[109,110]。UEA评估滋养血管和颈动脉斑块新生血管形成的数据不断涌现(图14,视频12;在www.onlinejase.com获取),这可反映斑块的不稳定性和易损性[111]。
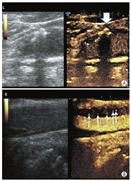

虽然研究显示斑块内的对比信号强度与随后的组织学检查之间具有良好的相关性[112,113],但是在推荐更多的常规使用之前,需要大量的前瞻性研究来评估增强超声观察斑块新生血管的预后意义。
UEA在股动脉和外周动脉疾病(PAD)中的使用受到限制。在医源性股动脉假性动脉瘤的情况下,增强超声已被证明可用于描绘血流和引导经皮凝血酶闭塞[114]。与MCE心肌灌注成像类似,UEA也可用于评估周围动脉疾病慢性期的骨骼肌灌注和血流储备[115]。由于缺乏评估PAD组织灌注的技术,增强超声检查将有潜力成为评估患者肢体灌注的主要技术。
在过去的20年中,血管内技术取得了进展,对于许多需要干预腹主动脉瘤的患者而言,血管内主动脉修复的效果与开腹修复相当。主动脉血管腔内修复后监测包括血管内漏,这是该手术最常见的并发症。内漏可能导致动脉瘤囊内高压,可能导致扩张和破裂。尽管计算机断层扫描(CT)仍然是内漏检测的金标准,但多普勒超声检查具有优势,包括无需肾毒性造影剂和电离辐射[116],以及实时无创监测介入放射学治疗内漏的操作过程的潜力。UEA现在作为CT的可行替代技术出现,借由对比剂施用期间在残余动脉瘤囊内检测到微泡以提示内漏(图15,视频13;在www.onlinejase.com获取)。研究已经证明对比增强超声对于内漏的检测具有高敏感性和特异性,与CT检测和分类内漏效力相当[116,117,118]。


尽管CT和TEE是检测A型主动脉夹层最常见的诊断方式,但主动脉的对比增强可以帮助区分TTE和TEE上真正的内膜瓣与线状伪影。在主动脉夹层患者中,对比增强也可以帮助描绘真腔和假腔(视频14;可在www.onlinejase.com上获得)。增强剂首过期需要对增强剂的首次团注进行成像,以描绘真腔和假腔中的分层流动,避免由对比剂的静脉注射量过大或速度过快造成的衰减。
如下所述,2007年美国FDA向UEA管理部门发布了黑框警告和多种疾病状态禁忌证,随后公布了超声增强剂在超声心动图中临床应用的ASE共识声明[1]。这些疾病状态禁忌证(急性心肌梗死或急性冠状动脉综合征、恶化或失代偿性心力衰竭、严重室性心律失常,或基于QT间期延长而存在发生心律失常的高危患者,以及呼吸衰竭、严重肺气肿、肺栓塞或其他可能导致肺动脉高压的病症)基本上排除了绝大多数重症监护室(ICU)患者行心脏超声造影。在一项研究中,超过58 000例住院患者接受了增强超声心动图检查,其中67%具有上述的一项或多项诊断[11]。虽然这些疾病状态禁忌证随后被FDA取消,但每种市售超声造影剂的当前处方信息都警告有这些诊断的患者可能会增加严重心肺反应的风险。然而,由于患者相关因素,包括机械通气、伤口敷料和患者定位困难,ICU患者的超声心动图常常在技术上困难,强调了对于这个患者群体中UEA的特殊需要。尽管以前的研究证实在超声成像存在基线技术难度的ICU患者中,UEA可改善图像质量,但在2008年共识声明发表时,仍缺乏预后数据[1]。
继2007年FDA黑框警告后,FDA和UEA制造商合作设计了两项超声心动图结局研究。首先,接受Optison TTE检查的2 900名危重病患者与11 600名接受非增强超声心动图检查的患者倾向匹配[18],两组的短期死亡率无差异[比数比(OR)1.18,95 %CI 0.82-1.71,P=0.37]。在另一项更大规模的研究中,16 217例接受Definity增强超声心动图检查的危重患者与16 217例接受非增强超声心动图检查的患者相比较[23],在检查后48 h,增强心脏超声组的死亡率显著降低(1.7% 对2.5%;OR 0.66;95%CI 0.54-0.80)。虽然没有直接的证据表明增强超声心动图在这种死亡率差异中起了一个因果作用,但是对这些危重病患者进行早期和更准确的诊断可能有助于更早期提供药物治疗。
Kurt等的研究数据支持这一论点[26]。连续632例技术难度较大的超声心动图检查患者接受了UEA的第二次检查,使用UEA将技术上困难的检查比率从86.7%降低到9.8%,几乎所有研究对象都获得了具有良好诊断质量的超声图像,使35.6%的患者发生了显著的管理变化(避免了下游诊断检查、重要的药物变化或两者皆具)。这种影响在外科ICU患者中最大(n=102),其中使用UEA导致63%的患者发生显著的管理变化。尽管UEA在重症监护研究中的益处主要在于改善局部和整体左心室收缩功能的分析,但可以在具有成像困难的患者中获得附加信息,包括增强的跨瓣膜多普勒信号用于压力梯度估计以及任何心内膜的检测和占位性病变[1,38]。
大多数胸痛急诊患者心电图没有明显的ST段抬高,并且许多急性心肌梗死患者未能描述典型的心绞痛胸部不适。另外,常规心脏生物标志物评估对于检测急性心肌梗死早期心肌坏死的敏感性较低。鉴于这些局限性,超声心动图评估室壁增厚率和心肌灌注(图16)已被认为传统评估疑似心肌缺血急诊患者的辅助手段[119],并且超声心动图在2011年超声心动图适用标准中被批准用于该适应证[120]。在2008年美国超声心动图协会共识声明之前发表的研究表明,即使在没有心脏生物标志物数据的情况下,在因胸痛就诊的急诊患者中使用UEA(区域功能和心肌灌注的评估)不仅显著增加诊断价值,并且增加短期、中期和长期预后的评估价值[120]。最近,Wei等[59]研究了1 166名长期胸痛的急诊患者,在这些患者中建立了一种风险模型,其包括心电图、超声心动图的节段性室壁运动和超声心动图心肌灌注评估,并在随后的720名患者中进行一系列验证。

节段性室壁运动异常但心肌灌注正常(OR 3.5,95%CI 1.8-6.5,P<0.001),和节段性室壁运动与心肌灌注均异常(OR 9.6, 95%CI 5.8-16.0,P<0.001),在预测非致死性心肌梗死或心脏死亡方面均优于心电图ST段异常(OR 2.9, 95%CI 1.7-4.8,P<0.001)。
此外,Wyrick等[60]评估了957名怀疑有心肌缺血但无心电图诊断证据的急诊患者接受MCE的成本效益。尽管这些患者中有67%按照传统的临床诊断标准(病史、体格检查、心电图和心脏生物标志物)的平均住院费用为5000美元,笔者认为通过加入MCE检查可为每位患者节省900美元。523例患者的MCE检查结果正常,并且由于其后续心脏事件发生率低(0.6%),可以直接从急诊出院,使整体入院率降低45%。
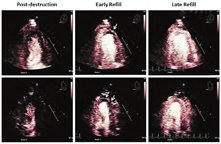
MCE已被应用于评估ST段抬高型心肌梗死(STEMI)急症处理后静息微血管血流量[56,121]。即使在梗阻血管早期成功再通后,梗死区域内静息微血管的持续灌注缺损对于不良左心室重构和再发心脏事件(死亡和再次梗死)有独立的预测价值。尽管数据有限,VLMI下UAE似乎可以同时获得STEMI患者出院前两项重要预后指标的评估,即左心室收缩功能和微血管阻塞程度。
尽管现代的经皮介入技术可以实现血管造影证实的再通和正常的心外膜血流,但微血管阻塞仍可能存在于相当大比例的患者中,并对预后也相当重要(图17)。

UEA在重症监护和急诊情况下使用的要点和建议
鉴于对患者管理的显著影响以及与降低死亡率的相关性,所有技术性困难的重症监护和急诊患者都推荐使用UEA,以更快、更准确地诊断可能危及生命的疾病,并减少下游诊断检查的需求。增强超声心动图不应在特定疾病的诊断或出现并发症时被停用(COR I, LOE B-NR)。
在怀疑有心肌缺血(并缺乏心电图证据)的急诊患者中,使用MCE进行节段功能评估会增加诊断和预后价值(超过传统的临床和心电图评估)并可能降低医疗费用(COR I, LOE B-NR)。
在怀疑有心肌缺血(并缺乏心电图证据)的急诊患者中,使用UEA进行心肌灌注评估会增加诊断及预后价值(超过传统的临床、心电图和区域功能评估)并可能降低医疗费用。在有条件的中心,若超声医师和临床医师具备操作和解读心肌灌注检查专业技术,则应考虑应用UEA技术(COR IIa, LOE B-NR)。
在超声临床医生具备操作和解读心肌灌注超声心动图专业技能的机构,以VLMI成像进行MCE可用于STEMI后患者以评价左室收缩功能、心腔内血栓和梗死区域内微循环血流量(COR IIa, LOE B-NR)
尽管UEA在成年人应用中非常有效,但在儿科的使用非常有限。此外,FDA尚未批准任何商用UEA用于小儿心脏成像(虽然Lumason已被批准用于小儿肝脏成像)。多项小样本研究报道了儿童和青少年使用UEA后具有临床意义[30,122,123],这些研究表明,在患有先天性心脏病的患者中,UEA改善了左右心室节段性室壁运动的可视化,从而能更好地量化静息时和生理或药物负荷期间的心室功能。使用UEA增强多普勒信号有利于定量先天性心脏病患者的右心室收缩压,与成年人一样,使用RTMCE可以在分析室壁运动的同时测量右心室和左心室MP[30,56,122,123]。
与一般看法相反,年龄较大的儿童在技术上可能对使用TTE成像具有更大挑战。由于既往心脏手术、胸壁问题以及心脏形状的改变导致的超声窗限制,先天性心脏病患者的成像挑战性更大。由于之前的外科手术和肥胖导致的青少年和年轻成人的困难超声窗频率增加、在先天性心脏病患者中进行涉及冠状动脉操作的外科手术的次数增加、在获得性心脏病(例如川崎病)随访中对于评估缺血的需求增加,以及无辐射暴露技术的需求增加等原因,UEA在静息和负荷超声心动图检查中的使用有可能在儿童人群中增加(甚至是仅用于LVO)[30]。先天性心脏病患者手术修复后心内交通通常会消失,因此右向左分流非常罕见。然而,在有交通的情况下,可能会发生右向左分流,并伴有肺动脉高压、右心功能不全或右心室顺应性减弱。因此在一些双心室或单心室的先天性心脏病患者,由于技术原因,无法很好地发现右向左分流的实际部位。通过心内交通的分流程度可能会因分流位置和负荷状态不同而异。尽管右向左分流的禁忌证最近已被消除,但FDA警告一开始的意图是针对在一些严重类型的先天性心脏病中可见的较大的右向左分流[38]。尽管取消了这一警告,但本研究组建议进一步研究以证实UEA在这一特定患者群体中的安全性。如下所述,在撰写本文件时,还没有评估儿科患者安全性的前瞻性试验完成,目前有一项关于Lumason在儿科超声心动图(ClinicalTrials.gov标识符NCT02282163)中的安全性和有效性的III期多中心临床评估正在进行。在不久的将来,随着儿科UEA临床应用的增加可能会给以后的研究带来更多的经验和安全数据。
目前还不清楚在获得儿科应用批准后,UEA最终用于儿科医疗的使用率如何,但由于儿科患者早期手术修复先天性心脏病的频率增加以及患病率增加,预计UEA在儿科患者的使用率会持续增加。写作组对儿科UAE应用的培训建议与成人UAE应用培训建议是一样的,需要在有UAE应用经验且已通过超声心动图Ⅲ级培训的心脏病专家的指导下进行50次的应用操作。目前儿科使用UAE研究的年龄下限为5岁,目前还没有关于5岁以下人群安全性的研究。
UEA用于儿科成像的要点和建议
目前,对儿童和青少年应用UAE是超适应证的。但对于5岁以上的儿童应用UAE是安全的,在多普勒信号不足(见2008年ASE共识文件的A.1.v节)以及采用标准组织谐波成像无法对左心室或右心室进行节段性室壁运动分析时,可考虑应用UAE(COR IIa, LOE B-NR)。
对于卵圆孔未闭和小的右向左分流的儿科和成人患者,应用UAE是安全的。而对于儿童和成年人大的右到左分流应用的安全性需要进一步研究。
表1 (超过1 000例患者的研究)和表2 (较小的焦点研究)显示了自2008年以来已发表的大量文献[7,8,9,10,12,13,14,15,16,17,19,20,21,22,23,24,28,29,30,31,32,33,34,60,123,124]。这些研究包括UAE在不同场景的使用:住院患者、门诊患者和重症患者,静息状态的成像以及运动或药物负荷超声心动图。大部分研究都是回顾性队列研究,其中大部分研究使用的是Definity或Optison这两种UEA。表1中接受UAE的受试者总人数超过250 000,其中包括了接受负荷超声心动图检查的患者、重症监护室患者和肺动脉高压患者。总体而言,与对照人群相比,心肌梗死率或死亡率没有增加。表2列出了2009年以来发表的小样本的研究,其中评估了<1 000例的登记受试者使用UAE的安全性。在两项单中心研究中回顾性分析了接受机械循环支持装置的危重病患者使用UAE的安全性、预防措施和获益31-32。对于特定患者人群,妊娠或<5岁儿童中使用UAE的安全性仍缺少研究报道。
自2016年以来,所有三家UAE厂家都宣布了FDA已去除UAE应用于已知或可疑右向左、双向或短暂右向左心脏分流患者的禁忌证。目前,已知或怀疑对全氟丙烷、血液、血液制品或白蛋白过敏是使用Optison的禁忌证,已知或怀疑对氟碳气体过敏是Definity的禁忌证(表3)。
2014年10月,FDA批准第三个UAE产品Lumason在成人超声心动图显影不佳时用于左心室显影并改善左心室内膜边界描绘[4]。2016年3月,Bracco Diagnostics还宣布FDA已经批准Lumason用于肝脏超声检查以判定成人和儿科患者的局灶性肝脏病变。尽管仅限于肝脏成像,但这一举措使得Lumason成为FDA批准用于儿科人群的第一个UEA。同时FDA还批准Lumason用于评估儿科患者疑似或已知的膀胱输尿管反流。在一项超过900例儿科患者中使用Lumason安全性研究的已发表文献中,只有1例儿科患者出现了非致命性过敏反应[3]。目前,对于六氟化硫脂质微球成分过敏反应史或Lumason任何非活性成分过敏的患者,禁止使用Lumason。
正如2014年ASE对比超声成像指南更新所述,这些最新的FDA变更遵循2008~2011年为Optison和Definity所制定的其他安全标签变更[38]。所有研究都表明,与UEA相关的危及生命的反应非常罕见,大约只有1/10 000。ASE建议并由Intersocietal Accreditation Commission负责制定了一项政策[5],以便及早发现并快速处理这些急性和严重反应,这项政策的内容是包括超声技师、注册护士、运动生理学家和医生都应该熟悉超声造影剂过敏反应的早期识别和适当的治疗。ASE和Intersocietal Accreditation Commission建议在使用任何造影剂之前制定类似政策,并在实施过程中对上述人员进行良好培训。在使用UEA的所有场所都应提供过敏试剂盒,并且在试剂盒上标有明确的过期时间。肾上腺素注射液(例如,EpiPen;Mylan Specialty;Basking Ridge,NJ)是这些试剂盒中最重要的组分,可以在患者过敏性休克时挽救生命。大多数造影剂相关过敏反应发生在使用超声造影时和使用后的30 min内。所发生的过敏性反应被认为是Ⅰ型过敏反应,称为补体激活相关过敏反应,其特征为皮肤红斑、荨麻疹、皮疹、呼吸困难、咽喉紧绷、潮红以及吞咽困难和(或)过敏性休克,其发病率很低,所报道的严重反应少于1/10 000[1]。使用Definity时有低概率发生临时性背痛,而通常在短时间内未经治疗能自发消退,其原因尚未了解,可能与脂质微泡在肾小球毛细血管内的滞留有关。白蛋白微泡例如Optison这种滞留发生明显少见[24]。
超声造影剂安全性的建议
大量文献(见表1和表2)证实UAE在非妊娠成人中使用的安全性。自2008年ASE对比剂共识声明(表6)以来,FDA对黑框警告的修改也支持了UAE安全性。
虽然过敏样反应很少,但常规使用UAE的实验室应制定相应政策,以便对可能出现严重副作用的患者进行紧急救治。
UAE可以安全地用于肺动脉高压和右向左分流患者 (COR I, LOE B-NR)。
在妊娠期或5岁以下的儿童中没有使用UAE的安全数据。因此,在安全数据出现之前,不推荐在这些人群中使用UAE。

FDA产品标签改变,2007到2017
FDA产品标签改变,2007到2017
| 年度 | 调整 | 备注 |
|---|---|---|
| 2007 | FDA 发布黑框警告 | 虽然确切的原因并未被证实,但是因为UCA使用后短期内副作用的发生,FDA 发布了黑框警告并增加肺高压和不稳定心肺疾病患者为禁忌证并且要求所有患者使用UCA后30 min需要监测 |
| 2008 | 黑框警告内容减少仅限于监测 | 对超声界系列发表文章的分析证实UCAs的安全性,FDA修改肺高压和不稳定心肺疾病患者的禁忌证为警告,并仅需对这部分患者进行监测。上市后安全性研究见参考文献[10,11,24] |
| 2011 | 去除Definity在监测、负荷试验中的黑框警告 | Definity标签在FDA分析风险研究的数据后修改,包括去除在肺高压和不稳定心肺疾病患者使用Definity后需要监护,以及声明并未确立Definity在负荷试验的有效性及安全性。参考文献[8,12,16,17] |
| 2012 | 去除Optison在监测、负荷试验中的黑框警告 | Optison标签改变跟Definity类似 (2011),FDA去除在肺高压和不稳定心肺疾病患者使用Optison后需要监护以及声明并未确立Optison在负荷试验的有效性及安全性。参考文献[17,21] |
| 2014 | FDA批准Lumason在美国使用 | 2014年10月:Lumason被FDA 批准用于成人左室显影以提高心内膜边界检出 |
| 2016-2017 | 去除右向左分流为禁忌证的黑框警告 | 2016年3月:Lumason获得FDA批准在成人或儿科肝脏疾病中应用2016年10月:Optison标签改变去除右向左分流禁忌证,只剩下经动脉注射的警告2016年12月:Lumason标签改变去除右向左分流禁忌证,FDA另外批准其用于儿科膀胱反流的评估Definity标签改变去除怀疑右向左分流,双向分流或短暂右向左心内分流的警告,参考文献[33,124] |
注:CPD:心肺疾病;CVD:心血管疾病;PH:肺动脉高压
现行的超声心动图培训标准在2015年出版的COCATS 5 Task Force 4文件中有详细描述[125]。希望获得灌注成像技能的医师应在具有MP评估专家的大规模中心进行进一步培训[1,38,126]。目前高级超声心动图培训标准正在编写,并将于近期出版。
在对节段室壁运动和射血分数进行床旁评估时,即使是经过超声培训的医师也常常面临困难心脏切面。医生需要进行关于如何使用UAE以及如何分析对比超声图像的具体培训。关于这种培训的建议和标准将会有很多文件进行规范。
2014年ASE超声医师指南支持超声医师进行静脉注射培训以便于UAE在医院和诊所的应用,以提高超声心动图的质量并提高效率[38]。根据当地医院政策不同,医疗中心对于符合进行静脉注射和造影剂使用资质的人员标准有所不同。
在北美的大多数中心,建立静脉注射通道和造影剂注射将由注册护士、医学技术人员、采血员或培训医师进行,其中的一些站点增加了对超声医师进行静脉注射的许可[38]。超声医师进行建立静脉通道和造影剂注射的培训需要医院批准、无菌技术和静脉解剖学知识以及相关风险意识。虽然严重的副作用非常罕见,但在使用造影剂时应始终有医生在场。欧洲和加拿大的两项单中心研究表明,超声医师主导的对比超声方案减少了决定造影剂使用到造影剂注射的时间,可以带来潜在的成本节省,并且通过声学造影超声心动图提高了效率[127,128]。这也强调了对UAE需求决策的培训必须成为超声医师教育的标准组成部分,并同时辅之以超声室执行对UAE应用的常规管理。
推荐
希望独立进行增强超声心动图检查的医师必须接受已通过Ⅲ级培训的人员的监督培训和操作。灌注成像培训需要接受进一步的关于静息和负荷灌注检查的操作和判读的培训(COR I, LOE C-EO)。
为了提高超声室的操作效率,超声医师应该接受建立静脉通道和增强剂注射使用方面的培训。建议将此技能纳入超声医学课程(COR I, LOE C-EO)。
新兴应用详见表7。

UEA的新兴应用
UEA的新兴应用
| 应用方向 | 需要用到的微泡 | 需要用到的超声仪器 | 特殊应用 |
|---|---|---|---|
| 溶栓 | 商业化/靶向性 | 间歇诊断高机械指数脉冲 | 急性冠脉综合征,缺血性卒中 |
| 分子成像 | 靶向/带有磷脂酰丝氨酸的商业化微泡* | 血池清除后高机械指数成像 | 缺血记忆成像斑块炎症早期斑块形成心肌炎/移植排异 |
| 靶向药物/基因输送 | 商业化/靶向性 | 弹丸注射后间歇诊断高机械指数脉冲 | 动脉粥样硬化的DNA/RNA传输,下肢缺血,心肌再生,靶向肿瘤治疗的抗血管新生 |
| 诊断超声介导空化效应 | 商业化 | 间歇诊断高机械指数脉冲 | 增加缺血下肢下游骨骼肌灌注(镰状细胞病)急性冠脉综合征后增加微循环灌注 |
注:DNA:脱氧核糖核苷酸;RNA:核糖核酸。*Sonazoid是唯一商业化的带有磷脂酰丝氨酸的微泡
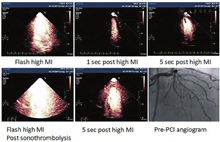
诊断性超声探头发出的间断性高机械指数脉冲超声溶解血管内血栓的潜能最初在犬动静脉移植血管血栓模型上得到验证。在这个实验中,低机械指数脉冲成像探测移植血管中微泡的同时给予间断高机械指数脉冲(均<1.9)[129]。高机械指数脉冲诱发了血管内的瞬时空化现象,从而形成了流体喷射,实现了机械溶解血栓[130]。高机械指数脉冲在没有任何促纤维蛋白溶解、抗血栓或抗血小板药物辅助的情况下实现了血管再通,这表明体外实验观察到的高机械指数脉冲的空化和辐照效应具有溶解血栓的能力。这项研究促进了后续关于高机械指数脉冲对猪急性ST段抬高心肌梗死模型的微血管和心外膜下大血管血流恢复功效的探索研究[131,132]。由于在诊断超声(DUS)检查时心外膜大血管不易观察,于是这些研究使用了VLMI微循环成像来指导高机械指数脉冲的使用时机。即使存在胸壁组织的衰减,这些研究同样证明了从诊断超声探头发出的间断性高机械指数脉冲可以增加心外膜冠脉再通率,从36%(单独使用半剂量的组织纤溶酶原激活物)到83%(同时使用诊断超声高机械指数脉冲结合微泡及半剂量组织纤溶酶原激活物)。此外,使用诊断超声高机械指数脉冲时,即使在未见心外膜冠脉再通的情况下,也可见ST段回落(表明微血管再通),这提示血管活性调节介质在恢复微循环血流及在心外膜冠脉血栓溶解中也发挥作用。随后的缺血性外周血管闭塞的研究也证实,即使存在上游血管闭塞的情况下,高机械指数脉冲能诱导一氧化氮的释放,从而促进微循环血流的恢复[133]。急性ST抬高心肌梗死患者的初步临床研究表明,超声引导的诊断性高机械指数脉冲(3 μs脉冲持续时间)以及通过静脉注射市售微泡足以提高早期心外膜大血管再通率及恢复微循环血流 (图18)[134]。目前正在进行的研究将检测诊断超声靶向超声溶栓技术在急性冠脉综合征和缺血性脑卒中应用中的安全性及有效性。

UEA由微泡组成,可作为游离的血管腔内示踪剂,但亦可将配体装配到其表面使其与功能异常的血管内皮细胞结合,通过特殊的增强剂显影模式进行成像,从而达到诊断和治疗目的。常见方法是将一种新型的分子探针与传统的非侵入性增强成像方法相结合[135]。虽然临床转化进展缓慢,但分子成像可通过疾病早期诊断和指导治疗选择,有效提高疗效和改善预后。分子成像技术也被应用于临床前研究,以评估新治疗方法中靶向与脱靶的效应,并确定干预的新途径。
靶向声学对比剂分子成像主要依赖于从几百纳米到几微米不等的几种不同类型分子靶向微泡对于不同疾病位点的选择性滞留。对微泡外壳进行修饰是相对简单的试剂制备方法,使其在传统显影成像时产生高强度信号,同时静脉注射后快速从循环中清除。后者尤为重要,因为对于靶向滞留微泡的信号识别通常是在游离的未黏附微泡被循环清除后完成的。由于大部分声学造影剂均局限于血管腔内,所以UEA主要是针对血管内或血管内皮细胞表面发生的病变或事件[136]。
靶向超声显影目前有两种常用策略。一种简单的方法是选择可促使微泡对白细胞附着,或与疾病区域中激活的内皮细胞附着的微泡壳成分。带有磷脂酰丝氨酸的脂质壳微泡在这方面已被证明是非常有效的,并且最近已被证明可作为检测近期心肌缺血的一种简单的无创检查手段[137]。在本文件出版时,类似的制剂均未被美国或欧洲批准,而Sonazoid(一种含有磷脂酰的微泡)在日本则被应用于非心脏成像。
更特异的靶向是使微泡表面连接上密度达到每平方毫米数千个的共轭配体(通常在分子间隔臂末端)。配体/靶分子结合的密度和键合动力学必须足以抵抗血管的血流剪切应力[138]。微泡靶向血管内皮黏附分子和其他活性内皮标记物(血管细胞黏附分子-1、细胞间黏附因子-1、选择性蛋白、整合素)已被应用于检测潜在的动脉粥样硬化或潜在的斑块炎症表型[139,140,141,142,143]。
这些制剂中部分已被应用于心肌缺血、移植排异、心肌炎和新生血管的成像[144,145,146,147,148,149,150,151]。靶向纤维蛋白、凝血系统的血小板成分(糖蛋白Ⅱb/Ⅲa,糖蛋白Ⅰb)、von Willebrand因子的微泡被用于识别心腔和动脉血栓、微血栓、或血小板的促血栓或促炎症潜能等情况[141,152,153]。微泡针对特定亚群的单核细胞也被应用于缺血相关性血管重构的成像中[148]。靶向微泡也被应用于增强超声治疗效果的临床前研究,比如干细胞或基因(质粒互补脱氧核糖核酸)的靶向转染或增强声学溶栓效果[154,155,156]。
靶向基因和药物可以通过超声无创性破坏经静脉注射的载体微泡UEA来进行靶向传输,被称为超声靶向微泡破坏(UTMD)。虽然单独超声波能量也能通过超声打孔(空化诱导的过洞形成或渗透性改变)以及通过活性细胞的吸收来促进基因转染,但额外使用微泡可降低超声空化的阈值,显著提高了转染效率,特别是当基因或核酸与微泡表面直接结合或电荷耦合发生时[156,157,158,159]。传输和转染的发生存在几种机制,包括瞬态空隙形成和激活钙介导的细胞吸收,这两种机制都可能是与空泡相关的剪切力、微射流、冲击波和压力相关的细胞形变的结果[160,161]。UTMD可通过触发DUS使载体微泡在破坏性脉冲间期再充填组织,创造理想声学环境以利于惯性空化(高声功率或MI,低发射频率)[162]。由于载体微泡是纯血管内的,转染和传递主要发生在声波穿透组织的血管内皮,但是也能够发生血管外转染和传递。从安全性考虑,研究表明,高水平的转染可以发生在恰好产生有害的生物学效应的声学压力水平之下[156],而在超声辐照的区域外无远程转染发生[163,164,165],这显示了UTMD靶向传递的特性。此外,许多临床前研究都使用了商业化的诊断超声探头的高机械指数脉冲来实现UTMD和靶向药物的运输。
虽然最初在体UTMD基因转染的研究都使用的是重组腺病毒[166],但在随后的研究中更多的使用了质粒脱氧核糖核酸,最近更多的研究还使用了其他核酸,比如小干扰核糖核酸[167]和微核糖核酸[168]。到目前为止,针对UTMD应用于治疗上的研究仅限于在临床前的各种疾病的动物模型中进行,包括心血管病、癌症和肝、肾、脑部疾病。在心血管疾病中,许多不同治疗性基因的UTMD治疗已被成功应用于急性心肌梗死[169]、慢性心肌梗死、缺血性心肌病[170]、扩张型心肌病[171,172,173]和PAD模型中[174],并在Ⅰ型糖尿病的动物模型恢复了胰腺的内分泌功能[175]。考虑到适度的转染效率,UTMD最显著的优势是即使当大部分细胞不能被转染时,旁分泌因子或携带着重要效应的基因仍然能被转染[171,176]。对于UTMD在心血管关于基因和药物传输的应用的综述不在本文件的涉及范围内,但是,在过去几年里已发表了数个高水平的综述[177,178]。虽然UTMD与其他的基因转染技术相比有潜在优势,包括它的无创性及多基因治疗的特性[169,170],但是正在进行的工作重点在于通过使用更新的载体来延长转染或促进染色体插入来提高转染效率。
在美国,与诊断相关的群体下,医疗保险和医疗救助服务中心(和大多数私人商业支付者)可报销医院支付的住院患者管理费用。在这个系统下,特定的诊断或临床情况与基本的住院费用报销相关,因此鼓励医院可以提供最有效的治疗。关于UEA的成本效益可以在具体情况下进行考察,如下所述。
超声心动图是一种高效的诊断方法,来自于成像平台成本相对低(与放射性核素示踪剂成像、CT、CMRI和心导管检查相比)、工作人员数量要求低(每次检查一名超声检查人员)、低廉的耗材成本、便携式检查的可能性,并且具有良好的重复性和高通量。在医院门诊,超声增强剂的使用可由医保和第三方付款人报销(C8929,经胸心脏超声使用增强剂和C8930,负荷经胸心脏超声与增强和心电图监测)。截至2017年,这些超声增强检查比没有做增强的相同检查多报销约200美元。尽管这些造影剂没有分开报销,但在技术难度大的超声心动图检查的住院患者中,使用超声增强剂会提高成本效益。在一项对632例技术难度较大的超声心动图检查的患者进行的研究中,他们每人都接受了第二次增强检查,超声增强剂将技术困难检查率从87%降至10%,导致36%的患者在管理上发生重大变化(避免了下游诊断检查,重要的用药变化,或两者兼备)[26]。
在全部队列中,增强检查的成本是39 184美元,未使用超声增强检查(经胸心脏超声检查和核素心肌检查)的总费用是116 094美元,总共节省了76 910美元,每位患者节省122美元。值得注意的是,住院患者管理的影响大于门诊患者,而且住院患者的成本节约可能明显高于上述报告的整体人群的成本节约程度。
诊断技术的成本效益基于初始成本、获得诊断结果的频率以及诊断和预后情况判断的准确性。缺乏确切的诊断结果会导致更多的下游检查,这会增加特定策略的成本。上一节清楚地表明,当超声增强剂用于左心室造影时,诊断检查频率降低,导致下游成本降低。阴性检查结果显示硬终点事件和血运重建率最低,因此准确性的提高可筛选更合适的患者进行冠状动脉造影。还有证据显示,在负荷超声心动图中增加灌注评估进一步提高了冠心病诊断和预后的准确性。在最近的一项研究中,与室壁运动相比,灌注评估将冠心病检出的阳性预测值从83%提高到90%,并且提高了预后的评估[60]。在一项大型随机对照研究中,比较了以RTMCE进行灌注和功能评估与仅对室壁运动评估的非MCE超声心动图检查,发现灌注技术可识别出更多的血流限制性冠心病,这可转化为临床预后的改善[45]。虽然没有进行正式的成本分析,但基于与室壁运动相比,灌注技术提高了诊断和预后准确性,灌注技术很可能是节省成本的,尽管LVO负荷超声心动图与灌注负荷超声心动图的初始成本对于计算成本效益是至关重要的。最近一项在手术(肾脏和肝脏移植)之前进行术前风险评估的研究已经证明,在多巴酚丁胺负荷试验中,灌注结合室壁运动成像在预测不良心血管结果方面具有增量价值[180,181]。
心肌灌注成像可以提高急诊胸痛患者的成本效益这一概念最初是通过SPECT确立的[182],这一情形的成本效益是基于排除心源性胸痛患者的能力以及快速识别急性冠脉综合征治疗可能获益的患者[183]。MCE检查为急诊患者提供了一种更加实用的灌注成像方法,因为它能够在床边快速执行,比SPECT检查便宜,并且能够向临床医生提供即时信息。在急诊室中执行时,MCE同时观察室壁运动和灌注已被证明对诸如患者危险分层的标准临床数据提供了增量价值[184]。因此,MCE检查预计会为急诊就诊患者节约大约900美元,大多数是由于避免了不必要的住院治疗和额外的心血管检查[60]。
在重症监护室中,关于UEA的影响的数据有限。在左心室辅助装置治疗后一系列超声心动图评估中,图像质量通常很差,新出现的证据表明使用UEA会改变大于40%的病例管理,包括调整泵的速度和检测到泵的血栓形成[31]。
要点和推荐
在所有检查图像有困难的住院患者中推荐使用UEA(COR I, LOE B-NR)。虽然在住院患者中没有提供UEA单独报销,但由于避免了下游诊断检查,包括经胸心脏超声检查和心肌核素检查,总体费用是节省的。额外的成本效益研究是必要的,包括评估增强超声心动图对住院时间的影响。
当超声心动图室医师在灌注成像方面经过充分培训后,MCE可用于负荷超声心动图(COR IIa, LOE B-R),并且对心电图不能得出诊断性结论的急诊胸痛患者也应使用MCE进行心肌灌注和节段性室壁运动的评估(COR IIa, LOE B-NR)。
需要更多的临床研究来评估重症监护中UEA的影响。
自2008年美国超声心动图协会共识声明发表以来[1],出现了重大的临床发展,包括发表了有关超声增强剂在几种临床环境中用于改善左室显影的安全性和有效性的文献,以及去除和(或)减少先前的使用禁忌证,提供新的临床数据以支持在儿科中使用和未批准的适应证,例如心肌灌注成像和治疗性溶栓。事实上,关于灌注成像的数据非常引人注目,以致欧洲指南建议将超声增强剂作为稳定胸痛患者的评估方法[185]。最近的一项Meta分析表明,与正常灌注相比,在运动负荷、多巴酚丁胺试验或血管扩张剂负荷显像中MCE出现异常灌注,心脏事件的风险增强5倍,且试验间异质性低[186]。表8比较了假设的美国医疗保险患者进行负荷MCE和灌注负荷SPECT可获得的信息、成本和风险。

实时负荷心肌灌注对比超声心动图与负荷SPECT的信息比较
实时负荷心肌灌注对比超声心动图与负荷SPECT的信息比较
| 操作 | 分辨率 | 预后的数据? | 负荷后LVEF? | 静息LVEF | 舒张功能 | 费用 | 射线量 |
|---|---|---|---|---|---|---|---|
| 负荷RTMCE | 3 mm | 是 | 是 | 是 | 是 | $309.36 | 0 |
| 负荷SPECT | 10 mm | 是 | 否 | 否 | 否 | $1,600.74 | 15.6 mSv[187] |
注:LVEF:左室射血分数
在美国,已为心肌灌注使用UEA(目前程序术语代码+ 0439T)建立了一个独特的附加收费代码,写作组建议在具有超声增强剂使用经验的实验室中使用此代码,尤其是评估胸痛或气短的静息检查,以及在负荷超声心动图或存活心肌检测过程中。在那些没有足够经验但有使用UEA进行左室显影指征的实验室中,建议获得经验以提供最先进的且符合国家认证标准的增强超声心动图检查。此外,大小型系统的超声供应商必须齐心协力,提供仪器面板预设,使用户能够更轻松地使用针对左室显影和灌注优化的成像预设和功能。
有关微泡物理学、UEA管理协议和政策以及左心造影和MP成像技术和技巧的其他教育材料可以在http://www.asecho.org/contrast找到。随着对超声增强剂使用成本效益、灌注成像、超声溶栓、分子成像以及靶向药物和基因递送等领域临床研究的进一步开展,预计指南会有进一步的更新。随着越来越多的心脏科医师、重症监护和急诊监护室医师使用超声增强剂来提高诊断能力,写作组强调供应商急需改进其现有系统(包括便携式系统)的VLMI成像协议和预设。
本指南感谢谢峰教授在图表和录像上的帮助,以及Carol Gould在准备文稿中的贡献


























