
恶性肿瘤的发生、发展是一个不断演进的过程,其具有侵袭、浸润和转移的基本生物学特征。WASP家族作为一类新型的肌动蛋白调节蛋白,是参与维持肌动蛋白细胞骨架的基本形态的关键成分,在维持细胞基础结构、细胞运动、细胞信号传导等在内的各种细胞过程中发挥着重要作用,同时也可介导肿瘤细胞的增殖、侵袭和转移。本文综述了WASP家族在肿瘤发生、发展中的作用,以及在不同肿瘤中的表达情况及其相关信号通路,提示WASP家族在肿瘤的发生及进展中存在广阔的研究空间,对于WASP家族在各种肿瘤中的机制研究、预后预测、甚至治疗等方面均有着重要意义。

本刊2022年版权归中国全科医学杂志社所有
未经编辑部许可,不得任意转载和摘编
本刊所发表作品仅为作者观点,并不代表编委会和编辑部意见
如有印装质量问题请向本刊发行部调换
WASP家族是一类新型的肌动蛋白调节蛋白[1],通过与肌动蛋白调节因子2/3(Arp2/3)相互作用,促进肌动蛋白分支点形成,并招募肌动蛋白单体相互聚合形成肌动蛋白分支,从而参与维持肌动蛋白细胞骨架的基本形态[2]。在胞质中,WASP家族可作为细胞骨架的关键成分参与包括维持细胞基础结构、细胞运动[3]、细胞信号传导等在内的各种细胞过程[4];也可促进侵袭性伪足形成和促进细胞内基质降解从而介导肿瘤细胞的侵袭和转移[5];目前已在血液系统肿瘤(白血病、淋巴瘤)及多种实体肿瘤(乳腺癌、肝细胞癌、食管鳞状细胞癌等)中发现其异常表达,并参与多种肿瘤的侵袭和转移。本文总结了WASP家族在多种肿瘤中的表达情况及其在肿瘤发生、发展中的作用,以及涉及的相关信号通路,并对WASP家族目前在肿瘤性疾病中的研究进行了讨论和展望。
WASP家族包括5个亚家族共8个成员[6]:WASP、N-WASP(也称为WASL);WAVE1-WAVE3(也称为SCAR1-SCAR3或WASF1-WASF3);WHAMM;WASH;YMY。虽然每个亚家族的结构各有特点,但是在结构上均具有两个基本结构域:PRD结构域和VCA结构域。VCA结构域高度保守,是发挥功能的主要结构域,通过与肌动蛋白结合蛋白2(Arp2)和肌动蛋白结合蛋白3(Arp3)结合,促使肌动蛋白单体聚合形成肌动蛋白分支,参与维持细胞基础结构、细胞运动、细胞信号传导等在内的一系列细胞过程。
WASP家族广泛表达于各种组织细胞中,具有参与调控细胞迁移/侵袭、细胞间黏附、内吞/吞噬、胞质分裂和胞内膜转运、伪足的形成、高尔基体、内质网和溶酶体内囊泡的生成等重要细胞功能[7]。有研究发现,WASP家族在促进中心体肌动蛋白运动、细胞膜重塑[8]和促进自噬体形成[9]等方面也具有重要作用。近年来随着某些WASP家族成员在细胞核中被发现,其作为组装表观遗传和转录机制的分子平台,影响基因表达的功能也逐渐被发现[6]。
除了以上的共同作用以外,WASP家族其他成员各自具备独特的生理作用,现将其生理功能总结如表1。

WASP家族生理功能
Physiological functions of WASP family
WASP家族生理功能
Physiological functions of WASP family
| WASP家族 | 特殊生理作用 | 共同生理作用 |
|---|---|---|
| WASP | 细胞毒性[4] | 促进肌动蛋白聚合[8]调节细胞骨架、维持细胞基础结构[8]细胞迁移、运动[10]促进侵袭性伪足形成[10] |
| 受体信号传导[7] | ||
| 促进淋巴细胞和髓细胞迁移[11] | ||
| T淋巴细胞的免疫突触形成[12,13] | ||
| 单核细胞的吞噬[11] | ||
| N-WASP | 调节肠上皮分化[14] | |
| 维持正常组织结构的完整性[14] | ||
| 调节成肌细胞与细胞之间的融合[15] | ||
| 调节少突细胞髓鞘形成[16] | ||
| 宿主-病原体相互作用[17] | ||
| 寄生虫感染[17] | ||
| 基质重塑过程[18] | ||
| 血管内皮细胞迁移及血管新生[19] | ||
| WHAMY | 维持高尔基体结构[20] | |
| 维持胞内物质运输过程[20] | ||
| 促进细胞自噬体形成[9] | ||
| 细胞减数分裂过程[21] | ||
| WASH | 细胞减数分裂过程[22] | |
| YMY | 影响血睾屏障功能[23] | |
| 干扰精子发生过程[23] |
恶性肿瘤的进展过程包括原位增殖、局部浸润和远处转移,目前认为解除肌动蛋白动力学的信号通路调控是癌症进展和转移过程的开始。WASP家族可促进肌动蛋白组装、下调钙黏蛋白表达、降低细胞黏附、促进细胞的迁移和运动[10],也可降解细胞外基质、促进层状伪足和丝状伪足等侵袭性伪足的形成。因此,WASP家族在肿瘤的浸润和转移中发挥着重要作用。
肿瘤的局部浸润具体分为以下4个步骤:肿瘤细胞之间的黏附力减弱、肿瘤细胞与基底膜和细胞外基质黏附力增强、肿瘤细胞降解基底膜及细胞外基质、肿瘤细胞阿米巴运动游出。WASP家族可通过参与细胞黏附、降解细胞外基质参与肿瘤细胞的浸润(表2)。

WASP家族在肿瘤中的作用及机制
Role and mechanism of WASP family in cancer formation and progression
WASP家族在肿瘤中的作用及机制
Role and mechanism of WASP family in cancer formation and progression
| 作用 | 机制 |
|---|---|
| 参与细胞黏附 | 激活Arp2/3复合物,促进肌动蛋白结构形成[23] |
| WasC通过阻断VCA结构域的活性抑制F-肌动蛋白聚合从而抑制细胞之间的黏附作用[24] | |
| 降解细胞外基质 | WAVE3激活NFκB通路和MAPK信号通路,从而激活基质金属蛋白酶MMP[26] |
| 促进血管新生 | WASP重组细胞骨架,促进血管内皮细胞移行[29] |
| WASP通过激活MMP,启动内皮细胞的激活和迁移,稳定新生血管[27] | |
| N-WASP磷酸化从而促进血管内皮细胞迁移及血管新生[30] | |
| 促进细胞运动 | N-WASP在甲状腺激素刺激下,激活FAK/paxillin/cortactin/N-WASP/Arp2/3复合信号通路,增强细胞运动能力[33] |
| 肌动球蛋白介导的细胞收缩为细胞体向前运动提供能量,为胞体前缘产生收缩力,从而促进胞体与基质分离[31] | |
| 促进形成侵袭性伪足 | 在Rac和Cdc42调节下,促进质膜突起形成层状伪足和丝状伪足[36,37] |
| 参与肿瘤免疫 | 参与免疫突触的形成和T淋巴细胞发育[39,40] |
| 调节BCR信号通路和抗原内化提呈过程[41,42] | |
| 影响巨噬细胞的趋化作用和吞噬作用[44] | |
| N-WASP通过NF-κB和MAPK的信号通路,影响炎性因子表达水平[45] | |
| 参与肿瘤代谢 | 与TRIM21形成螯合物,从而保持PFK的活性,促进糖酵解过程[47] |
| 通过Rac1/ROS信号通路促进活性氧(ROS)的生成[49] | |
| 参与肿瘤死亡 | WAVE3激活AKT促存活信号通路,加强肿瘤细胞对凋亡信号和TNF-α介导的细胞死亡信号的敏感性,从而促进肿瘤细胞的凋亡和死亡[50] |
| WAVE2通过Rac1/ROS信号通路促进活性氧(ROS)生成[49] | |
| WASP缺陷时,在CD24交联诱导下使细胞凋亡增强[51] | |
| 促进自噬小体形成[52] | |
| 参与肿瘤耐药 | 通过Beclin1/Bcl-2和Beclin1/PI3K-Ⅲ复合物途径增强白血病细胞的存活和调节化疗耐药[53] |
(1)对WASP家族的功能生理功能和独特生理功能进行总结,利于探寻和发现目前WASP家族中各蛋白尚未发现的功能;(2)从肿瘤浸润和转移的具体过程对WASP家族在肿瘤中的作用进行总结和分析,利于进一步研究WASP家族在不同肿瘤生长调节中的作用和机制;(3)以肿瘤发生的不同系统划分,总结WASP在不同肿瘤中的表达情况和发病机制,有利于今后探寻WASP家族在具体肿瘤中的作用机制。
(1)WASP家族在肿瘤中的作用研究相关资料多为WASP、N-WASP及WAVE亚家族,对于其他亚家族在肿瘤发生发展中的作用相关资料不足;(2)WASP家族在神经系统肿瘤、循环系统肿瘤、骨肿瘤等其他系统肿瘤方面资料不足;(3)WASP家族相关的具体肿瘤靶向治疗方法或药物还鲜见报道。
N-WASP激活Arp2/3复合物调节肌动蛋白聚合,该过程可促进丝状体等富含肌动蛋白结构的形成,这些富含肌动蛋白的结构在细胞黏附中起着关键作用[24]。JEON等[25]研究发现,与野生型细胞相比,缺乏WASP的细胞常具有更强的细胞黏附性,WasC可通过阻断VCA结构域的活性抑制F-肌动蛋白聚合从而抑制细胞之间的黏附作用,这一发现与SCHELL等[26]的研究结果相似,其通过肾脏模型发现N-WASP-Arp2/3决定了复杂树状足细胞突起在体内外的发育,肌动球蛋白细胞骨架的过度激活和成熟反而使足细胞的黏附效率降低,导致足细胞的分离。因此WASP家族是介导细胞黏附的负性调控因子,当WASP家族表达升高时,细胞之间黏附作用下降、细胞脱落,为肿瘤细胞的侵袭提供结构基础。
90%的肿瘤患者死亡是因为肿瘤转移导致的[29],肿瘤转移是一个复杂得多步骤过程,包括原发瘤增殖扩展、肿瘤血管形成、癌细胞运动迁移侵入基质、形成伪足进入脉管系统、癌栓形成、继发组织器官定位生长和转移癌继续扩散7个步骤。WASP家族可通过促进肿瘤血管新生、肿瘤细胞运动、侵袭性伪足形成从而促进肿瘤细胞的转移(表2)。
肿瘤血管生成是一个极其复杂的过程,包括血管内皮基质降解、内皮细胞移行、内皮细胞增殖、内皮细胞管道化分支形成血管环和形成新的基底膜等步骤。WASP家族作为重排细胞骨架的关键因子,可促进血管内皮细胞移行[30];WASP家族激活MMP[28]后通过降解基底膜糖蛋白及细胞外基质成分,启动内皮细胞的激活和迁移功能,在整合素家族协助下,介导血管内皮细胞的迁移和黏附,有助于新生血管的成熟和稳定。
肿瘤细胞在基质中的运动由4个循环往复的步骤组成,即头部伪足的形成和延伸、新黏附位点的建立、胞体的收缩以及尾部的退缩,通过不断重复的4个过程向前运动和迁移。肌动球蛋白介导的细胞收缩不仅为细胞体向前运动提供能量,还在胞体前缘产生收缩力,从而促进胞体与基质分离,促进胞体运动[31]。肌动蛋白细胞骨架在介导细胞迁移运动过程中发挥着重要作用[32]。UZAIR等[33]发现,N-WASP在甲状腺激素刺激下,通过FAK/paxillin/cortactin/N-WASP/Arp2/3信号通路增加细胞的运动能力,从而增加迁移率;ASHISH等[24]通过对N-WASP+/+和N-WASP-/-小鼠胚胎成纤维细胞迁移过程进行研究发现,N-WASP-/-细胞比N-WASP+/+细胞迁移更快,N-WASP的缺乏可导致对纤维连接蛋白的黏附减少和细胞活力增加,从而促进细胞的运动和迁移。同样的,MORRIS等[14]通过在大肠癌小鼠模型中也发现了N-WASP的缺失将导致肠上皮细胞迁移增加。因此,WASP家族在肿瘤细胞的运动和迁移中起着重要作用,为肿瘤细胞的远处转移提供条件。
WASP家族可以促进肌动蛋白细胞骨架重构,而肌动蛋白细胞骨架重构在免疫调节中发挥着重要作用,其与多种免疫细胞(包括T淋巴细胞、B淋巴细胞、巨噬细胞等)的功能密切相关[38]。细胞免疫是肿瘤免疫应答的主要方式,WASP家族参与免疫突触的形成[39]和T淋巴细胞发育[40],进而影响T淋巴细胞功能;另一方面,体液免疫在肿瘤免疫应答中起着协同作用,WASP家族可通过调节BCR信号通路[41]和抗原内化、提呈[42]过程影响B淋巴细胞功能,并且WASP也是抗原内化和提呈的重要因子[43];此外,肌动蛋白细胞骨架重构对巨噬细胞的趋化作用和吞噬作用[44]也有一定的影响。WANG等[45]研究发现,敲除小鼠N-WASP基因表达后,将显著激活NF-κB和MAPK的信号通路,并且白介素6(IL-6)、白介素8(IL-8)、超氧化物歧化酶2(SOD2)和前列腺素内过氧化物合酶2(PTGS2)等炎性因子的表达水平也显著上调,促使小鼠发生炎性反应。因此,WASP家族在免疫调节中发挥着重要作用(表2)。
肿瘤细胞通常通过糖酵解维持代谢,磷酸果糖激酶(PFK)是糖酵解过程中的关键酶[46],而E3泛素化蛋白质连接酶TRIM21可以降解PFK。有研究发现,细胞骨架中的肌动蛋白能够与TRIM21形成螯合物,从而保持PFK的活性,促进糖酵解过程,为肿瘤代谢提供能量[47],因而细胞骨架具有调节糖酵解的作用[48]。当WASP被激活时,通过促进肌动蛋白相互聚合,提高肌动蛋白表达水平,促进其与TRIM21的螯合作用,促使糖酵解增强,为肿瘤细胞代谢提供能量。此外,WAVE2可通过Rac1/ROS信号通路促进活性氧(ROS)的生成[49],过多的ROS对细胞结果造成严重损害,从而参与一系列代谢过程(表2)。
WASP家族所导致的肿瘤细胞死亡主要通过促进细胞凋亡和自噬小体形成。一方面,WAVE3通过激活AKT促存活信号通路增强肿瘤细胞对凋亡信号和TNF-α介导的细胞死亡信号的敏感性,从而促进肿瘤细胞的凋亡和死亡[50];另一方面,WASP家族可促进ROS生成[49]:第一,高水平的ROS刺激死亡受体通路,引起细胞凋亡;第二,过量的ROS诱导线粒体外膜孔开放,释放钙离子、细胞色素C、凋亡诱导因子AIF,引起胱冬蛋白酶caspase9激活caspase3/6/7;使线粒体电子传递链解耦联,下调ATP水平,上调促凋亡蛋白Bax的表达,最后使线粒体外膜破裂,导致细胞凋亡;第三,ROS使Src/Ras/蛋白激酶p38-MAPK和蛋白激酶JNK过度激活,氧化损伤转录因子cMyb、Sp-1、EGR-1、缺氧诱导因子HIF-1、AP-1等的半胱氨酸-SH基,使其丧失与靶基因启动子的结合力,抑制靶基因表达,促进细胞凋亡。SATO等[51]利用基于同源重组的基因靶向和细胞通透性重组WASP的功能研究发现,在CD24交联诱导下,WASP缺陷的细胞出现凋亡增强;ZHANG等[52]发现,下调WAVE1表达后,自噬标记物微管相关蛋白轻链3(LC3-Ⅱ)的表达上调、自噬小体形成增多,并且WAVE1表达下调可使白血病细胞对化疗和凋亡的敏感性增强,因此WAVE1是一种重要的促自噬蛋白,并通过Beclin1/Bcl-2和Beclin1/PI3K-Ⅲ复合物途径增强白血病细胞的存活和参与化疗耐药。慢性髓细胞白血病中,BCR-ABL1负性调控WASP的表达,影响试验药物或化疗药物诱导的肿瘤细胞凋亡敏感性,参与肿瘤耐药的产生[53](表2)。
目前WASP家族在白血病中的研究包括慢性髓细胞白血病(chronic myelocytic leukemia,CML)和幼年型粒单核细胞白血病(juvenile myelomonocytic leukemia,JMML)。PEREIRA等[53]研究发现,在CML发生、发展过程中,随着病情进展,WASP的表达逐渐降低,在急变期达最低水平,且与BCR-ABL1的表达呈负相关;在CML晚期患者中,低水平的WASP与患者较差的总体生存率相关。虽然BCR-ABL1酪氨酸激酶抑制剂(TKIs)的发现彻底改变了CML患者的治疗方法,但是对于CML晚期患者而言,由于BCR-ABL1水平升高和基因组不稳定性增加导致继发性致癌修饰,因此TKIs常无效,但是在BCR-ABL1阳性的K562细胞中若强制表达WASP,将增加TKIs诱导的细胞凋亡的易感性,并在体内外对BCR-ABL1诱导的肿瘤产生负性调节。这一发现或许可为将来CML晚期患者研发新药物提供新思路(表3)。
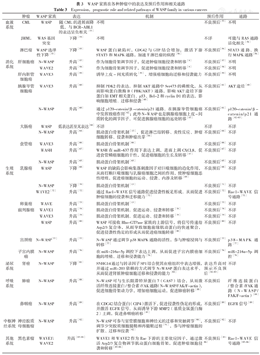
WASP家族在各种肿瘤中的表达及预后作用和相关通路
Expression,prognostic role and related pathways of WASP family in various cancers
WASP家族在各种肿瘤中的表达及预后作用和相关通路
Expression,prognostic role and related pathways of WASP family in various cancers
| 肿瘤 | WASP家族 | 表达 | 机制 | 预后作用 | 通路 | |
|---|---|---|---|---|---|---|
| 血液系统 | CML | WASP | 随CML的进展而降低,与BCR-ABL1的表达呈负相关[53] | 不明 | 不良预后[53] | 不明 |
| JMML | WAS基因突变 | 下降[54] | 不明 | 不详 | 可能与RAS通路活化相关[54] | |
| 淋巴瘤 | WASP选择性下降[55] | 下降[55] | WASP蛋白缺陷时,CDC42与GTP结合增加,激活下游STAT3和MAPK通路,加速T淋巴瘤的病程[56] | 不良预后[56] | STAT3通路、换行MAPK通路[56] | |
| 消化系统 | 肝细胞癌 | N-WASP | 升高[57] | 作为细胞骨架调节因子,促进肿瘤细胞侵袭和转移[9] | 不良预后[57] | 不明 |
| WAVE2 | 升高[58] | 作为细胞骨架调节因子,促进肿瘤细胞侵袭和转移[9] | 不良预后[58] | 不明 | ||
| 肝内胆管细胞癌 | WAVE3 | 升高[59] | 诱导上皮-间充质转化[59],增强癌细胞的迁移和侵袭能力 | 不良预后[59] | 不明 | |
| 胰腺导管细胞癌 | WAVE3 | 升高[60] | 抑制PDK2的表达,抑制AKT通路中Ser473的磷酸化,从而影响蛋白激酶B(PBK/AKT)通路,影响AKT途径下游蛋白如EMT相关蛋白、p53、Bcl-2和cyclin D1的表达,影响细胞增殖、迁移和侵袭[60] | 不良预后[61] | AKT途径[60] | |
| N-WASP | 升高[60] | 通过p120-catenin/β-catenin/p21通路,在胰腺导管细胞癌中发挥致癌作用[62];此外N-WASP也是胰腺癌细胞上皮-间质转化的调节因子,可促进胰腺癌细胞的远处转移[63] | 不良预后[61] | p120-catenin/β-catenin/p21通路[62,63] | ||
| 大肠癌 | WASP | 低表达甚至无表达[64] | 不详 | 不详 | 不详 | |
| N-WASP | 升高[64] | 肌动蛋白骨架机制[13],促进淋巴结转移、炎性反应、肿瘤细胞转移、侵袭和肿瘤出芽[64] | 不良预后[64] | 不详 | ||
| 食管癌 | WAVE3 | 升高[66] | 肌动蛋白骨架机制[66] | 不良预后[66] | 不详 | |
| WASH | 升高[67] | WASH在miR-637作用下表达上调,进而上调CXCL8,促进食管鳞癌细胞的干性,促进癌细胞的生长及转移[67] | 不良预后[67] | 不详 | ||
| N-WASP | 升高[65] | 肌动蛋白骨架机制[65] | 不良预后[65] | 不详 | ||
| 生殖系统 | 乳腺癌 | WASP | 下降[68] | WASP的缺陷会影响集落刺激因子对巨噬细胞的趋化作用,从而打断巨噬细胞与乳腺癌细胞之间的作用,使肿瘤细胞恶性增殖,促进癌细胞的运动、侵袭、内渗及转移[69] | 不良预后[68] | 不详 |
| N-WASP | 下降[70] | 肌动蛋白骨架机制[13] | 不良预后[71] | 不详 | ||
| WAVE2[72] | 升高[72] | 通过Rac1-WAVE信号通路促进侵袭性板足形成,从而促进肿瘤细胞的侵袭和迁移能力[72] | 不良预后[72] | Rac1-WAVE信号通路[72] | ||
| 卵巢癌 | WAVE | 升高[75] | 肌动蛋白骨架机制[13] | 不良预后[75] | 不详 | |
| 前列腺癌 | WAVE1 | 升高[78] | 肌动蛋白骨架机制,促进运动、侵袭和转移[78] | 不良预后[78] | 不详 | |
| WAVE3 | 升高[79] | 肌动蛋白骨架机制,促进运动、侵袭和转移[79] | 不良预后[79] | 不详 | ||
| WASP | 升高[80] | WASP可接收Rho-GTPase家族的上游信号,将信号传递给Arp2/3复合体,从而导致细胞前缘肌动蛋白的快速聚合,促进侵袭性伪足的形成从而促进癌细胞转移[80] | 不良预后[80] | 不详 | ||
| 宫颈癌 | N-WASP[77] | 升高[77] | N-WASP通过调节p38 MAPK通路的活性,参与肿瘤浸润与转移[77] | 不良预后[77] | p38-MAPK通路[77] | |
| 子宫内膜癌 | N-WASP | 升高[76] | 在miR-216a-5p调控下表达上调,从而促进子宫内膜癌细胞的增殖、迁移和侵袭能力[76] | 不良预后[76] | miR-216a-5p调控[76] | |
| 泌尿系统 | 肾癌 | N-WASP | 下降[81] | SNHG14通过与转录因子SP1结合使其在癌组织中表达增强,并通过miR-203依赖的方式调节N-WASP蛋白表达水平,从而促进肾脏肿瘤细胞迁移和侵袭的能力[84] | 表达升高时预示不良预后[82,83] | 不详 |
| 呼吸系统 | 肺癌 | N-WASP | 升高[88] | N-WASP可与生长阻滞特异蛋白7(GAS7)结合,从而激活纤维连接蛋白/整合素/FAK通路(N-WASP/FAK/F-actin),促进细胞骨架动力学,增加癌细胞运动,促进肺癌转移[88] | 不良预后 | 纤维连接蛋白/整合素/FAK通路(N-WASP/FAK/F-actin)[88] |
| 鼻咽癌 | N-WASP | 升高[89] | 在CDC42结合蛋白(CIP4)激活下,促进侵袭性伪足的形成,并激活EGFR信号,从而诱导下游MMP2(基质金属蛋白酶2)上调,促进鼻咽癌转移[89] | 不良预后[89] | EGFR信号[89] | |
| 中枢神经系统 | 神经胶质母细胞瘤 | N-WASP | 升高[92] | N-WASP可参与室管膜细胞和神经元的迁移和突触调节[90],调节少突胶质细胞髓鞘和再髓鞘过程[91],参与肿瘤细胞的扩散、迁移和侵袭[92] | 不良预后[92] | 不详 |
| 其他系统 | 黑色素瘤 | WAVE1\WAVE2 | 升高[85,86] | WAVE1和WAVE2作为Rac下游的主要效应因子,通过激活Arp2/3复合物调节肌动蛋白细胞骨架,促进肿瘤细胞侵袭和转移[85,86] | 不良预后[85,86] | Rac1-WAVE信号通路[85,86] |
JMML是一种非常罕见的恶性血液系统肿瘤,绝大多数JMML为RAS/MAPK信号通路的基因突变所致。然而COPPE等[54]在一对双胞胎JMML患者中发现了WAS基因突变(p.Ala274Thr),且产生了与理论上WASP突变效应相反的作用,猜测可能与RAS通路的活化相关,但其具体机制尚不明确(表3)。
MENOTTI等[55]发现,T淋巴细胞淋巴瘤患者,尤其是间变性大细胞淋巴瘤(ALCL)患者WASP的表达水平选择性下调,一方面使T淋巴细胞的免疫监测功能发生缺陷,降低机体免疫力;另一方面,CDC42作为WASP的主要调控因子,WASP在CDC42作用下激活下游的STAT3信号通路和MAPK信号通路,促进肿瘤细胞的侵袭和转移,加速淋巴瘤患者疾病进展[56]。因此WASP在T淋巴细胞淋巴瘤中具有肿瘤抑制因子作用(表3、图1)。
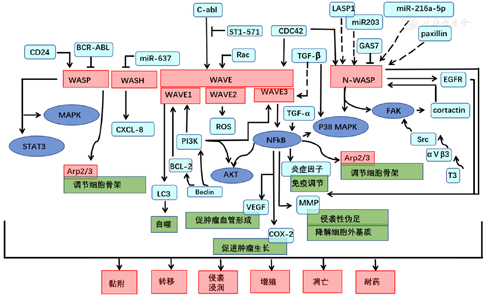

注:PI3K=磷脂酰肌醇3激酶,TGF=转化生长因子,Arp=肌动蛋白调节因子,CXCL=趋化因子
肝癌患者存在N-WASP和WAVE2、WAVE3的异常表达。N-WASP[57]和WAVE2[58]在肝细胞癌中表达水平升高,其高表达与其不良预后相关,是影响总体生存率的独立危险因素;WAVE3在肝内胆管细胞癌(ICC)中表达水平升高[59],通过诱导上皮-间充质转化,增强癌细胞的迁移和侵袭能力,是影响ICC患者预后的不良因素(表3)。
胰腺导管细胞癌患者N-WASP和WAVE3表达上调[60],且其高表达与不良预后相关[61];从作用机制来看,N-WASP通过p120-catenin/β-catenin/p21通路[62],在胰腺导管细胞癌中发挥致癌作用;此外N-WASP也是胰腺癌细胞上皮-间质转化的调节因子,可促进胰腺癌细胞的远处转移[63],是治疗胰腺癌远处转移的潜在靶向点。WAVE3则通过抑制丙酮酸脱氢酶激酶亚型2(PDK2)的表达,抑制AKT途径中Ser473的磷酸化,从而影响蛋白激酶B(PBK/AKT)通路,以及AKT途径下游蛋白比如上皮间质转化(EMT)相关蛋白、p53、Bcl-2和细胞周期蛋白cyclin D1的表达[60](表3、图1)。
WASP在结直肠癌(APC)中低表达甚至无表达[64];N-WASP在结直肠癌中则高表达,且其高表达与患者淋巴结转移、炎性反应、肿瘤细胞转移和侵袭、肿瘤出芽相关[64],是影响APC患者生存率的危险因素。MORRIS等[14]利用APC小鼠肿瘤模型发现N-WASP在肿瘤的不同阶段起到不同作用:肿瘤早期敲除N-WASP将增加肿瘤细胞生长并降低小鼠生存率,肿瘤晚期N-WASP表达逐渐升高,通过肌动蛋白细胞骨架机制促进肿瘤细胞侵袭和转移。因此N-WASP在早期肠道癌变中具有抑制肿瘤的作用,而到肿瘤后期则起肿瘤促进作用(表3)。
WANG等[65]通过对正常食管黏膜及ESCC中N-WASP表达水平的比较及生存分析发现,N-WASP在ESCC患者中高表达,与ESCC患者淋巴结转移及病理分期有关,可作为ESCC诊断和预后的生物标志物,这将对ESCC患者的靶向治疗有指导意义。同样,LI等[66]也发现与健康志愿者相比,ESCC患者血清中WAVE3表达水平明显升高,其高表达与ESCC的TNM分期、浸润深度及淋巴结浸润有关,是影响ESCC患者预后的危险因素,并提示WAVE3可能是ESCC的癌基因。DERIVERY等[67]也发现,在ESCC患者的癌细胞中,WASH的表达水平明显高于癌旁组织,且其表达与病理分期有明显相关性,进一步深入研究其机制发现,ESCC低表达的miR-637导致WASH表达上调,WASH通过上调趋化因子8(CXCL8)的表达水平促进食管鳞癌细胞的干性,从而促进癌细胞的生长及转移(表3、图1)。
ISHIHARA等[68]研究发现,WASP在乳腺癌转移中发挥着重要作用,WASP的缺陷会影响集落刺激因子对巨噬细胞的趋化作用,从而中断巨噬细胞与乳腺癌细胞之间的联系,使肿瘤细胞恶性增殖,促进癌细胞的运动、侵袭、内渗及转移[69]。MARTIN等[70]发现N-WASP在乳腺癌细胞中低表达,诱导N-WASP过表达将显著降低乳腺癌细胞的侵袭能力、运动能力和生长能力;这一发现与MARTIN等[71]的研究一致,其分别利用免疫组化和RT-PCR对124例乳腺癌组织进行了N-WASP与人乳腺癌患者预后及转移率的相关性检测,发现肿瘤组织与癌旁组织相比,N-WASP表达明显下降,低表达的N-WASP与患者不良预后相关,更易出现远处转移。因此N-WASP在乳腺癌中是一种肿瘤抑制因子(表3)。
WAVE亚家族中,表达水平显著增高的是WAVE2[72],通过Rac1-WAVE信号通路促进侵袭性板足形成,从而促进肿瘤细胞的侵袭和迁移能力;其次表达水平增高的是WAVE3。SOSSEY-ALAOUI等[73]发现乳腺癌患者分期越晚,其表达水平越高。TAYLOR[74]发现WAVE3表达水平和活性的增强有助于三阴性乳腺癌(TNBC)的转移,因此WAVE3的表达水平与乳腺癌患者的分期及预后密切相关,将来或许能从如何使WAVE3失活方面寻找一种靶向治疗乳腺癌转移的治疗方法。此外,TAKAHASHI等[35]发现血小板生长因子PDGF通过侵袭性室膜室间孔诱导乳腺癌细胞侵袭,并在乳腺癌细胞浸润处发现了依赖于PI3K导致的WAVE2、N-WASP和F-肌动蛋白的共聚集,当利用RNA干扰技术干扰WAVE2、N-WASP的表达时,肿瘤细胞浸润处的F-肌动蛋白也随之减少。因此WAVE2、N-WASP通过介导F-肌动蛋白在细胞浸润部位的大量积累,在PDGF诱导的PI3K依赖性细胞侵袭中起关键作用(表3、图1)。
WASP家族在卵巢癌中的表达研究多为WAVE亚家族。申丽媛等[75]通过免疫组化法检测60例卵巢癌、25例卵巢交界性肿瘤、30例卵巢良性肿瘤和21例正常卵巢组织中WAVE蛋白的表达,结果发现WAVE1在卵巢癌中的表达显著升高,且WAVE1在卵巢癌中的表达与临床分期、病理分化程度密切相关。因此WAVE1在卵巢癌中高表达,可能与其发生、发展及侵袭转移有关,有望成为卵巢癌治疗的靶标(表3)。
秦巧红等[76]发现,在子宫内膜癌组织中,WASL在miR-216a-5p调控下表达上调,从而促进子宫内膜癌细胞的增殖、迁移和侵袭能力,可能是子宫内膜癌治疗的潜在靶点(表3、图1)。
在肾透明细胞癌(CCRCC)中,N-WASP的表达显著降低[81],但是其表达一旦升高,常预示着不良预后[82],并且其表达水平与CCRCC的组织学分级显著相关[83],N-WASP是CCRCC患者总生存率的独立预测因子,可作为预测CCRCC临床预后的独立生物标志物。LIU等[84]对肾癌的研究发现,SNHG14通过与转录因子SP1结合使其在癌组织中表达增强,并通过miR-203依赖的方式调节N-WASP蛋白表达水平,从而促进肾脏肿瘤细胞迁移和侵袭的能力(表3、图1)。
SEMBA等[87]分别研究了肺腺癌组织和细支气管肺泡癌中Arp2和WAVE2的共表达情况,结果发现Arp2和WAVE2在肺腺癌癌细胞中共同表达的比例明显较高,但在恶性程度较低的细支气管肺泡癌中共同表达的比例明显较低,且Arp2和WAVE2的共表达与不良预后相关,说明Arp2和WAVE2的共表达可能在肺癌癌症转移机制中发挥着重要作用。生长阻滞特异蛋白7(GAS7)是一种迁移抑制因子,是预测肺癌预后的标志物之一,GAS7表达下降时,通过与N-WASP结合激活纤维连接蛋白/整合素/FAK通路(N-WASP/FAK/F-actin),促进细胞骨架动力学,增加癌细胞运动,促进肺癌转移[88](表3、图1)。
作为细胞骨架的重要组成部分,WASP家族通过诱导肌动蛋白成核、介导细胞黏附和侵袭性伪足等参与调节肿瘤细胞的运动、侵袭和转移,也在肿瘤免疫调节、肿瘤代谢等方面有重要作用。目前对WASP家族在肿瘤中的作用研究包括血液系统肿瘤和各种实体肿瘤,但以实体肿瘤居多,并涉及呼吸系统、生殖系统、消化系统等各方面,总结见表3。从发病机制来看涉及MAPK、STAT3、p120-catenin/β-catenin/p21等多条信号通路,且其表达异常通常与肿瘤患者不良预后相关,这对今后研究各种恶性肿瘤发病机制以及寻找靶向治疗药物均具有重要意义;WASP家族在肿瘤发生、发展中的作用还存在广阔的研究空间,进一步地探究WASP家族在肿瘤生长调节中的作用和机制,对于WASP相关的肿瘤诊断、靶向治疗以及预后研究有着重要意义。
本文无利益冲突。



























