
多重耐药肠杆菌(MDR-EB)感染已成为全球住院患者的治疗难题,其发病率和严重程度呈上升趋势。
系统评价头孢他啶/阿维巴坦(CAZ/AVI)治疗MDR-EB感染的有效性与安全性。
系统检索中国知网、万方数据知识服务平台、维普网、PubMed、EMBase、Cochrane Library数据库中涉及CAZ/AVI治疗MDR-EB感染的随机对照试验(RCT)或临床对照试验(CCT),其中试验组采用包含CAZ-AVI的药物治疗方案,对照组采用其他治疗措施。检索时间为建库至2021年2月。由两位评审人员进行文献筛选、数据提取及质量评价,采用RevMan 5.1软件进行Meta分析。
共纳入12篇文献、15项研究。Meta分析结果显示,两组临床治愈率、细菌清除率、药物不良反应发生率比较,差异均无统计学意义〔OR=1.02,95%CI(0.73,1.43),P=0.90;OR=1.23,95%CI(0.96,1.58),P=0.10;OR=1.02,95%CI(0.85,1.22),P=0.84〕。试验组死亡率低于对照组〔OR=0.72,95%CI(0.52,0.99),P=0.04〕。绘制临床治愈率的漏斗图,结果显示,漏斗图分布基本对称。对临床治愈率、细菌清除率及死亡率进行Egger's检验,结果显示,三者无发表偏倚存在(P=0.234、0.679、0.056)。
CAZ-AVI可以降低MDR-EB感染患者的死亡率,可以作为MDR-EB,特别是耐碳青霉烯肠杆菌感染患者的可选方案之一。

本刊2022年版权归中国全科医学杂志社所有
未经编辑部许可,不得任意转载和摘编
本刊所发表作品仅为作者观点,并不代表编委会和编辑部意见
如有印装质量问题请向本刊发行部调换
细菌耐药问题日趋严重,据2020年中国细菌耐药监测网(CHINET)数据统计结果显示,71.9%的临床病原菌为革兰阴性菌[1]。目前认为碳青霉烯类药物是治疗因多重耐药肠杆菌(multidrug-resistant enterobacteriaceae bacteria,MDR-EB)引起的严重感染的首选药物,然而耐碳青霉烯肠杆菌(carbapenem-resistant enterobacter,CRE)的检出率呈迅速上升趋势,超过20%的细菌已出现耐药[2]。因目前治疗CRE的手段有限,致使CRE感染确诊患者的死亡率和治疗成本显著升高[3]。头孢他啶/阿维巴坦(CAZ/AVI)是2019年5月获国家药品监督管理总局批准上市的一种新型β-内酰胺类/β-内酰胺酶抑制剂,能对抗包括CRE在内的多数MDR-EB引起的感染[4]。由于该药在国内上市时间较短,目前关于该药的研究主要集中在微生物学或体外敏感性等方面的实验性研究[5,6],但基于临床耐药菌感染的严峻挑战,其在临床实践中的应用越来越多,特别是治疗由CRE引起的严重感染,然而其相关的临床应用性研究国内很少报道,且药物临床疗效及安全性资料有限,虽然有相关的循证医学证据报道,但纳入分析的文献普遍较少且质量不等。本文拟从循证医学的角度对CAZ/AVI治疗MDR-EB感染的疗效和安全性进行Meta评价,旨在为严重感染患者提供用药参考。
系统检索中国知网、万方数据知识服务平台、维普网、PubMed、EMBase、Cochrane Library数据库中涉及CAZ/AVI治疗MDR-EB感染的文献,中文主题词为"头孢他啶/阿维巴坦""碳青霉烯""多重耐药""产碳青霉烯酶",英文主题词为"ceftazidime avibactam""CAZ/AVI""carbapenem resistan*""multidrug resistan*""carbapenemase producing",检索时间为建库至2021年2月。
由两位评审人员进行文献初步筛选,若评审人员对文献质量存在不同观点,则需第三位研究员参与分析,最后一起讨论解决分歧。
(1)研究类型包括随机对照试验(randomized controlled trial,RCT)和临床对照试验(controlled clinical trial,CCT);(2)试验组采用包含CAZ/AVI的药物治疗方案,对照组采用其他治疗措施的临床研究;(3)致病菌为MDR-EB;(4)结局指标包括治愈率、细菌清除率、死亡率、药物不良反应(adverse drug reaction,ADR)。
(1)动物实验;(2)重复性研究;(3)综述或个案报道;(4)结局指标无可用数据的研究。
由两位评审人员独立地收集符合纳入标准的研究数据,包括:(1)第一作者;(2)发表时间;(3)研究类型(RCT或CCT);(4)致病菌类型;(5)平均年龄;(6)随访时间;(7)纳入例数;(8)治疗方案;(9)临床治愈率;(10)细菌清除率;(11)死亡率;(12)ADR;(13)证据质量;(14)质量评分。
使用Downs and Black清单评估文献质量[7]。该清单既可以用于临床RCT,也可以用于非随机CCT的方法学质量评估,该清单内容包括报告质量、外部有效性、偏倚、混杂因素和效力5个部分共27个条目,每个条目判断:是=1分,否或未提及=0分,得分越高,表示文献质量越高[8]。结合本文纳入文献的特点,选取Downs and Black清单中27项中的15个条目用于本次评估,满分15分,其中0~5分为低质量文献,6~10分为中等质量文献,11~15分为高质量文献。
采用STATA 12.0软件和RevMan 5.1软件进行数据统计分析,计数资料和计量资料分别采用比值比(OR)和均数差(MD)及其95%置信区间(CI)表示。采用P值和I2值评估文献的异质性,若I2≤50%、P>0.05,表示文献间异质性低,采用固定效应模型进行Meta分析;反之则采用随机效应模型[9]。异质性的来源主要通过亚组分析或剔除文献分析。根据Begg's漏斗图的对称性评价发表偏倚,如果漏斗图不对称,提示可能存在发表偏倚[10]。但是观察Begg's漏斗图是否对称可能存在较大的主观性影响,遂又采用Egger's测试的统计学数据验证偏倚是否存在[11]。以P<0.05为差异有统计学意义。
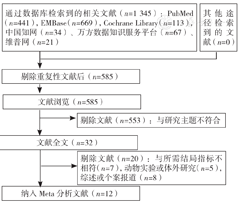
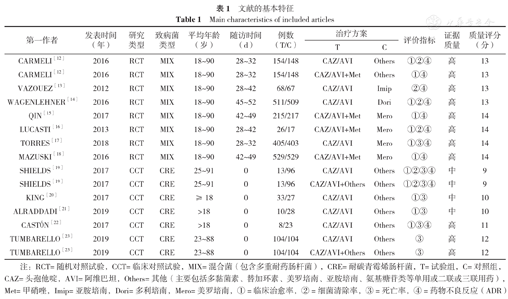
共检索到中、英文文献1 345篇,最终纳入12篇文献[12,13,14,15,16,17,18,19,20,21,22,23],总共15项研究(其中3篇文献[12,19,23]各包含2项研究),纳入文献全为英文文献;研究类型为RCT 7篇[12,13,14,15,16,17,18],CCT 5篇[19,20,21,22,23]。文献筛选流程见图1,文献的基本特征见表1。

文献的基本特征
Main characteristics of included articles
文献的基本特征
Main characteristics of included articles
| 第一作者 | 发表时间(年) | 研究类型 | 致病菌类型 | 平均年龄(岁) | 随访时间(d) | 例数(T/C) | 治疗方案 | 评价指标 | 证据质量 | 质量评分(分) | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| T | C | ||||||||||
| CARMELI[12] | 2016 | RCT | MIX | 18~90 | 28~32 | 154/148 | CAZ/AVI | Others | ①②④ | 高 | 13 |
| CARMELI[12] | 2016 | RCT | MIX | 18~90 | 28~32 | 154/148 | CAZ/AVI+Met | Others | ①④ | 高 | 13 |
| VAZOUEZ[13] | 2012 | RCT | MIX | 18~90 | 28~42 | 68/67 | CAZ/AVI | Imip | ②④ | 高 | 13 |
| WAGENLEHNER[14] | 2016 | RCT | MIX | 18~90 | 45~52 | 511/509 | CAZ/AVI | Dori | ①②④ | 高 | 13 |
| QIN[15] | 2017 | RCT | MIX | 18~90 | 42~49 | 215/217 | CAZ/AVI+Met | Mero | ①④ | 高 | 14 |
| LUCASTI[16] | 2013 | RCT | MIX | 18~90 | 28~42 | 26/17 | CAZ/AVI+Met | Mero | ①②④ | 高 | 14 |
| TORRES[17] | 2018 | RCT | MIX | 18~90 | 28~32 | 405/403 | CAZ/AVI | Mero | ①③④ | 高 | 14 |
| MAZUSKI[18] | 2016 | RCT | MIX | 18~90 | 42~49 | 529/529 | CAZ/AVI+Met | Mero | ①④ | 高 | 14 |
| SHIELDS[19] | 2017 | CCT | CRE | 25~91 | 0 | 13/96 | CAZ/AVI | Others | ①②③④ | 中 | 9 |
| SHIELDS[19] | 2017 | CCT | CRE | 25~91 | 0 | 13/96 | CAZ/AVI+Others | Others | ①②③④ | 中 | 9 |
| KING[20] | 2017 | CCT | CRE | ≥18 | 0 | 33/27 | CAZ/AVI | Others | ①③ | 中 | 10 |
| ALRADDADI[21] | 2019 | CCT | CRE | >18 | 0 | 10/28 | CAZ/AVI | Others | ①③ | 中 | 10 |
| CASTóN[22] | 2017 | CCT | CRE | >18 | 0 | 8/23 | CAZ/AVI | Others | ①③④ | 高 | 11 |
| TUMBARELLO[23] | 2019 | CCT | CRE | 23~88 | 0 | 104/104 | CAZ/AVI | Others | ③ | 高 | 12 |
| TUMBARELLO[23] | 2019 | CCT | CRE | 23~88 | 0 | 104/104 | CAZ/AVI+Others | Others | ③ | 高 | 12 |
注:RCT=随机对照试验,CCT=临床对照试验,MIX=混合菌(包含多重耐药肠杆菌),CRE=耐碳青霉烯肠杆菌,T=试验组,C=对照组,CAZ=头孢他啶,AVI=阿维巴坦,Others=其他(主要包括多黏菌素、替加环素、美罗培南、亚胺培南、氨基糖苷类等单用或二联或三联用药),Met=甲硝唑,Imip=亚胺培南,Dori=多利培南,Mero=美罗培南,①=临床治愈率,②=细菌清除率,③=死亡率,④=药物不良反应(ADR)
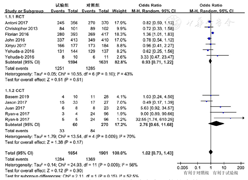
共10篇文献[12,14,15,16,17,18,19,20,21,22]、12项研究分析临床治愈率,其中试验组1 654例,对照组1 901例。异质性检验结果显示,各研究间存在统计学异质性(I2=56%,P=0.009),采用随机效应模型进行分析。Meta分析结果显示,两组临床治愈率比较,差异无统计学意义〔OR=1.02,95%CI(0.73,1.43),P=0.90〕。按照研究类型不同,将研究分为RCT和CCT 2个亚组,Meta分析结果显示,RCT研究的两组临床治愈率比较,差异无统计学意义〔OR=0.93,95%CI(0.71,1.22),P=0.61〕;CCT研究的两组临床治愈率比较,差异无统计学意义〔OR=2.76,95%CI(0.65,11.68),P=0.17〕,见图2。

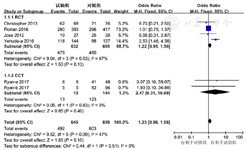
共5篇文献[12,13,14,16,19]、6项研究分析细菌清除率,其中试验组645例,对照组809例。异质性检验结果显示,各研究间统计学异质性低(I2=47%,P=0.09),采用固定效应模型进行分析。Meta分析结果显示,两组细菌清除率比较,差异无统计学意义〔OR=1.23,95%CI(0.96,1.58),P=0.10〕。按照研究类型不同,将研究分为RCT和CCT 2个亚组,Meta分析结果显示,RCT研究的两组细菌清除率比较,差异无统计学意义〔OR=1.22,95%CI(0.95,1.56),P=0.13〕;CCT研究的两组细菌清除率比较,差异无统计学意义〔OR=2.47,95%CI(0.31,19.89),P=0.40〕,见图3。

共6篇文献[17,19,20,21,22,23]、8项研究分析死亡率,其中试验组573例,对照组777例。异质性检验结果显示,各研究间存在统计学异质性(I2=50%,P=0.05),采用固定效应模型进行分析。Meta分析结果显示,试验组死亡率低于对照组,差异有统计学意义〔OR=0.72,95%CI(0.52,0.99),P=0.04〕。按照研究类型不同,将研究分为RCT和CCT 2个亚组,Meta分析结果显示,RCT研究的两组死亡率比较,差异无统计学意义〔OR=1.29,95%CI(0.78,2.12),P=0.32〕;CCT研究的试验组死亡率低于对照组,差异有统计学意义〔OR=0.47,95%CI(0.30,0.72),P=0.000 5〕,见图4。
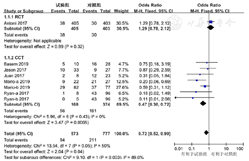

9篇文献[12,13,14,15,16,17,18,19,22]报道了ADR,ADR类型包括:消化道反应、肝肾功能损害、中枢神经系统反应以及其他ADR(包括咳嗽、低钠血症、尿路感染、肺炎、皮疹、心力衰竭等)。按照ADR类型不同,将文献分为4个亚组进行安全性分析。异质性检验结果显示,各研究间存在统计学异质性(I2=58%,P=0.000 2),采用随机效应模型进行分析。Meta分析结果显示,两组ADR发生率比较,差异无统计学意义〔OR=1.02,95%CI(0.85,1.22),P=0.84〕,见图5。
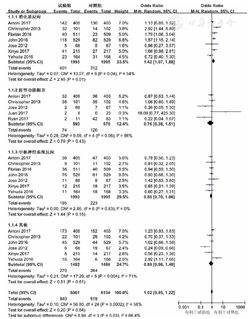

绘制临床治愈率的Begg's漏斗图,结果显示,漏斗图分布基本对称,见图6。对临床治愈率、细菌清除率及死亡率进行Egger's检验,结果显示,三者无发表偏倚存在(P=0.234、0.679、0.056)。

通过对影响异质性的可能因素,如致病菌类型〔CRE、混合菌(MIX)〕、文献证据质量(高、中质量)、对照方案不同(对照药物明确、对照药物不明确)、治疗方案不同(抗菌药物单用、抗菌药物联用)以及随访时间长短(无随访、有随访)进行敏感性亚组分析寻找异质性来源。结果显示,致病菌类型中MIX、文献证据质量中高质量文献、治疗方案中抗菌药物单用以及有随访是细菌清除率异质性来源的重要因素;文献证据质量中高质量文献是死亡率异质性来源的重要因素,见表2。
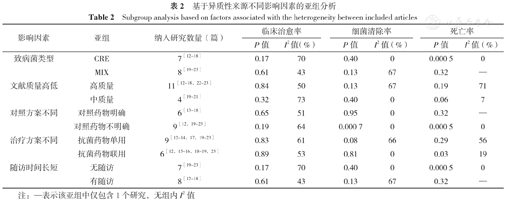
基于异质性来源不同影响因素的亚组分析
Subgroup analysis based on factors associated with the heterogeneity between included articles
基于异质性来源不同影响因素的亚组分析
Subgroup analysis based on factors associated with the heterogeneity between included articles
| 影响因素 | 亚组 | 纳入研究数量(篇) | 临床治愈率 | 细菌清除率 | 死亡率 | |||
|---|---|---|---|---|---|---|---|---|
| P值 | I2值(%) | P值 | I2值(%) | P值 | I2值(%) | |||
| 致病菌类型 | CRE | 7[12,13,14,15,16,17,18] | 0.17 | 70 | 0.40 | 0 | 0.000 5 | 0 |
| MIX | 8[19,20,21,22,23] | 0.61 | 43 | 0.13 | 67 | 0.32 | — | |
| 文献质量高低 | 高质量 | 11[12,13,14,15,16,17,18,22,23] | 0.84 | 50 | 0.13 | 67 | 0.19 | 71 |
| 中质量 | 4[19,20,21] | 0.32 | 73 | 0.40 | 0 | 0.06 | 7 | |
| 对照方案不同 | 对照药物明确 | 6[13,14,15,16,17,18] | 0.65 | 51 | 0.95 | 0 | 0.32 | — |
| 对照药物不明确 | 9[12,19,20,21,22,23] | 0.19 | 64 | 0.000 7 | 0 | 0.000 5 | 0 | |
| 治疗方案不同 | 抗菌药物单用 | 9[12,13,14,17,19,20,21,22,23] | 0.83 | 61 | 0.08 | 66 | 0.29 | 56 |
| 抗菌药物联用 | 6[12,15,16,18,19,23] | 0.89 | 53 | 0.81 | 0 | 0.03 | 19 | |
| 随访时间长短 | 无随访 | 7[19,20,21,22,23] | 0.17 | 70 | 0.40 | 0 | 0.000 5 | 0 |
| 有随访 | 8[12,13,14,15,16,17,18] | 0.61 | 43 | 0.13 | 67 | 0.32 | — | |
注:—表示该亚组中仅包含1个研究,无组内I2值
通过逐篇剔除临床治愈率、细菌清除率和死亡率所纳入的文献,结果显示,临床治愈率的异质性主要来源于LUCASTI等[16],剔除该文献后,各研究间异质性降低(I2=45%,P=0.05),采用固定效应模型进行分析,Meta分析结果显示,两组临床治愈率比较,差异无统计学意义〔OR=0.88,95%CI(0.72,1.07),P=0.20〕。细菌清除率的异质性主要来源于CARMELI等[12],剔除该文献后,各研究间异质性降低(I2=0,P=0.91),采用固定效应模型进行分析,Meta分析结果显示,两组细菌清除率比较,差异无统计学意义〔OR=1.01,95%CI(0.77,1.34),P=0.92〕。死亡率的异质性主要来源于TORRES等[17],剔除该文献后,各研究间异质性降低(I2=0,P=0.43),采用固定效应模型进行分析,Meta分析结果显示,试验组死亡率低于对照组,差异有统计学意义〔OR=0.47,95%CI(0.30,0.72),P=0.000 5〕。
本文通过Meta分析比较了含CAZ/AVI与不含CAZ/AVI的抗菌药物治疗方案治疗MDR-EB感染的有效性与安全性。从循证医学的角度为治疗重症感染提供了选药依据。
对于有效性来说,Meta分析结果显示:含有CAZ/AVI的试验组与不含CAZ/AVI的对照组治疗MDR-EB感染,其临床治愈率和细菌清除率无明显优势,但是能显著降低患者的死亡率。本文纳入的研究中,对照组多为含碳青霉烯类的单药或联用方案,临床治愈率和细菌清除率间未发现显著差异,这与CHEN等[24]已经证明CAZ/AVI与包括碳青霉烯类在内的其他药物治疗各种感染的疗效相当结论相似。由于耐药菌株的出现和传统的β-内酰胺类抑制剂对碳青霉烯类的抑制活性低下,导致"第二代"β-内酰胺酶抑制剂的开发——包括AVI在内的新一代β-内酰胺酶抑制剂是基于非β-内酰胺结构,其抗菌谱被扩展到可以抑制产A类碳青霉烯酶的CRE(如肺炎克雷伯菌)感染,但是可能由于MDR-EB感染的患者病情重、病程长、多种疾病因素并存等复杂的医学背景,并不能提高患者的临床治愈率和细菌清除率。另外,由于CAZ/AVI具有较低的药物-药物相互作用潜力,患者耐受性良好,以及严重ADR几乎未见报道,在治疗MDR-EB感染时,相较于其他治疗选择可能很大程度上避免除患者疾病本身之外的药源性的死亡不良事件,因此,其死亡率可能更低。所以,CAZ/AVI可能是重症感染,特别是CRE感染患者的一个有价值的、新的治疗选择[24,25]。
在安全性方面,CAZ/AVI试验组与对照组的ADR发生率不存在显著差异(P=0.84)。但是对照组可能发生更多严重的ADR,如肝肾功能损害和中枢神经系统相关ADR,试验组的ADR主要为消化道反应,且多为一过性,患者症状较轻,因此含CAZ/AVI的试验组可能更加安全且耐受性更好。然而,值得注意的是,试验组的ADR发生率略高于对照组,MDR-EB感染的患者本身病情重,即使是轻微的打击也可能延长患者病程,影响预后,因此,临床医师在使用CAZ/AVI时,仍必须重视及积极处理其相关ADR。
敏感性亚组分析结果显示:致病菌类型是否单一、文献质量高低、试验组是否联合用药或有无随访可能是细菌清除率异质性来源的重要因素。究其原因,文献质量越高,其试验方法学设计越复杂全面,如高质量的RCT文献运用了随机及盲法等方法,增加了试验的不确定性,从而可能导致异质性的发生。同样,试验组联合用药或致病菌中包含了多种细菌,增加的其他治疗药物或其他细菌均可能导致异质性。另外,对患者进行随访,随访时患者所处环境各异,对治疗结局影响较大,也可能导致异质性。通过一一剔除各个纳入文献分析,结果发现,异质性主要来源于可能受纳入文献LUCASTI等[16]、TORRES等[17]及CARMELI等[12]的临床试验方法学影响,3项研究异质性较大的共同原因可能是三者均为多中心、大型临床试验,参与研究的患者来自世界各地的医院,纳入人群的个体差异较大,病原微生物的流行趋势及耐药程度不一,重要的是,给予患者相同的治疗方案时,但不能反映药物的使用方式相同,例如,TORRES等[17]提到,美罗培南标准给药方式为每8 h静脉滴注30 min,但有些机构给予延长或连续注入,可能对治疗结局有较大的影响。所以,结果可能存在一定的选择性偏倚和处方偏倚。
本Meta分析仍存在部分局限性:(1)虽纳入文献研究为12篇,高质量的研究数量足够,但总样本量不够大,可能会出现假阳性或假阴性结果;(2)对于某些结局指标的分析时,个别纳入的文献研究异质性来源较大,基础性疾病严重程度不同,可能会产生偏倚;(3)纳入文献的质量高低、试验组是否联合用药、致病菌类型是否单一及有无随访均是造成本研究结果偏倚的潜在重要因素。
基于MDR-EB耐药问题日益突出,抗感染治疗方案十分有限,已经成为公共卫生领域的治疗难题,该Meta分析结果显示,CAZ/AVI能显著降低患者的死亡率且不增加严重ADR的发生,可以作为MDR-EB,特别是CRE感染患者的重要可选方案之一。本文结果具有重要的临床指导意义,但受研究方法学的限制,上述结论仍需设计完善的大样本临床试验来验证,旨在为CRE感染患者提供疗效更佳的治疗手段及宝贵经验。
本文无利益冲突。



























