
慢性阻塞性肺疾病(简称慢阻肺)是我国重点防治的慢性呼吸系统疾病之一,深入探讨慢阻肺的免疫发病机制并对其中的关键靶点进行干预可能为慢阻肺的防治提供新办法。基于目前临床常用的慢阻肺免疫调节剂相关研究证据及具有免疫治疗作用的药物研发现状和趋势,《慢性阻塞性肺疾病免疫调节治疗专家共识》撰写组提出4条推荐意见:(1)细菌溶解产物、磷酸二酯酶抑制剂、大环内酯类药物等生物、化学制剂均可通过增强机体免疫功能和提高免疫细胞活性而发挥对慢阻肺的免疫调节作用;(2)针对流感病毒、肺炎球菌感染等进行疫苗接种可预防慢阻肺急性加重、降低患者死亡率;(3)他汀类药物及维生素D等具有免疫调节作用,对慢阻肺可能有一定的治疗作用,但二者在慢阻肺中的应用证据较少且存在一定不良反应,仍需进一步积累证据;(4)中医药复方及虫草制剂或可通过调节机体免疫功能、提高免疫细胞活性改善慢阻肺稳定期患者生活质量,减少急性加重。本专家共识旨在进一步推动我国慢阻肺免疫调节治疗的临床实践。

本刊2022年版权归中国全科医学杂志社所有
未经编辑部许可,不得任意转载和摘编
本刊所发表作品仅为作者观点,并不代表编委会和编辑部意见
如有印装质量问题请向本刊发行部调换
慢性阻塞性肺疾病(简称慢阻肺)是一种以持续性气流受限和相应呼吸系统症状为主要临床特征、气道和/或肺泡异常为主要病理学改变的慢性呼吸系统疾病。慢阻肺的发病机制复杂,至今尚未完全阐明,而多种免疫调节失衡在慢阻肺的发生、发展中发挥着重要作用。深入探讨慢阻肺的免疫发病机制并对其中的关键靶点进行干预可能为慢阻肺的防治提供新办法。
《慢性阻塞性肺疾病诊治指南(2021年修订版)》[1]中关于慢阻肺治疗的内容提及免疫调节剂治疗,推荐慢阻肺合并明确免疫缺陷患者在慢阻肺规范化治疗基础上针对具体的免疫缺陷参照相应指南或专家共识进行治疗。免疫调节治疗主要针对慢阻肺患者免疫功能受损,治疗目标为改善患者免疫功能、减轻症状、减少感染和急性加重,但治疗目标并非在短期内可达成,在治疗过程中需密切观察其临床疗效和相关不良反应。
基于目前临床常用的慢阻肺免疫调节剂的相关研究证据、具有免疫治疗作用的药物研发现状和趋势,在参考国内外现有指南和临床研究成果基础上,《慢性阻塞性肺疾病免疫调节治疗专家共识》撰写组通过在PubMed、Medline、中国知网、万方数据知识服务平台检索关于慢阻肺免疫调节治疗的随机双盲对照研究、Meta分析、病例对照研究、真实世界研究等(检索时间截至2022年1月),经充分讨论后达成本专家共识,以供临床参考并进一步推动我国慢阻肺免疫调节治疗的临床实践。
本专家共识采用2001年牛津循证医学中心(Oxford Centre for Evidence-Based Medicine,OCEBM)制定的临床证据分级和推荐强度系统将证据级别分为5个等级,推荐强度由强到弱用A~D表示,详见表1。
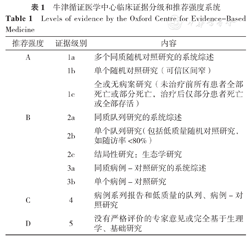
牛津循证医学中心临床证据分级和推荐强度系统
Levels of evidence by the Oxford Centre for Evidence-Based Medicine
牛津循证医学中心临床证据分级和推荐强度系统
Levels of evidence by the Oxford Centre for Evidence-Based Medicine
| 推荐强度 | 证据级别 | 内容 |
|---|---|---|
| A | 1a | 多个同质随机对照研究的系统综述 |
| 1b | 单个随机对照研究(可信区间窄) | |
| 1c | 全或无病案研究(未治疗前所有患者全部死亡或部分死亡,治疗后仅部分患者死亡或全部存活) | |
| B | 2a | 同质队列研究的系统综述 |
| 2b | 单个队列研究(包括低质量随机对照研究,如随访率<80%) | |
| 2c | 结局性研究:生态学研究 | |
| 3a | 同质病例-对照研究的系统综述 | |
| 3b | 单个病例-对照研究 | |
| C | 4 | 病例系列报告和低质量的队列、病例-对照研究 |
| D | 5 | 没有严格评价的专家意见或完全基于生理学、基础研究 |
慢阻肺是一种异质性疾病,其发病机制主要涉及炎性反应、蛋白酶-抗蛋白酶失衡、氧化应激、细胞凋亡与肺组织结构细胞代偿修复之间不平衡引起的气道重塑和肺泡破坏[2,3,4]。有研究表明,自身免疫在慢阻肺的发生、发展中具有重要作用[5]。近年来,与免疫学相关的机制在慢阻肺发生、发展中的作用受到广泛关注和重视。
气道黏膜是机体防止病原微生物等入侵肺脏的第一道防线,肺组织结构细胞和固有/适应性免疫细胞共同参与并维持局部组织微环境稳态,当呼吸系统受到不同物质刺激时,区域免疫系统会表现出不同的应答特点并引发不同的生理和病理改变。
在香烟烟雾等外源性或内源性物质刺激下,肺组织局部上皮细胞、肺泡巨噬细胞、树突状细胞(dendritic cells,DCs)等固有免疫细胞被激活,其中气道上皮细胞和肺泡巨噬细胞可释放肿瘤坏死因子(tumor necrosis factor,TNF)-α、白介素(interleukin,IL)-1β、IL-8、CC亚族趋化因子配体(C-C chemokine ligand,CCL)-20、CXC趋化因子配体(CXC chemokine ligand,CXCL)-10等促炎细胞因子和趋化因子,导致相关炎性细胞及血管内皮细胞活化并增加其黏附分子/受体表达,继而促使中性粒细胞和单核细胞从血循环募集至肺组织[6]。有研究发现,气道、肺实质、肺泡灌洗液和痰中巨噬细胞数量与慢阻肺严重程度呈正相关[7];活化的中性粒细胞和巨噬细胞可通过释放氧自由基和蛋白质水解酶如中性粒细胞弹性蛋白酶和基质金属蛋白酶(matrix metalloproteinase,MMP)-12等而促进肺气肿的发展[8,9]。此外,中性粒细胞弹性蛋白酶还参与黏蛋白的产生,而过多的黏液和受损的纤毛清除能力均与慢阻肺患者小气道阻塞有关[10,11]。研究表明,部分慢阻肺患者存在嗜酸粒细胞增多现象,而嗜酸粒细胞释放的嗜酸性阳离子蛋白(eosinophil cationic protein,ECP)等碱性蛋白可损伤上皮细胞、加重气道炎症和肺泡破坏[12];慢阻肺加重程度和频次与巨噬细胞清除嗜酸粒细胞功能异常有关[13];肥大细胞和自然杀伤(natural killer,NK)细胞与小叶中央性肺气肿或肺泡破坏相关[14,15]。还有研究发现,慢阻肺患者体内增多的3型固有淋巴样细胞(type 3 innate lymphoid cell,ILC3)可通过产生IL-17等细胞因子参与慢阻肺局部免疫应答[16,17];气道黏膜上皮层及黏膜下层的DCs在受到香烟烟雾刺激后能迁移至纵隔淋巴结或局部气道黏膜淋巴滤泡,活化初始白细胞分化抗原(cluster of differentiation,CD)4+辅助性T(helper T,Th)1细胞和CD8+细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)[18,19],同时DCs还可以通过释放MMP-12直接参与肺气肿的形成[20]。上述研究表明,固有免疫细胞在慢阻肺的发生、发展中至关重要。
与固有免疫相比,适应性免疫的主要特征为对抗原识别的特异性、多样性和记忆性。既往研究发现,慢阻肺患者小气道周围和肺实质存在以B、T淋巴细胞为主要成分的三级淋巴滤泡,尤以重度慢阻肺患者为明显,而微生物抗原、香烟烟雾成分或其衍生物、上皮损伤后暴露的组织蛋白、细胞外基质等均可能成为抗原或自身抗原并诱导适应性免疫应答、促进淋巴滤泡的形成[21]。
研究表明,CD8+ CTL活化后可释放穿孔素和颗粒酶,进而导致结构细胞凋亡或坏死,其数量与慢阻肺患者病情严重程度呈正相关[22]。通常情况下,CD8+ CTL的活化需要CD4+ Th1细胞辅助,而CXCL-10和细胞因子IL-18对Th1细胞的募集和极化具有重要作用,后者可通过产生干扰素(interferon,IFN)-γ进一步激活巨噬细胞而加重炎性反应[23,24]。有研究发现,慢阻肺患者支气管黏膜和黏膜下层均可检出Th17细胞,而该类细胞产生的IL-17A和IL-17F能诱导上皮细胞产生抗菌肽(如β-防御素)、趋化因子和粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)及粒细胞-单核细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF),进而促进组织损伤部位中性粒细胞的聚集[25,26];此外,Th17细胞还与自身免疫有关[27]。另有研究发现,慢阻肺患者肺组织存在调节性T细胞(regulatory T cell,Treg),而该类细胞可通过细胞接触和分泌IL-10或转化生长因子β(transforming growth factor-β,TGF-β)的方式负向调节T细胞和DCs功能[27]。
研究表明,慢阻肺患者分泌型免疫球蛋白A(secretory immunoglobulin A,sIgA)(参与呼吸道黏膜稳态和局部抗感染免疫的主要抗体)的保护作用下降[28],而sIgA的保护作用下降有利于气道微生物的定植和感染,可能会进一步招募中性粒细胞、导致黏膜受损并形成恶性循环,最终产生局部和系统性炎性反应。研究发现,慢阻肺患者呼出气冷凝物中含有较高的前列腺素(prostaglandin,PG)E2、PGF2和白三烯(leukotriene,LT)B4,后者对中性粒细胞和T细胞具有一定的趋化作用[29];粒细胞、巨噬细胞等释放的弹性蛋白酶、基质金属蛋白酶家族与肺气肿的形成及黏液过度分泌有关[8,9,10,11];TNF-α、IL-1β、IL-18、IFN-γ、CXCL-1、CXCL-5、IL-8、CXCL-9、CXCL-10、CXCL-11、CCL-2、CCL-5等不仅与慢阻肺患者炎性反应有关,而且与多种免疫细胞活化、增殖、分化、趋化等有关[23,30,31]。因此,抗体、脂类介质、蛋白酶、细胞因子、趋化因子等免疫分子也与慢阻肺的发生、发展相关。
免疫细胞和肺组织结构细胞既是上述免疫分子来源细胞,也是其效应细胞,而由于上述免疫分子与细胞之间形成了复杂的相互作用关系,因此单一阻断某种分子并不能完全使患者临床症状消失。同时,上述免疫分子不仅存在于局部组织,也可能存在于血循环,会使慢阻肺患者发生系统性炎性反应并增加并发症发生风险。
血循环中C反应蛋白、IL-6、IL-8、TNF-α、纤维蛋白原、白细胞计数等是临床常用的反映系统性炎性反应的标志物。临床研究发现,约70%的慢阻肺患者存在某些反映系统性炎性反应标志物的异常,约16%的慢阻肺患者存在持续性系统性炎性反应[32]。研究表明,吸烟本身就会引起系统性炎性反应(如血循环中白细胞总数增加),吸烟的慢阻肺患者系统性炎性反应程度更高且持续性低水平系统性炎性反应可能会使慢阻肺与合并症之间发生关联;虽然目前尚未确定系统性炎性反应标志物是由于局部气道和肺组织炎性反应"外溢"入血所致还是由于存在其他合并症并通过血循环而对肺脏产生影响,但毫无疑问的是,系统性炎性反应会加快慢阻肺患者肺功能恶化、加重合并症和全身症状[33,34]。
慢阻肺的临床表现存在明显异质性,在多种诱因刺激下,呼吸道炎性反应加重、黏液过度分泌及潴留增加等均可加重呼吸道症状,但不同诱因诱发的炎性反应不尽相同。《慢性阻塞性肺疾病诊治指南(2021年修订版)》[1]指出,慢阻肺急性加重有可能是"细菌感染、病毒感染、嗜酸粒细胞增高或寡细胞"的内因型,且其防治策略也应该有所不同;根据诱导痰中炎性细胞种类,可将慢阻肺急性加重期分为4种表型,即嗜酸粒细胞增多型、中性粒细胞为主型、寡细胞型和混合型。实际上,慢性气道疾病如哮喘和慢阻肺的炎性反应分型包括以固有淋巴细胞(innate lymphoid cell,ILC)1、Th1细胞、巨噬细胞介导的1型炎性反应,以ILC2、Th2细胞、嗜酸粒细胞介导的2型炎性反应(T2型炎性反应),以ILC3、Th17细胞、中性粒细胞介导的3型炎症[35,36,37],而1型和3型炎性反应又归属于非T2型炎性反应。关于慢阻肺患者T2型炎性反应生物靶向治疗的临床试验结果显示,抗IL-5和IL-5R单克隆抗体对嗜酸粒细胞增多型慢阻肺患者具有一定疗效[38]。鉴于多项研究表明嗜酸粒细胞计数可用以指导糖皮质激素的使用[39],因此2021年慢性阻塞性肺疾病全球倡议(global initiative for chronic obstructive lung disease,GOLD)建议血嗜酸粒细胞计数>300个/μl的慢阻肺患者初始治疗采用长效β2-受体激动剂(long acting beta-agonists,LABA)/吸入性糖皮质激素(inhaled corticosteroid,ICS)疗法。总之,对慢阻肺稳定期和急性加重期进行早期识别及分型并探究其免疫学机制将为慢阻肺的诊断、治疗和针对性预防奠定基础。
感染是慢阻肺的危险因素之一,而当病原体突破气道屏障时则会引发慢阻肺急性加重[34,40]。临床研究数据显示,吸烟人群和超过50%的慢阻肺稳定期患者存在气道微生物定植[40,41,42],而慢阻肺急性加重期患者微生物多样性与上述人群相比有所下降[43,44]。sIgA黏膜保护作用的下降和巨噬细胞吞噬功能失调是导致慢阻肺患者气道微生物定植的重要原因。
临床常见的引起慢阻肺急性加重的细菌包括流感嗜血杆菌、肺炎球菌、卡他莫拉菌、铜绿假单胞菌等。研究表明,细菌感染诱发的慢阻肺急性加重患者IL-17、TNF-α等细胞因子表达水平升高,外周血Th1细胞和CD8+ CTL比例增加[45,46],Treg比例降低[47],肺组织中中性粒细胞明显聚集。此外,细菌感染导致的慢阻肺急性加重期患者血清中多种抗体与稳定期患者相比也有明显变化,如血清免疫球蛋白(immunoglobulin,Ig)G、IgA、IgM滴度下降且不能有效发挥抗体介导的调节作用,进而导致机体免疫防御水平降低[48]。
病毒感染也是临床常见的导致慢阻肺急性加重的原因,常见的气道感染病毒包括人鼻病毒、流感病毒、呼吸道合胞病毒、副流感病毒、冠状病毒等。研究表明,病毒感染可引起外周血中性粒细胞、嗜酸粒细胞、CD8+ CTL增多,细胞因子TNF-α、IL-6高表达[49];CD8+ CTL是机体抵御病毒感染的主要效应细胞,而流感病毒可引起CD8+ CTL抗病毒活性降低[50,51]。另有研究发现,慢阻肺患者出现鼻病毒感染后血清IL-21、特异性抗体IgG1与稳定期相比明显降低,提示病毒感染会导致慢阻肺急性加重期患者体液免疫损伤[52]。
鉴于气道微生物定植和感染在慢阻肺的发生、发展过程中发挥着重要作用,因此给予免疫调节剂如细菌溶解产物治疗或进行疫苗接种以改善慢阻肺患者机体免疫力、抗感染能力可能是防治慢阻肺的新途径。
推荐意见1:细菌溶解产物、磷酸二酯酶抑制剂、大环内酯类药物等生物、化学制剂均可通过增强机体免疫功能和提高免疫细胞活性而发挥对慢阻肺的免疫调节作用。
细菌溶解产物的主要成分为流感嗜血杆菌、肺炎球菌、肺炎克雷伯菌、臭鼻克雷伯菌、金黄色葡萄球菌、草绿色链球菌、化脓性链球菌和卡他奈瑟菌的冻干溶解产物,具有多种免疫活性,可通过调控固有免疫(巨噬细胞、中性粒细胞、DCs及细胞因子分泌)和适应性免疫(淋巴细胞亚群分布和Ig生成)两个方面而调节机体免疫功能[53,54]。临床研究表明,在常规治疗基础上联合使用细菌溶解产物可有效降低慢阻肺患者急性加重发作次数、缩短患者住院时间和慢阻肺急性发作时抗生素使用时间、改善患者临床症状与体征,并有助于改善患者肺功能、免疫功能[53,55]。因此,对于过去1年因慢阻肺急性加重住院或反复细菌感染而需应用抗生素的慢阻肺患者,可考虑应用细菌溶解产物治疗。
卡介菌多糖核酸含卡介菌多糖0.35 mg,核酸不低于30 μg,其作为一种免疫调节剂,具有调节机体固有免疫和适应性免疫的作用,有助于机体有效清除病毒抗原及各种抗原抗体复合物,进而提高机体抗病能力;此外,卡介菌多糖核酸还可通过稳定肥大细胞、抑制IgE释放而发挥抗过敏作用[56]。临床研究表明,卡介菌多糖核酸治疗可有效改善慢阻肺患者免疫功能、提高患者体液免疫和细胞免疫水平、纠正免疫功能紊乱,且经卡介菌多糖核酸治疗后慢阻肺患者外周血炎性因子水平明显下降、肺组织损伤减轻、通气状态明显改善,有利于促进患者病情好转并改善患者预后[57],但其对慢阻肺患者的免疫调节治疗效果仍需更多临床研究证实。
克雷伯杆菌提取物是一种从克雷伯杆菌中提取的糖蛋白,其作为一种无抗原性生物免疫调节兴奋剂,可有效预防呼吸道感染、减少慢性支气管炎急性感染发作次数及抗生素的使用、缩短慢性支气管炎急性感染持续时间[58]。一项包含73例受试者的临床试验结果显示,口服克雷伯杆菌提取物可有效减少慢性支气管炎患者感染的发生及抗生素的使用[59]。另一项包含110名受试者的临床试验发现,口服克雷伯杆菌提取物(第1个月2 mg/d,第2~3个月1 mg/d,每月持续口服8 d,持续治疗3个月)可有效减少慢性阻塞性支气管炎伴或不伴慢性呼吸衰竭、营养不良等患者感染的发生,但其对普通支气管炎患者感染的发生无明显影响[60]。因此,克雷伯杆菌提取物对慢阻肺患者的免疫调节治疗效果也需更多临床研究证实。
磷酸二酯酶由11个酶家族组成,是一类超家族酶;研究表明,磷酸二酯酶3和磷酸二酯酶4与肺部疾病最为相关[61]。磷酸二酯酶4是炎性细胞和免疫细胞中主要的选择性环磷酸腺苷(cyclic adenosine monophosphate,cAMP)代谢分解酶[62],其抑制剂早已运用于慢阻肺患者的治疗并被证实可有效减轻患者慢阻肺急性加重次数、改善患者肺功能、提高患者生活质量[63]。目前,磷酸二酯酶4抑制剂的消化道不良反应使其在临床上的应用受到一定限制。为了丰富慢阻肺患者的治疗选择,有研究探索了磷酸二酯酶3/4抑制剂对慢阻肺患者的治疗效果并经体外实验和动物实验证实其具有良好效果,且有Ⅱ期临床试验提示磷酸二酯酶3/4抑制剂可减轻慢阻肺患者诱导痰炎性反应[61]。因此,对于存在慢性支气管炎、重度及极重度通气功能障碍且已经规范慢阻肺治疗(包含吸入长效支气管扩张剂及ICS治疗等)但仍有反复急性加重病史尤其是有急性加重住院病史的慢阻肺患者,可考虑使用磷酸二酯酶抑制剂治疗,但治疗期间应密切监测患者体质量下降、消化道不良反应等,低体质量患者、有抑郁症状患者慎重使用该药物,且不应与茶碱类药物同时应用[1]。
大环内酯类药物的有效成分为链霉菌产生的弱碱性抗菌素,可通过减少炎性细胞的生成、抑制炎性细胞介导的炎性反应、促使炎性细胞提前凋亡、减少下气道黏液分泌量等有效减轻慢阻肺患者炎症,进而减轻患者气道损伤、改善患者肺功能并提高患者生活质量[64,65]。SEEMUNGAL等[66]研究结果显示,红霉素持续治疗1年(250 mg/次,2次/d)可有效降低慢阻肺急性加重次数并缩短急性加重期持续时间。SUZUKI等[67]研究发现,使用红霉素维持治疗1年(200~400 mg/d)的慢阻肺患者感冒及慢阻肺急性加重次数明显减少,住院率有所下降。2011年进行的一项包含1 142例受试者的临床试验发现,口服阿奇霉素(250 mg/次,1次/d,持续治疗1年)可有效降低慢阻肺患者急性加重发生频率,改善患者生活质量[68]。目前,大环内酯类药物治疗的最佳获益人群及其不良反应仍需更多的循证医学证据。
匹多莫德是一种人工合成的二肽类药物,其作为一种免疫调节剂,主要适用于机体免疫功能低下患者。研究表明,匹多莫德可调节慢阻肺急性加重期患者T淋巴细胞免疫功能并维持CD4+/CD8+细胞比值平衡,进而使机体免疫细胞功能保持正常或接近正常、增强机体抗感染能力[69];BENETTI等[70]通过一项随机、双盲、安慰剂对照临床试验证实口服匹多莫德片(800 mg/次,2次/d,持续治疗30 d)可增强慢阻肺患者T细胞活性且耐受性好,但匹多莫德对慢阻肺患者的免疫调节治疗效果仍需更多临床研究证实。
推荐意见2:针对流感病毒、肺炎球菌感染等进行疫苗接种可预防慢阻肺急性加重、降低患者死亡率。
流感疫苗包括三/四价灭活流感疫苗(IIV3/4)和三价减毒活流感疫苗(LAIV3),其通过提前刺激、促使机体产生免疫记忆而保证机体再次受到病毒攻击时迅速启动自我防御机制,但由于流感病毒存在不断变异现象,因此流感疫苗也会以每年两次的频率不断进行革新。研究表明,流感疫苗可减轻重症慢阻肺患者临床症状并降低患者死亡率,且与安慰剂对照组相比,流感疫苗注射组患者中慢阻肺急性加重患者比例明显下降,因此,灭活疫苗甚至减毒活疫苗均是被推荐的,且有证据支持其在老年慢阻肺患者中作用更加明显[71]。多项人群研究表明,慢阻肺尤其是老年慢阻肺患者接种流感疫苗多年后缺血性心脏病患病风险较低,不良反应轻微且短暂[72]。因此,建议慢阻肺患者接种流感疫苗。
肺炎球菌疫苗包括肺炎球菌多糖结合疫苗(PCV13)和肺炎球菌多糖疫苗(PPV23),其多糖抗原主要用于诱导特异性抗体并增强吞噬细胞对肺炎球菌的调节作用、吞噬作用和杀伤作用;同时,其多糖抗原也可通过产生免疫记忆而诱导特异性T细胞和特异性B细胞的产生,进而发挥保护作用。目前,PCV13和PPV23均被推荐用于>65岁的慢阻肺患者,其中PPV23还被推荐用于合并明显慢性心肺疾病的青年慢阻肺患者;有研究表明,慢阻肺患者接种PCV13疫苗2年内呈现出至少与PPV23相同甚至是更强的免疫原性[73]。总体而言,接种肺炎球菌疫苗可减少慢阻肺患者急性加重的可能性,对于慢阻肺患者有益。
其他疫苗主要包括百白破疫苗和带状疱疹疫苗。百白破疫苗的成分包括白喉和破伤风类毒素、杀死导致百日咳或百日咳抗原细菌的全细胞,对于白喉、百日咳和破伤风具有持续性免疫作用。对于青春期未接种百白破疫苗的慢阻肺患者,需要补接种。带状疱疹疫苗可刺激机体产生高水平抗体及特异性细胞免疫反应,且其有效性可持续数年;鉴于慢阻肺患者机体抵抗力较低、接种带状疱疹疫苗有一定保护作用,因此建议≥50岁的慢阻肺患者接种带状疱疹疫苗[74]。
近期研发的新型靶向抗炎治疗药物主要分为抗非T2型炎性反应制剂、抗T2型炎性反应制剂和蛋白酶抑制剂(表2),但现阶段尚缺乏此类药物的获益证据,因此急需严谨的临床试验证实其临床治疗效果、安全性并评估何种表型的慢阻肺患者临床获益更佳。

Summary of clinical trials related to new targeted anti-inflammatory drugs for COPD
| 靶点 | 研究类型 | 受试者 | 剂量/持续时间 | 主要结果 | 次要结果 | |
|---|---|---|---|---|---|---|
| 抗非T2型炎性反应制剂 | ||||||
| 抗IL-8单抗 | 抗IL-8单抗治疗慢阻肺的多中心、随机、双盲、安慰剂对照试验(NCT00035828)[83] | 中重度慢阻肺、病程>50年、MRC≥1分患者 | 800 mg负荷剂量,400 mg/月(持续治疗2个月),随访5个月 | 降低TDI | 健康状况a、肺功能a、6MWTa、沙丁胺醇在抢救中的使用a | |
| 抗CXCR-2、MK-7123 | 抗CXCR-2治疗慢阻肺的对照试验(NCT01006616)[84] | 中重度慢阻肺患者 | 10 mg/d、30 mg/d或50 mg/d,第一阶段6个月,第二阶段18个月,共24个月 | 6个月治疗期间50 mg MK-7123可改善FEV1 | (1)降低目前吸烟患者急性加重频次和痰中MMP-9、MPO含量;(2)血中性粒细胞绝对数减少 | |
| 抗TNF-α、依那西普单抗 | 慢阻肺患者中随机、双盲、多中心临床试验(NCT00789997)[85] | 有吸烟史的中重度急性加重的慢阻肺患者 | 50 mg/次,第0、7天给药,随访90 d | 治疗后14 d后FEV1a | 90 d治疗失败率a、呼吸困难a、健康状况a | |
| 抗TNF-α、英夫利昔单抗 | 英夫利昔单抗治疗中度至重度慢阻肺的多中心、随机、双盲、安慰剂对照试验(NCT00056264)[86] | 中重度慢阻肺、病程>40年、CRQ评分<120分的患者 | 3 mg/kg或5 mg/kg,第0、2、6、12、18、24周给药,随访44周 | CRQ评分a | FEV1a、6WMTa、TDIa、中重度慢阻肺急性加重频次a | |
| 抗TNF-α、英夫利昔单抗 | 单中心、双盲、安慰剂对照、随机化Ⅱ期临床试验(NCT00244192)[87] | 轻中度慢阻肺患者 | 5 mg/kg,第0、2、6周给药,共治疗8周 | 痰液中炎性细胞a | FEV1a、SGRQ评分a | |
| IL-1、MEDI 8968 | 抗IL-1抗体治疗慢阻肺的多中心、随机、安慰剂对照Ⅱ期临床试验(NCT01448850)[88] | 上1年出现2次以上急性加重的45~75岁慢阻肺患者 | 300 mg/4周,共治疗52周 | 中重度急性加重频次a | SGRQ-C评分a | |
| IL-17、CNTO 6785 | 抗IL-17抗体治疗慢阻肺的多中心、随机、安慰剂对照、双盲Ⅱ期临床试验(NCT01966549)[89] | 中重度慢阻肺患者 | 6 mg/kg,第0、2、4、8、12周给药,随访24周 | FEV1%a | SGRQ-C评分a、急性加重频次a | |
| 抗T2型炎性反应制剂 | ||||||
| 抗IL-5、贝那利珠单抗 | 贝那利珠单抗治疗中重度慢阻肺患者的随机、双盲、安慰剂对照Ⅱa期临床试验(NCT01227278)[90] | 上1年痰嗜酸粒细胞比例≥3.0%且至少出现1次急性加重的中重度慢阻肺患者 | 100 mg/次,前3剂每4周1次,序贯100 mg/每8周,共治疗56周 | 中重度急性加重频次a | 改善FEV1、减少血和/或痰嗜酸粒细胞绝对数 | |
| 抗IL-5、贝那利珠单抗 | 贝那利珠单抗治疗中至极重度慢阻肺患者的随机、双盲、双假、安慰剂对照、多中心Ⅲ期临床试验(NCT02155660,NCT02138916)[91,92] | 双联或三联治疗的中至极重度慢阻肺患者,既往1年内至少出现两次中度急性加重或1次重度急性加重 | 30 mg/次或100 mg/次,前3次1次/4周,序贯1次/8周,共治疗56周 | 中重度急性加重频次a | 汇总分析后发现基线血嗜酸粒细胞计数≥220个/μl、在1年前有≥3次急性加重、接受三联疗法的慢阻肺患者使用100 mg贝那利珠单抗可获益,目前正在开展相关研究 | |
| 抗IL-5、美泊利珠单抗 | 美泊利珠单抗治疗慢阻肺患者的随机、双盲、安慰剂对照临床试验(NCT0210548和NCT02105961)[93] | 在过去12个月内外周血嗜酸性粒细胞计数≥300个/μl或筛选时基线血嗜酸粒细胞计数≥150个/μl的中重度慢阻肺患者 | 100 mg/次或300 mg/次,1次/4周,共治疗52周 | (1)降低嗜酸表型的慢阻肺患者的中/重度急性加重年发生率;(2)100 mg美泊利珠单抗可减少急性加重频次,且随着筛选血嗜酸粒细胞计数的增加获益增加、剂量组间获益相似 | 延长初次发生急性加重间隔并降低CAT评分、HRQoL评分,FEV1a、SGRQ评分a | |
| 抗IL-33、Itepekimab | Itepekimab治疗中重度慢阻肺患者安全性和有效性的随机、双盲Ⅱa期临床试验(NCT03546907)[94] | 具有吸烟史、目前维持治疗方案为三联疗法或两种吸入药物的40~75岁中重度稳定期慢阻肺患者 | 300 mg/次,2次/2周,共治疗52周 | 降低既往吸烟患者中/重度急性加重频次 | 改善具有吸烟史的慢阻肺患者FEV1,目前吸烟的慢阻肺患者FEV1a | |
| 蛋白酶抑制剂 | ||||||
| 选择性MMP-9和MMP-12抑制剂(AZD1236) | 多国、随机、双盲、安慰剂对照临床试验[95] | ≥40岁的中重度稳定期慢阻肺患者 | 75 mg/次,2次/d,共治疗6周 | 炎性标志物a | 肺功能a、CCQa、抢救药物应用频次a | |
| NE抑制剂(MR899) | 随机、双盲、安慰剂对照临床试验[96] | 近1年未吸烟的稳定期慢阻肺患者 | 500 mg/次,2次/d,共治疗4周 | 降低尿锁链素水平(病程<13.3年亚组),血EDPa | FEV1%a | |
注:慢阻肺为慢性阻塞性肺疾病的简称;IL=白介素,MRC=英国医学研究委员会呼吸困难问卷评分,TDI=短暂呼吸困难指数,6MWT=六分钟步行试验,CXCR-2=CXC趋化因子受体2,FEV1=第一秒用力呼气容积,MMP-9=基质金属蛋白酶9,MPO=髓过氧化物酶,TNF-α=肿瘤坏死因子α,CRQ=慢性呼吸系统疾病问卷,SGRQ=圣·乔治呼吸问卷,SGRQ-C=SGRQ问卷COPD专用改良版,FEV1%=第一秒用力呼气容积占预计值百分比,CAT=慢性阻塞性肺病评估测试,HRQoL=健康相关生活质量,MMP-12=基质金属蛋白酶12,CCQ=COPD临床问卷,NE=中性粒细胞弹性蛋白酶,EDP=弹性蛋白衍生肽;a表示无临床获益
慢阻肺的免疫调节治疗药物推荐强度详见表3。

慢阻肺免疫调节治疗药物的推荐强度
Grades of recommendations for immunomodulatory drugs for COPD
慢阻肺免疫调节治疗药物的推荐强度
Grades of recommendations for immunomodulatory drugs for COPD
| 慢阻肺免疫调节治疗药物 | 推荐强度 | |
|---|---|---|
| 微生物来源的生物制剂 | ||
| 细菌溶解产物 | A | |
| 卡介菌多糖核酸 | C | |
| 克雷伯杆菌提取物 | C | |
| 人或动物免疫系统的产物 | ||
| 胸腺肽制剂 | C | |
| 化学合成药物 | ||
| 大环内酯类药物 | A | |
| 磷酸二酯酶抑制剂 | B | |
| 匹多莫德 | C | |
| 维生素D a | B | |
| 他汀类药物a | C | |
| 其他功能调节类制剂 | ||
| 流感疫苗 | A | |
| 肺炎球菌疫苗 | A | |
| 新型靶向抗炎治疗药物 | ||
| 抗非T2型炎性反应制剂 | C | |
| 抗T2型炎性反应制剂 | C | |
| 蛋白酶抑制剂 | C | |
注:a表示在慢阻肺中的应用证据较少,尚需更多循证证据支持
推荐意见4:中医药复方及虫草制剂或可通过调节机体免疫功能、提高免疫细胞活性改善慢阻肺稳定期患者生活质量,减少急性加重。
中医药治疗慢阻肺的方法包括内治法、外治法和非药物疗法等,其中内治法指口服中药复方或中成药,外治法包括针、灸、穴位贴敷等,非药物疗法主要指通过传统功法、呼吸导引法锻炼骨骼肌、呼吸肌群,进而改善肺通气量。已有循证证据证实玉屏风散可有效改善慢阻肺稳定期患者生活质量、减少急性加重[97];太极拳可有效改善慢阻肺患者股四头肌肌力等[98]。此外,还有针对慢阻肺免疫调节的临床与基础研究报告[99,100]。
有系统综述及Meta分析表明,中药复方对慢阻肺有一定疗效[101,102]。近年来,除动物实验证实中药复方可通过调节免疫干预慢阻肺气道炎性反应、气道重塑及黏液高分泌外,也有临床研究显示中药复方对慢阻肺具有免疫调节作用,如自拟中药复方、院内制剂等可改善慢阻肺患者核因子κB(nuclear factor kappa-B,NF-κB)、toll样受体4(TLR4)mRNA表达水平[103],调节Th1细胞、Th2细胞、Th17细胞、IL-17、Th1/Th2细胞比值、CD4+CD25+Fox3+ Tregs[104,105,106]。另有多项临床研究证实,虫草制剂联合常规西药、中药或非药物疗法可更好地改善慢阻肺稳定期患者生活质量并调节免疫相关指标,如联合使用虫草制剂金水宝可调节CD4+细胞、CD4+/CD8+细胞比值、Th17细胞/Treg比值,改善IgA、IgG、IgM水平[107,108,109,110,111,112,113,114,115,116]。
一项纳入8项临床试验的Meta分析结果显示,穴位贴敷可提高慢阻肺患者CD4+/CD8+细胞比值和CD8+细胞数量,减少急性加重次数[117]。另有研究表明,穴位贴敷联合针灸治疗能有效减轻慢阻肺稳定期患者临床症状,提高患者T淋巴细胞亚群CD3、CD4水平及体液免疫IgG水平[118]。
长期临床实践表明中药复方内服和/或外用、针灸、传统功法等均可有效改善慢阻肺患者生活质量,减少急性加重;多项动物实验证实中药复方、针灸可调节慢阻肺模型大鼠免疫功能,但尚缺乏规范的多中心、大样本、随机双盲临床研究,亟待进行大样本规范化临床研究以提供循证证据。
免疫调节剂种类繁多、作用各异,用以治疗慢阻肺的临床研究证据尚有待进一步在真实世界中进行验证。对于临床医师,选择适当免疫调节剂的关键在于对其免疫调节机制的正确认识。笔者在此也希望借本专家共识编写契机进一步提高对慢阻肺免疫发病机制的认识、发现新的免疫调节治疗靶点,而随着研究证据的不断增加及临床经验的不断积累,本专家共识将适时进行更新。
执笔专家(按姓氏拼音顺序):陈亚红(北京大学第三医院),冯淬灵(北京大学人民医院),王婧(中国医学科学院基础医学研究所),王炜(首都医科大学基础医学院),谢俊刚(华中科技大学同济医学院附属同济医院),尹燕(中国医科大学附属第一医院)
指导专家(按姓氏拼音顺序):曹彬(中日友好医院),陈荣昌(深圳市人民医院 深圳市呼吸疾病研究所/广州医科大学附属第一医院 广州呼吸健康研究院 国家呼吸系统疾病临床医学研究中心),陈燕(中南大学湘雅二院),陈志华(浙江大学医学院附属第二医院),康健(中国医科大学附属第一医院),苗青(中国中医科学院西苑医院),孙德俊(内蒙古自治区人民医院),孙永昌(北京大学第三医院),王玮(中国医科大学附属第一医院),温桂兰(南昌大学第一附属医院),熊维宁(上海交通大学医学院附属第九人民医院),杨汀(中日友好医院),姚婉贞(北京大学第三医院),张静(复旦大学附属中山医院),张炜(上海中医药大学附属曙光医院)
项目秘书:孙丽娜(北京大学第三医院)
本专家共识无利益冲突。
IPGRP-2022CN267
慢性阻塞性肺疾病(简称慢阻肺)是一种异质性疾病,其发病机制主要涉及炎性反应、蛋白酶-抗蛋白酶失衡、氧化应激、细胞凋亡与肺结构细胞代偿-修复不平衡引起的气道重塑和肺泡破坏,其中与免疫学相关的机制近年来受到广泛关注和重视。肺组织结构细胞和固有/适应性免疫细胞共同参与并维持局部组织微环境稳态,当呼吸系统受到不同物质刺激时,区域免疫系统表现出不同的应答特点,引发不同的生理和病理改变。
针对《慢性阻塞性肺疾病诊治指南(2021年修订版)》发布之后临床实践中关注的热点问题之一——慢阻肺的免疫调节治疗,《慢性阻塞性肺疾病免疫调节治疗专家共识》撰写组经充分讨论后达成以下4条推荐意见:(1)细菌溶解产物、磷酸二酯酶抑制剂、大环内酯类药物等生物、化学制剂均可通过增强机体免疫功能和提高免疫细胞活性而发挥对慢阻肺的免疫调节作用;(2)针对流感病毒、肺炎球菌感染等进行疫苗接种可预防慢阻肺急性加重、降低患者死亡率;(3)他汀类药物及维生素D等具有免疫调节作用,对慢阻肺可能有一定的治疗作用,但二者在慢阻肺中的应用证据较少且存在一定不良反应,仍需进一步积累证据;(4)中医药复方及虫草制剂或可通过调节机体免疫功能、提高免疫细胞活性改善慢阻肺稳定期患者生活质量,减少急性加重。
根据2001年牛津循证医学中心制定的临床证据分级和推荐强度系统,推荐强度为A的慢阻肺免疫调节治疗药物包括细菌溶解产物、大环内酯类药物、流感疫苗、肺炎球菌疫苗,推荐强度为B的慢阻肺免疫调节治疗药物包括磷酸二酯酶抑制剂、维生素D,推荐强度为C的慢阻肺免疫调节治疗药物包括卡介菌多糖核酸、克雷伯杆菌提取物、胸腺肽制剂、匹多莫德、他汀类药物、抗非T2型炎性反应制剂、抗T2型炎性反应制剂、蛋白酶抑制剂。



























