
慢性阻塞性肺疾病(以下简称慢阻肺)是一种常见的慢性气道异质性疾病。近年来,尽管国内外慢阻肺相关研究不断深入,管理日趋完善,但仍有许多难点亟待解决。2022年9月,《柳叶刀》杂志发布《消除慢阻肺之路》,该文件针对慢阻肺的认识、诊断、评估和个体化治疗等方面提出了新理念并提供临床诊疗指导。本文重点对该文件中慢阻肺的分类、诊断标准及诊断建议、慢阻肺的急性加重和迈向消除慢阻肺5个方面进行介绍和解读,以期为我国临床工作者开展慢阻肺相关研究和管理提供一定的参考及启示。

本刊2023年版权归中国全科医学杂志社所有
未经编辑部许可,不得任意转载和摘编
本刊所发表作品仅为作者观点,并不代表编委会和编辑部意见
如有印装质量问题请向本刊发行部调换
慢性阻塞性肺疾病(以下简称慢阻肺)是一种以进行性气流受限为特征的慢性气道炎症性疾病,主要症状为咳嗽、咳痰和进行性加重的呼吸困难[1]。截至2017年,慢阻肺已成为全球第三大死因[2],亦是2019年全球寿命损失的第八大原因[3],上述数据提示慢阻肺作为全球公共卫生问题广受关注。因此2022-09-05《柳叶刀》文件《消除慢阻肺之路》正式发布,从9个方面详细阐述了慢阻肺,(1)慢阻肺:一项全球健康危机;(2)慢阻肺:不仅是吸烟;(3)为什么要重新考虑慢阻肺的诊断标准;(4)诊断慢阻肺的建议;(5)有症状的慢阻肺患者的诊断;(6)慢阻肺的关键:急性加重;(7)慢阻肺的治疗如何才能更有效;(8)要实现慢阻肺的控制需要什么;(9)迈向消除慢阻肺[4]。目前国内外指南对于慢阻肺的各亚型分类尚无明确的推荐意见,慢阻肺的诊断主要依赖肺量计测定,这些局限可能无法为疾病表型差异巨大的慢阻肺患者提供个体化诊治方案,从而难以实施精准治疗。此外,目前临床对慢阻肺患者的管理更多的是关注缓解症状和减少急性发作,达不到控制疾病,更谈不上消除疾病。故本文重点对该文件中慢阻肺的分类、诊断标准及诊断建议、慢阻肺的急性加重和迈向消除慢阻肺5个方面进行介绍和解读,以期为相关工作提供建议和指导,并为广大慢阻肺患者的诊治提供帮助。
吸烟是慢阻肺最重要的危险因素,但近年来吸烟以外的危险因素也逐渐被证明与慢阻肺的发生、发展密切相关,包括空气污染、职业暴露、哮喘控制不良、环境二手烟、传染病和社会经济地位低下[5]。这些危险因素可能通过不同的病理生理机制引发多种临床表现。提高对吸烟以外危险因素的认识,可为非吸烟所致新发慢阻肺患者的诊疗提供思路。因此《柳叶刀》文件系统地提出了慢阻肺的新分类(表1),其全面体现了慢阻肺病因的异质性,提示在整个生命过程中存在多种保护性干预靶点可进行慢阻肺预防,强调疾病分类有利于对高风险个体展开有针对性地筛查,并提高大家对非吸烟风险的认识。已有研究关注遗传因素对慢阻肺的影响[6],未来可继续研究潜在基因异常和蛋白质变化对慢阻肺发生和疾病进程的影响,尤其可着重关注驱动疾病进展的潜在分子类型,为药物开发提供新靶点。此外在慢阻肺分类的临床和基础研究中,可以针对不同分类、分组的目标人群建立相应的动物模型,有针对性地探索慢阻肺的发病机制。总之,新分类迈出了辨别慢阻肺不同病理、生理机制的重要一步,为慢阻肺的预防、治疗创新和精准医疗打开理念上的窗口。
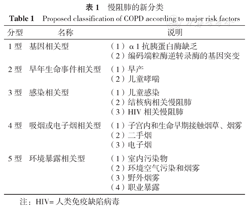
慢阻肺的新分类
Proposed classification of COPD according to major risk factors
慢阻肺的新分类
Proposed classification of COPD according to major risk factors
| 分型 | 名称 | 说明 |
|---|---|---|
| 1型 | 基因相关型 | (1)α1抗胰蛋白酶缺乏(2)编码端粒酶逆转录酶的基因突变 |
| 2型 | 早年生命事件相关型 | (1)早产(2)儿童哮喘 |
| 3型 | 感染相关型 | (1)儿童感染(2)结核病相关慢阻肺(3)HIV相关慢阻肺 |
| 4型 | 吸烟或电子烟相关型 | (1)子宫内和生命早期接触烟草、烟雾(2)二手烟(3)电子烟 |
| 5型 | 环境暴露相关型 | (1)室内污染物(2)环境空气污染和烟雾(3)野外烟雾(4)职业暴露 |
注:HIV=人类免疫缺陷病毒
慢阻肺是慢性气道炎症性疾病,通常涉及邻近肺泡和血管的破坏,随着时间推移,慢性炎症的进展会导致肺泡进一步扩大,进而影响通气/血流(V/Q)比值,发生不同程度的低氧血症和高碳酸血症,最终出现呼吸衰竭[7]。目前慢阻肺诊断的"金标准"是患者吸入支气管舒张剂后第1秒用力呼气容积/用力肺活量比值(FEV1/FVC%)<70%为确定存在持续气流受限的界限,若能同时排除其他已知病因或具有特征病理表现的气流受限疾病,则可明确诊断为慢阻肺,而气流受限严重程度则依据FEV1下降程度分级,意味着慢阻肺的诊断完全依赖于肺功能中气流受限的存在,其缺点在于:(1)不同患者可能对支气管舒张剂的反应不同,造成诊断误差;(2)特异性不高,比如无法区分哮喘和慢阻肺所致的气流受限[8];(3)没有关注慢阻肺的动态变化,更重要的是忽略了其潜在病理生理学的变化,气流受限可能在慢阻肺较晚期才能检测到,因此现有的慢阻肺诊断标准忽视了疾病早期的病理变化。《柳叶刀》文件从3个方面指出了现有慢阻肺诊断标准的局限性(表2)。

慢阻肺诊断标准的局限性
Limitations in diagnostic criteria for COPD
慢阻肺诊断标准的局限性
Limitations in diagnostic criteria for COPD
| 关注不足方面 | 局限性 |
|---|---|
| 慢阻肺的肺外表现 | 慢阻肺的合并症对其病程的影响 |
| 肺功能轨迹 | (1)多种个体和环境因素影响肺功能的数值和峰值、平台期的持续时间以及随后的肺功能下降速度(2)不同肺功能轨迹发展为慢阻肺的患者可能具有不同的潜在病理机制,进而可能存在不同的临床表现、预后和治疗需求 |
| 组织病理学改变 | (1)气道重塑特点存在差异(2)炎性反应类型存在差异(3)肺部微生物组群存在差异 |
慢阻肺的合并症在临床上很常见,比如心血管疾病、骨质疏松、精神疾病如焦虑、抑郁以及糖尿病等,极大地增加了慢阻肺患者的负担和死亡率[9,10]。但目前关于慢阻肺与合并症的相关认识大致归纳为以下3方面:(1)慢阻肺和合并症可能有共同的危险因素和病理途径,例如衰老及烟雾暴露等;(2)合并症会加重慢阻肺,导致症状进一步恶化,例如抑郁症会导致体力活动减少、体质量增加和肺功能下降[11];(3)对合并症的诊治不及时会对慢阻肺患者呼吸道症状或肺功能造成不良影响。现有的指南未能就慢阻肺患者合并症的识别、评估和管理提供明确的建议。需要更多研究了解合并症对患者的整体影响和慢阻肺与其合并症的潜在联系机制,建立能够改善临床结局的可靠测量工具,不断完善对慢阻肺合并症的评估,最终在临床实践中实施量化和管理。
研究表明生命过程中的大多数肺功能变化趋势可分为6个主要轨迹(图1),包括持续高水平肺功能、平均水平肺功能、低于平均水平肺功能、持续低水平肺功能、早年肺功能低于平均水平且成年后加速下降、早年低水平肺功能随后加速发育最终正常下降[12]。在慢阻肺患者的日常临床评估中加入"金标准"以外的肺功能指标(如静息容量、呼吸道阻力、弥散功能、强迫振荡技术、心肺运动试验)被证明是进行不同患者管理的关键[13]。对肺功能轨迹的不断认识促使临床关注慢阻肺的早期病理、生理变化,以识别并诊断早期患者,从而提高慢阻肺的管理效率。
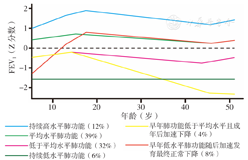

注:FEV1=第1秒用力呼气容积
慢阻肺患者进行性气流受限主要由两个主要病理过程引起,包括小气道的重塑和肺气肿不断加重导致的肺实质破坏。这些病理改变与肺内慢性炎症息息相关,同时炎性反应的严重程度也随疾病进展而增加[14]。异常炎性反应是慢阻肺的核心之一,炎性细胞可通过释放蛋白酶、氧化剂和细胞毒性产物导致细胞外基质的凋亡和降解,但这些作用的强度也各不相同;此外各炎症亚型也具有异质性,可能是嗜酸粒细胞炎症亚型或嗜中性粒细胞炎症亚型。因此需要更多的研究来了解慢阻肺患者肺部炎症的不同亚型,以及这些亚型与临床表现、诊断、治疗反应和预后的关系,特别是有必要了解炎症是如何随着不同的环境刺激而变化的,以及同一患者的炎性反应是如何随着时间的推移而变化的。
因此临床医生需要关注慢阻肺的肺外表现,如合并症、肺功能轨迹的变化、炎症表型的不同等更广泛的信息,形成更全面完整的诊断流程,以期实现疾病早期的诊断和管理。
最新的慢性阻塞性肺疾病全球倡议(GOLD)2022仍未充分考虑慢阻肺病理、生理过程的异质性,即可能出现需要早期干预的年轻患者诊断不足,或者在不需要治疗的老年患者中出现过度诊断。因此期待一种新的诊断方法能对气流受限进行更广泛的定义,同时兼顾生命早期和其他损害肺功能的因素,而不仅是单纯的肺功能测定。《柳叶刀》文件依据目前对慢阻肺异质性的理解,提出在新的诊断方法中需考虑症状、暴露以及生理、放射学和病理改变等作用(表3),并制定了新的诊断流程图(图2)。此外《柳叶刀》文件还提到了慢阻肺类型、内型和表型之间的关联(图3)。
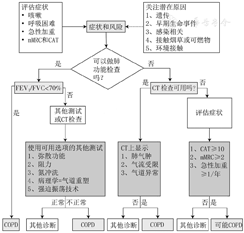

注:mMRC=改良英国医学研究学会呼吸困难指数,CAT=慢性阻塞性肺疾病评估测试,FVC=用力肺活量,COPD=慢性阻塞性肺疾病
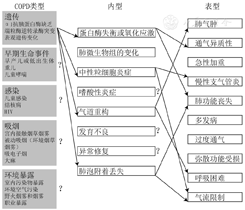

注:HIV=人类免疫缺陷病毒,?代表COPD类型、内型和表型之间关联暂时不明确

慢阻肺的诊断注意事项
Diagnostic considerations in chronic obstructive pulmonary disease
慢阻肺的诊断注意事项
Diagnostic considerations in chronic obstructive pulmonary disease
| 项目 | 补充 |
|---|---|
| 慢性呼吸道症状 | (1)呼吸困难(2)咳嗽(3)咳痰 |
| 呼吸道症状急性恶化 | 无 |
| 病史 | (1)早产(2)儿童呼吸道感染(肺炎、病毒性细支气管炎、肺结核)(3)儿童呼吸道疾病(哮喘、婴儿慢性肺疾病) |
| 暴露 | (1)吸烟、环境烟草烟雾、电子烟(2)环境暴露(室内燃料烟雾、环境空气污染或烟雾、野外烟雾、职业暴露) |
| 遗传 | (1)α1抗胰蛋白酶缺乏(2)端粒酶多态性(TERT基因)(3)非吸烟者的家族史 |
| 气道重塑 | (1)气道平滑肌细胞肥大(2)基底膜增厚(3)慢性气道炎症(4)细胞外基质病理性更新(5)CT检查显示气道壁厚度增加 |
| 肺功能测试显示持续气流受限 | (1)第1秒用力呼气容积/用力肺活量比值(2)特定的有效气道阻力(3)肺清除指数(4)峰值流量减少(5)异质性的氮冲洗测量(6)强制示波法(5 Hz和19 Hz下的振荡阻力差异,电抗面积) |
| 实质异常 | (1)CT检查显示≥5%肺气肿受累(定义为肺密度低于-950 HFU的区域)(2)CT检查显示末端细支气管的破坏(3)弥散功能降低 |
注:TERT=端粒酶逆转录酶,HFU=高频超声
由图2可知,该诊断流程图的重点首先是识别症状和风险因素,症状主要有咳嗽、呼吸困难和有反复急性加重,风险因素包括吸烟和非吸烟;其次该流程图显示了肺功能的多项指标、CT检查和病理改变等的重要性,强调了推荐基于全面病史和体格检查的个性化评估策略。
通过该诊断流程图可以在气流受限出现前早期识别慢阻肺,突出了慢阻肺临床和病理、生理特征的异质性,反映了不同危险因素的重要性,并将诊断标准扩展到肺功能检测之外。但不可避免的是部分慢阻肺患者可能会低估自身症状,可能将活动诱发的症状归因于身体功能失调或年龄,这是尤其值得关注的。此外,该流程图突出了CT检查在慢阻肺诊断中的作用。许多慢阻肺高危者已经接受了胸部CT检查或胸部X线检查进行肺癌筛查,然而,这些胸部CT检查数据并没有在慢阻肺的临床实践中得到充分应用,也没有被纳入慢阻肺的临床诊断和管理中[15]。越来越多的证据表明,CT检查数据变化可以辅助识别当前和既往吸烟者中存在气流受限的患者[16]。其中一种旨在识别小气道异常的图像分析技术——参数响应映射(PRM),可以根据患者吸气和呼气时CT的动态图像将肺部区域分类为正常、肺气肿或非气肿性空气潴留3个部分[17],为慢阻肺的诊断提供影像学证据。
CT检查可提供大量的形态和功能信息,有助于在临床环境中对慢阻肺患者进行表型分析。CT检查通过对局部肺气肿破坏、气道重塑和通气/灌注比异常进行非侵入性评估,为管理慢阻肺提供了新手段。CT检查可以准确地诊断肺气肿和中央气道重塑,而无需进行有创的肺活检。由于空气和正常肺实质之间具有极好的分辨率对比,可以使用软件进行定量测量。因此,除了诊断慢阻肺之外,基于CT图像的定量测量还可对疾病严重程度和表型进行分期、分类[18,19],并可用于手术减少肺气肿患者的随访。综上,未来在CT方案标准化方面的研究,特别是定量成像和人工智能技术(即深度学习)的研究,可能有助于揭示慢阻肺结构和功能损伤的机制,以及开发新的治疗方法。
由图3可知慢阻肺类型可能是由不同的分子机制(内型)引起的,这些机制反过来又影响了疾病的临床表型。所以有些患者可能症状不典型,导致诊断延迟、疾病进展,有些慢阻肺患者即使前来就诊但由于内型未知,从而导致个体化诊疗不足。此外由于内型和表型均具有多样性,患者的治疗反应也有多样性。现在关于慢阻肺类型、内型和表型之间关联的研究还不充分,未来可进一步研究其具体的相互关系,从而为慢阻肺的精准诊断和治疗提供帮助。
慢阻肺急性加重可导致肺功能显著下降,严重影响患者的健康和生活质量,是引起慢阻肺患者死亡的重要原因[20]。但慢阻肺患者和医务人员经常忽视潜在的呼吸道症状变化,这导致其对急性加重的认识不足,最终导致诊断和治疗不足[21]。
慢阻肺急性加重目前被定义为"患者呼吸道症状的急性恶化,导致需要额外的治疗"[22]。目前该诊断主要依赖于临床判断,由于其与其他肺源性疾病如肺炎、气胸、胸腔积液、肺栓塞和非肺源性疾病如充血性心力衰竭和心律失常等有相似的临床表现[23],常难以鉴别诊断。当前的定义并未关注诱发慢阻肺的病因和潜在过程,没有应用可能的生物标志物等对急性加重进行分类,因此可能出现误诊,导致慢阻肺急性加重不能及时诊疗。此外急性加重期肺部炎症的增加可能对全身炎症产生重要影响。反之全身炎性反应的激增可能对心脏、外周血管系统、胃肠道、肾脏、肌肉骨骼和骨髓系统产生重要影响。急性加重的治疗对肺外器官功能的影响尚不明确。因此针对上述问题开展研究可为慢阻肺急性加重患者肺部和非肺部治疗靶点的开发提供证据。
《柳叶刀》文件提出了慢阻肺急性加重的新诊断标准,即在没有急性心脏缺血、充血性心力衰竭或肺栓塞证据的情况下,患者出现咳嗽、咳痰或呼吸困难加重,以及至少以下一种情况:气流受限、呼吸道或全身炎症增加、存在细菌或病毒感染的证据。相比较GOLD 2022,该标准更关注实质性证据,并提供了未来可供选择的客观指标检测方向,比如血清中性粒细胞、嗜酸粒细胞或C反应蛋白等实验室检查指标,以及胸部X线检查和心脏超声检查等客观检查,为以后临床慢阻肺急性加重的诊断和治疗提供了新思路。
对于慢阻肺患者因急性事件就诊时的评估,《柳叶刀》文件也给出了特别需要注意的地方。首先应该明确急性加重的炎症特征,尽可能区分嗜酸粒细胞炎症亚型或嗜中性粒细胞炎症亚型,并确认该次急性加重的炎症特征是否属于细菌性的;其次建议慢阻肺患者应在合理的时间范围内进行随访,包括对其临床、生理和生物特征的再次评估。为了定义和内分慢阻肺急性加重并划定潜在原因,需要一个标准化的调查小组,《柳叶刀》文件已经提出了一种这样的方法(图4),对此笔者强烈支持前瞻性测试和迭代改进。病情加重后的随访应包括对病情的临床、生理和生物学特征的重新评估,并应在合理的时间范围内进行。资源因国家而异,拟议的建议并不一定适用于所有卫生保健系统。明确慢阻肺急性加重的内型和病因,以及治疗后的定期随访将进一步加深临床医生对慢阻肺急性加重的认识,可在临床实践中为慢阻肺的诊断和治疗提供参考。
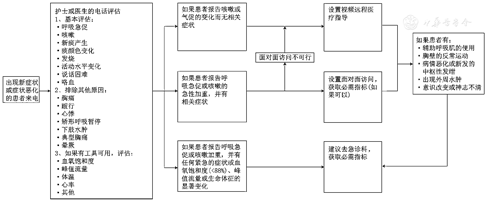

注:必需指标包括呼吸频率、血氧饱和度、胸部影像、全血细胞计数、C反应蛋白及D-二聚体的检测
关于慢阻肺急性加重严重程度的评估,GOLD 2022将慢阻肺急性加重的程度分为3度,即轻度:门诊患者仅用短效支气管舒张剂治疗;中度:门诊患者接受短效支气管舒张剂加抗生素和/或口服皮质类固醇治疗;重度:患者需要住院或去急诊室进行进一步治疗。但慢阻肺的诊疗技术与地域、医院与医疗资源的分布密切相关,全球存在很大不平衡。这些非医疗因素、非疾病因素可能干扰对慢阻肺急性加重危险程度的判断。因此对于严重程度的评估,《柳叶刀》文件提议取消轻、中、重度急性加重的定义,转而划分为重度急性加重或非重度急性加重,具体标准为:(1)运用辅助呼吸肌呼吸、反常的胸壁运动,或两者兼有;(2)临床上显著的低氧血症和新的或恶化的高碳酸血症或呼吸性酸中毒;(3)意识改变(意识模糊、嗜睡、昏迷);(4)对初始医疗治疗没有反应;(5)右心衰竭、心脏缺血、血流动力学不稳定或有临床意义的心律失常。上述标准中任何一个的存在均足以将慢阻肺急性加重定义为重度,并可计算严重性评分(上述每项对应1分,总分1~5分)。此类评分能够在早期有效的识别重度急性加重患者,并对其实施干预,避免了非重度急性加重患者药物滥用。未来可进一步回归疾病本身,从气道炎症、气流受限和全身症状的严重程度出发,寻找灵敏且高度特异的生物标志物,提高诊断准确性。
远程医疗使医务人员能够接触到难以获得医疗帮助的患者,特别是在服务不到的人群中,并且其具有降低医疗保健成本的潜力。当患者出现急性加重的呼吸道症状时,其经常通过电话联系医务人员。有证据表明,基于远程医疗的症状报告有助于早期发现急性加重[24],但没有明确的指导意见。《柳叶刀》文件提出的慢阻肺急性加重评估流程图(图4)结合了远程医疗来评估疑似慢阻肺急性加重患者。
远程医疗服务可以帮助管理稳定期患者并及时诊断和治疗病情恶化的患者。该流程图包括面对面就诊,如果面对面就诊存在障碍或门诊就诊时间有限,视频虚拟就诊可以取代面对面就诊。但也有研究表明远程医疗对慢阻肺患者的死亡率、生活质量、运动能力和急性加重相关结局的影响是有限的[25],所以远程医疗在慢阻肺中的作用需要进一步探索。
《柳叶刀》文件针对"迈向消除慢阻肺"提出了具体的建议及相关目标(表4)。
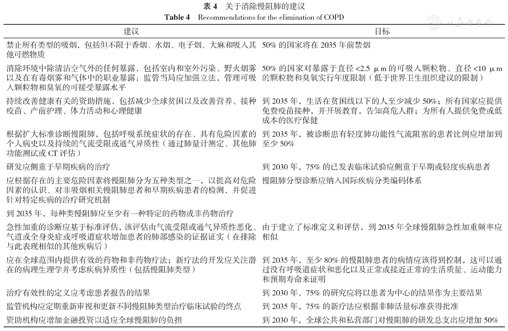
关于消除慢阻肺的建议
Recommendations for the elimination of COPD
关于消除慢阻肺的建议
Recommendations for the elimination of COPD
| 建议 | 目标 |
|---|---|
| 禁止所有类型的吸烟,包括但不限于香烟、水烟、电子烟、大麻和吸入其他可燃物质 | 50%的国家将在2035年前禁烟 |
| 消除环境中除清洁空气外的任何暴露,包括室内和室外污染、野火烟雾以及在有毒烟雾和气体中的职业暴露;监管当局应加强立法,管理可吸入颗粒物和臭氧的可接受暴露水平 | 50%的国家对暴露于直径<2.5 μm的可吸入颗粒物、直径<10 μm的颗粒物和臭氧实行年度限制(低于世界卫生组织建议的限制) |
| 持续改善健康有关的资助措施,包括减少全球贫困以及改善营养、接种疫苗、产前护理、体力活动和心理健康 | 到2035年,生活在贫困线以下的人至少减少50%;所有国家应提供免费疫苗接种,并开展教育,告知高危人群;为所有人提供免费或低成本的医疗保健 |
| 根据扩大标准诊断慢阻肺,包括呼吸系统症状的存在、具有危险因素的个人病史以及持续的气流受限或通气异质性(通过肺量计测定、其他肺功能测试或CT评估) | 到2035年,被诊断患有轻度肺功能性气流阻塞的患者比例应增加到至少50% |
| 研发应侧重于早期疾病的治疗 | 到2030年,75%的已发表临床试验应侧重于早期或轻度疾病患者 |
| 应根据存在的主要危险因素将慢阻肺分为五种类型之一,以提高对危险因素的认识、对非吸烟相关慢阻肺患者和早期疾病患者的检测,并促进针对特定疾病的治疗研究机制 | 慢阻肺分型诊断应纳入国际疾病分类编码体系 |
| 到2035年,每种类慢阻肺应至少有一种特定的药物或非药物治疗 | |
| 急性加重的诊断应基于标准评估,该评估由气流受限或通气异质性恶化、气道或全身炎症或呼吸道症状增加患者的肺部感染的证据证实(在排除与此表现相似的其他疾病后) | 由于建立了标准定义和评估,到2035年全球慢阻肺急性加重频率应相似 |
| 应在全球范围内提供有效的药物和非药物疗法;新疗法的开发应关注潜在的病理生理学并考虑疾病异质性(包括慢阻肺类型) | 到2035年,至少80%的慢阻肺患者的病情应该得到控制,这可以通过没有呼吸道症状和恶化以及正常或接近正常的生活质量、运动能力和预期寿命来证明 |
| 治疗有效性的定义应考虑患者报告的结果 | 到2030年,75%的研究应将以患者为中心的结果作为主要结果 |
| 监管机构应定期重新审视和更新不同慢阻肺类型治疗临床试验的终点 | 到2035年,75%的新疗法应根据非肺活量标准获得批准 |
| 资助机构应增加金融投资以适应全球慢阻肺的负担 | 到2030年,全球公共和私营部门对慢阻肺的研发总支出应增加50% |
该推荐建议立足于以下原则,包括重视吸烟与非吸烟因素重叠或相互作用的风险;改进用于早期疾病识别的预测和诊断工具;提高治疗效果并尽可能达到治愈。《柳叶刀》文件归纳出了6项核心战略:(1)扩大对慢阻肺多种相互作用的风险因素的理解;(2)根据潜在的致病机制(包括遗传、早期生命事件、呼吸道感染、烟草和其他环境暴露)将疾病分为不同的类型;(3)对慢阻肺实施更全面的诊断,在发生不可逆转的病理变化之前发现轻微的改变;(4)在对慢阻肺病理生理学、症状以及患者的需求、能力和偏好全面评估的基础上,制定稳定期和急性加重期个性化的预防和治疗策略;(5)不局限现有的主要对症治疗方案,投入开发新治疗手段和再生疗法;(6)积极制定公共卫生预防策略,禁止吸烟和保持空气清新。《柳叶刀》文件重点强调了早期慢阻肺的诊断、治疗和预后,早期慢阻肺是目前国内外关注的热点问题,相关研究有利于明确早期慢阻肺发病机制,从而指导病情评估和个体化治疗。该推荐建议也重点突出了消除慢阻肺危险因素的作用,消除危险因素不仅可预防慢阻肺,还将有助于终生保持呼吸健康,从而延长生存期。
慢阻肺的预防、诊断和治疗要强调非吸烟危险因素预防和初级预防,需关注从胚胎开始到整个生命过程的肺部健康。通过对易感人群在疾病早期的病理生理学等进行识别,从而促进慢阻肺的早诊断和早治疗。未来慢阻肺将需要多方位的探索,包括改进疾病亚型分类、分期和诊断工具等,针对性地研究开发可能逆转和治愈慢阻肺的治疗方法。
本文无利益冲突。
2022年《柳叶刀》文件《消除慢性阻塞性肺疾病之路》(以下简称文件)指出,慢性阻塞性肺疾病(简称慢阻肺)已成为全球第三大死因及第八大寿命损失原因。慢阻肺是一种具有高度异质性的慢性气道疾病,现有国内外指南缺乏针对慢阻肺不同表型的精准诊疗策略,实现慢阻肺个体化诊治道阻且长。
文件系统地提出慢阻肺的新分类,包括基因相关型、早年生命事件相关型、感染相关型、吸烟或电子烟相关型及环境暴露相关型。慢阻肺的新分类充分体现了病因的异质性,提示在整个生命过程中可能存在多种干预靶点进行慢阻肺预防,同时强调疾病病因分类有利于针对性地对高风险个体进行筛查。在慢阻肺诊断方面,目前肺功能"金标准"潜在忽视了慢阻肺病理生理过程中的动态变化,存在诊断不足或过度诊断的弊端;文件提出慢阻肺的诊断不应仅依靠肺功能测定,还需兼顾不同生命周期和其他影响肺功能的因素,并创新性地制定了涉及危险因素、临床症状、肺生理指标、影像学和病理学变化等因素的多维度诊断流程。
关于慢阻肺急性加重,文件建议将生物标志物(包括血清中性粒细胞、嗜酸粒细胞或C反应蛋白等)及特殊检查(胸部X线检查和心脏超声检查等)等客观证据融入慢阻肺急性加重的诊断标准;同时,文件提议取消既往单纯参照治疗方式的慢阻肺急性加重严重程度分类,转而依据症状(意识改变、心力衰竭等)、体征(呼吸肌辅助呼吸、胸壁反常运动等)、客观检查(血气分析、心脏检查等)及初始治疗的反应将慢阻肺急性加重分为重度或非重度。
综上,《柳叶刀》文件推陈出新,顺应当前智慧医疗的纵深发展,强调了远程医疗服务在慢阻肺全程管理中的潜在作用,为慢阻肺的危险防控、早期诊断、病情评估及个体化治疗等方面指明了全新方向,对于未来全球迈向"消除慢阻肺之路"提供了具体的建议和目标。






























