
以程序性死亡蛋白-1(PD-1)抑制剂为代表的免疫治疗近年来逐步成为晚期非小细胞肺癌(NSCLC)的标准治疗方案,改变了该病的治疗格局。大部分PD-1抑制剂相关研究排除了70或75岁以上的老年晚期NSCLC患者,使得老年患者使用PD-1抑制剂治疗的疗效及安全性数据相对较少。
本研究旨在探讨PD-1抑制剂在老年晚期NSCLC患者中的疗效及安全性。
选取2018年10月至2021年11月在甘肃中医药大学第四附属医院胸外科和肿瘤科接受PD-1抑制剂单药治疗的65岁及以上的晚期NSCLC患者,最终纳入符合标准的患者63例。本研究中PD-1抑制剂均为已经在中国获批上市的PD-1抑制剂单抗,包括卡瑞利珠单抗、信迪利单抗和帕博利珠单抗。通过医院电子病历系统整理患者接受治疗后的疗效及安全性数据,并对患者进行定期随访获取长期生存数据,随访至2022-03-15,收集患者PD-1抑制剂的疗效资料、老年晚期NSCLC患者的预后情况和接受PD-1抑制剂治疗的毒副作用情况,采用Cox比例风险模型探讨老年晚期NSCLC患者预后的影响因素。
63例老年晚期NSCLC患者的中位年龄为71(65,89)岁。接受PD-1抑制剂治疗期间的最佳疗效评估结果显示无患者完全缓解,14例患者获得部分缓解,21例患者疾病稳定,28例患者疾病进展。PD-1抑制剂单药治疗晚期NSCLC患者的客观缓解率(ORR)为22.2%(14/63),疾病控制率(DCR)为66.7%(14/21)。预后数据提示63例老年晚期NSCLC患者的中位无进展生存期(PFS)为3.3(2.0,4.6)个月。中位OS为10.2(6.1,14.3)个月。接受PD-1单药治疗期间,63例老年晚期NSCLC中46例患者出现了治疗相关的毒副作用(73.0%),其中3级以上的毒副作用发生率为14.3%(9/63)。常见的毒副作用类型有乏力、腹泻、皮疹和肝功能异常,发生率分别为23.8%(15/63)、19.1%(12/63)、15.9%(10/63)和14.3%(9/63)。Cox比例风险回归分析结果显示,东部肿瘤协作组(ECOG)体质状态评分和转移病灶数目是老年晚期NSCLC患者接受PD-1抑制剂后PFS的独立影响因素(HR=0.56、0.48)。
PD-1抑制剂单药在老年晚期NSCLC患者中具有初步的疗效和可耐受的安全性。ECOG体质状态评分和转移病灶数目可能是影响该类患者PFS的潜在风险因素。

本刊2023年版权归中国全科医学杂志社所有
未经编辑部许可,不得任意转载和摘编
本刊所发表作品仅为作者观点,并不代表编委会和编辑部意见
如有印装质量问题请向本刊发行部调换
肺癌是全球常见的恶性肿瘤之一,每年新发病例约为210万例,死亡病例约为177万例[1]。中国的流行病学数据显示每年约有81.5万例新发病例和71.5万例死亡病例[2]。非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌中最常见的类型,约占所有肺癌的85%[3]。因此,中国每年新增的NSCLC患者约有69.3万。近年来晚期NSCLC治疗领域取得了突破性的研究进展。既往预后相对较差的驱动基因阴性的晚期NSCLC患者中以程序性死亡蛋白-1(programmed death-1,PD-1)抑制剂为代表的免疫治疗取得了明显和持久的疗效,目前晚期NSCLC患者的5年生存率已经从5%提高到了20%[4]。尽管如此,晚期NSCLC患者的整体预后仍然较差,需要深入探索提高患者预后的治疗方法。
临床实践中NSCLC诊断的起始年龄通常在70岁左右[5]。由于多数临床试验设定了严格的年龄筛选标准(通常为<75岁),75岁及以上的患者参与临床研究的比例<10%[6]。因此,老年晚期NSCLC患者的治疗可以参考的临床研究结果非常有限。而老年患者被大部分临床研究排除的原因可能在于以下几点:较大的年龄、较差的东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体质状态评分、认知能力障碍、伴随了较多的合并疾病和不能接受毒副作用较大的治疗方案等[7]。以上因素成为限制老年患者参加临床研究的客观原因。PD-1抑制剂单药或联合化疗目前已经成为晚期NSCLC患者一线或二线的标准治疗方案[8]。晚期NSCLC患者应用PD-1抑制剂单药治疗的中位无进展生存期(progression free survival,PFS)为3~6个月,中位总生存期(overall survival,OS)为10~15个月[9]。以上研究纳入的大部分是年轻患者。在KEYNOTE-010研究中,接受帕博利珠单抗治疗的690例晚期NSCLC患者的中位年龄为63岁[10]。在CheckMate-057研究中,接受纳武利尤单抗治疗的292例非鳞状NSCLC患者的中位年龄为61岁,在CheckMate-017研究中,接受纳武利尤单抗治疗的135例鳞状NSCLC患者的中位年龄为62岁[11,12]。目前在晚期NSCLC患者中PD-1抑制剂单药治疗的研究主要集中在年龄相对较小的患者中,对于65岁以上的老年晚期NSCLC患者PD-1抑制剂的疗效及安全性数据尚且缺乏。
此外,目前PD-1抑制剂单药在临床实践中主要的困境在于有效率偏低,尤其是在细胞程序性死亡-配体1(PD-L1)的联合阳性分数(CPS)表达<50%的患者中客观缓解率(objective response rate,ORR)<20%[13]。有必要探讨基线临床资料和药物的疗效及患者预后之间的关联性,从而进一步筛选PD-1抑制剂的潜在获益人群。
因此,本研究旨在探讨真实世界中PD-1抑制剂单药在老年晚期NSCLC患者中的疗效及安全性。
选择2018年10月至2021年11月在甘肃中医药大学第四附属医院胸外科和肿瘤科接受PD-1抑制剂单药治疗的晚期NSCLC患者为研究对象。纳入标准:(1)年龄≥65岁;(2)病理学检查确诊为NSCLC且病理分期为Ⅲb或Ⅳ期;(3)ECOG体质状态评分为0~2分;(4)患者既往接受系统治疗后接受了PD-1抑制剂单药治疗;(5)根据实体瘤免疫治疗疗效评价标准(irRESIST)[14],至少有1个可测量的靶病灶。排除标准:(1)有自身免疫性疾病史或正在接受类固醇或者其他免疫抑制药物治疗;(2)伴随了另一种肿瘤疾病或合并可能影响患者生命的严重疾病;(3)一般信息及诊疗信息大量缺失,无疗效评估数据。
最终纳入63例老年晚期NSCLC患者。本研究得到甘肃中医药大学第四附属医院伦理委员会批准(伦理批号:KY-2021036),入组患者均签署了知情同意书。
本研究采用在中国获批上市的PD-1抑制剂,包括了卡瑞利珠单抗(江苏恒瑞医药股份有限公司),信迪利单抗〔信达生物制药(苏州)有限公司〕和帕博利珠单抗〔默沙东(中国)有限公司〕。3种药物均采用200 mg静脉滴注,第1天静脉滴注持续时间0.5 h以上,每3周为1个治疗周期,直至患者出现疾病进展或无法耐受的毒副作用。
患者在接受PD-1抑制剂治疗过程中最佳的疗效根据irRECIST确定。接受治疗前以及治疗后每两个周期用CT或MRI对患者接受治疗的靶病灶进行疗效评估,部分患者也可以跟进实际情况按需进行疗效评估。任一条毒副作用通过不良事件的通用术语标准(CTCAE)5.0版[15]进行毒副作用的评价,记录每例患者治疗过程中出现的最大级别的毒副作用。
每个月通过电话沟通的方式对纳入的患者进行随访,记录患者接受PD-1抑制剂单药治疗后的后续药物治疗情况,重点随访患者的生存状态,记录患者出现死亡事件的具体日期。本研究最后一次随访时间为2022-03-15。
本研究评价指标包括患者的基线临床资料〔包括性别、年龄、ECOG体质状态评分、病理学分期、吸烟史(吸烟史定义为患者目前正在吸烟或过去曾吸烟)、组织学类型、PD-1抑制剂治疗线数、转移病灶数目、靶向药物治疗史、PD-1抑制剂类型〕、ORR、疾病控制率(disease control rate,DCR)、PFS、OS和毒副作用。ORR和DCR根据每个患者治疗过程中最佳的疗效反应进行评估。
ORR定义为:最佳疗效为完全缓解(CR)与部分缓解(PR)患者在老年晚期NSCLC患者中的比例。DCR定义为:最佳疗效为CR与PR患者在疾病稳定患者中的比例。PFS定义为:患者开始接受PD-1抑制剂单药治疗的日期到患者出现疾病进展或者死亡的日期。OS定义为:患者开始接受PD-1抑制剂单药治疗的日期到因任何原因导致死亡的日期。
采用SPSS 25.0软件对数据进行统计分析。不符合正态分布的计量资料以M(P25,P75)表示;计数资料以相对数表示。采用Stata 14.0软件绘制患者的PFS和OS的Kaplan-Meier曲线,生存曲线的比较采用Log-rank检验。老年晚期NSCLC患者接受PD-1抑制剂单药治疗后PFS的影响因素分析采用单因素、多因素Cox比例风险回归分析,将单因素Cox比例风险回归分析结果中P<0.1的因素纳入多因素Cox比例风险回归分析中。研究最后一次随访日期时尚未出现疾病进展或死亡的,则按照删失数据进行处理。安全性分析中采用频数资料展示毒副作用的发生率。以P<0.05为差异有统计学意义。
最终纳入63例患者,其中男41例(65.1%)、女22例(34.9%),中位年龄71.0(65.0,89.0)岁,ECOG体质状态评分0~1分34例(54.0%)、2分29例(46.0%),病理学分期Ⅲb期7例(11.1%)、Ⅳ期56例(88.9%),有吸烟史37例(58.7%),组织学类型腺癌34例(54.0%)、鳞癌29例(46.0%),PD-1抑制剂治疗线数二线11例(17.5%)、三线及以上52例(82.5%),转移病灶数目≤3个41例(65.1%)、>3个22例(34.9%),有靶向药物治疗史30例(47.6%),PD-1抑制剂卡瑞利珠单抗25例(39.7%)、信迪利单抗23例(36.5%)、帕博利珠单抗15例(23.8%)。
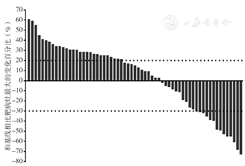
63例患者中无CR者,14例患者表现为PR,21例患者疾病稳定,28例患者疾病进展。ORR为22.2%(14/63),DCR为66.7%(14/21)。63例患者接受治疗后靶病灶的变化情况见图1。

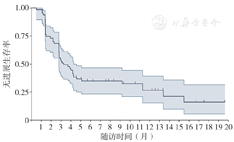
63例患者的中位随访持续时间为10.5(5.0,26.0)个月。在随访日期截止时共有46例患者出现了疾病进展或死亡事件,PFS的成熟度为73.0%。患者的中位PFS为3.3(2.0,4.6)个月,6个月和12个月的PFS率分别为34.7%和26.5%。有9例患者PFS超过12个月,PFS生存期曲线见图2。

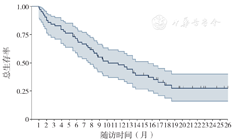
在随访日期截止时共有42例患者出现了死亡事件,OS的成熟度为66.7%,中位OS率为10.2(6.1,14.3)个月,12个月和24个月的OS分别为48.0%和27.4%。有8例患者OS超过20个月,OS生存曲线见图3。

以患者PFS为因变量(赋值:实测值),以患者年龄(赋值:0=≥71岁,1=<71岁)、性别(赋值:0=女性,1=男性)、ECOG体质状态评分(赋值:0=2分,1=0~1分)、病理学分期(赋值:0=Ⅳ期,1=Ⅲb期)、吸烟史(赋值:0=无,1=有)、组织学类型(赋值:0=鳞癌,1=腺癌)、PD-1抑制剂治疗线数(赋值:0=三线及以上,1=二线)、转移病灶数目(赋值:0=>3,1=≤3)、靶向药物治疗史(赋值:0=无,1=有)为自变量进行单因素Cox比例风险回归分析,结果表明ECOG体质状态评分和转移病灶数目是老年晚期NSCLC患者接受PD-1抑制剂后PFS的影响因素(P<0.05),见表1。以ECOG体质状态评分和转移灶数目为自变量,以老年晚期NSCLC患者接受PD-1抑制剂后PFS为因变量纳入多因素Cox比例风险回归模型进行校正,结果表明,ECOG体质状态评分和转移病灶数目是老年晚期NSCLC患者接受PD-1抑制剂治疗后PFS的影响因素(P<0.05),见表2。
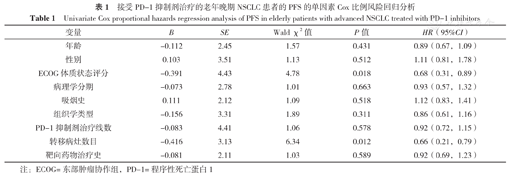
接受PD-1抑制剂治疗的老年晚期NSCLC患者的PFS的单因素Cox比例风险回归分析
Univariate Cox proportional hazards regression analysis of PFS in elderly patients with advanced NSCLC treated with PD-1 inhibitors
接受PD-1抑制剂治疗的老年晚期NSCLC患者的PFS的单因素Cox比例风险回归分析
Univariate Cox proportional hazards regression analysis of PFS in elderly patients with advanced NSCLC treated with PD-1 inhibitors
| 变量 | B | SE | Wald χ2值 | P值 | HR(95%CI) |
|---|---|---|---|---|---|
| 年龄 | -0.112 | 2.45 | 1.57 | 0.431 | 0.89(0.67,1.09) |
| 性别 | 0.103 | 3.51 | 1.13 | 0.512 | 1.11(0.81,1.78) |
| ECOG体质状态评分 | -0.391 | 4.43 | 4.78 | 0.018 | 0.68(0.31,0.89) |
| 病理学分期 | -0.073 | 2.78 | 1.01 | 0.663 | 0.93(0.57,1.32) |
| 吸烟史 | 0.111 | 2.12 | 1.09 | 0.518 | 1.12(0.83,1.41) |
| 组织学类型 | -0.156 | 3.31 | 1.89 | 0.311 | 0.86(0.61,1.16) |
| PD-1抑制剂治疗线数 | -0.083 | 4.41 | 1.06 | 0.578 | 0.92(0.72,1.15) |
| 转移病灶数目 | -0.416 | 3.13 | 6.34 | 0.012 | 0.66(0.21,0.79) |
| 靶向药物治疗史 | -0.081 | 2.11 | 1.03 | 0.589 | 0.92(0.69,1.23) |
注:ECOG=东部肿瘤协作组,PD-1=程序性死亡蛋白1
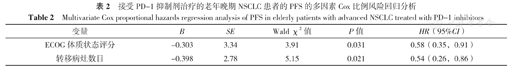
接受PD-1抑制剂治疗的老年晚期NSCLC患者的PFS的多因素Cox比例风险回归分析
Multivariate Cox proportional hazards regression analysis of PFS in elderly patients with advanced NSCLC treated with PD-1 inhibitors
接受PD-1抑制剂治疗的老年晚期NSCLC患者的PFS的多因素Cox比例风险回归分析
Multivariate Cox proportional hazards regression analysis of PFS in elderly patients with advanced NSCLC treated with PD-1 inhibitors
| 变量 | B | SE | Wald χ2值 | P值 | HR(95%CI) |
|---|---|---|---|---|---|
| ECOG体质状态评分 | -0.303 | 3.34 | 3.91 | 0.031 | 0.58(0.35,0.91) |
| 转移病灶数目 | -0.398 | 2.78 | 5.15 | 0.021 | 0.54(0.26,0.86) |
在接受PD-1抑制剂单药治疗过程中,一共73.0%(46/63)的患者出现不同级别的毒副作用,3级以上毒副作用发生率为14.3%(9/63)。其中有1例患者由于免疫相关性肺癌出现死亡。
常见的毒副作用类型包括乏力(23.8%,15/63)、腹泻(19.1%,12/63)、皮疹(15.9%,10/63)、肝功能异常(14.3%,9/63)、恶心呕吐(14.3%,9/63)、反应性皮肤毛细血管内皮增生(7.9%,5/63)、肺炎(7.9%,5/63)、发热(6.3%,4/63)和口腔炎(3.2%,2/63)。3级以上的毒副作用有肝功能异常(6.3%,4/63)、腹泻(4.8%,3/63)、乏力(3.2%,2/63)、恶心呕吐(1.6%,1/63)和肺炎(1.6%,1/63)。总体毒副作用安全可控。
本研究不仅提供了真实世界中老年晚期NSCLC患者接受PD-1抑制剂单药治疗的疗效和安全性数据,而且对接受PD-1抑制剂单药治疗的患者PFS影响因素进行了分析,结果提示ECOG体质状态评分和转移病灶数目是PD-1抑制剂单药治疗PFS的影响因素。研究结果为老年晚期NSCLC患者在临床实践中的药物选择提供了参考数据。
近年来中国肺癌的发病率一直处于上升趋势,目前每年新发病例已经达到81.5万例,其中老年肺癌患者同样逐年增多[2]。然而年龄增大伴随的体脂率下降、肝肾功能衰退等身体状态的变化也会影响免疫治疗药物的吸收、代谢和排泄过程。大部分临床研究都把老年患者排除在研究之外,目前老年晚期NSCLC患者中可参考的临床数据较少[7]。老年晚期NSCLC患者在临床实践中迫切需要有效且安全的治疗方案从而进一步延长患者生存期。
本研究纳入的63例患者中接受二线PD-1抑制剂治疗的患者有11例,其余52例患者接受三线及以上PD-1抑制剂的治疗,考虑到目前PD-1抑制剂已经获批作为二线单药使用,因此,研究中PD-1抑制剂的应用是符合伦理规范的。63例接受PD-1抑制剂单药治疗的老年晚期NSCLC患者的ORR和DCR分别为22.2%和55.6%,中位PFS为3.3个月。本研究结果显示的ORR、DCR、PFS与纳武利尤单抗二线治疗鳞癌和非鳞癌晚期NSCLC的CheckMate-017和CheckMate-057研究结果基本一致[11,16]。而在KEYNOTE-010研究中,帕博利珠单抗二线治疗晚期NSCLC的ORR为18%,本研究的结果与之基本一致;中位PFS为3.9个月[10],略优于本研究的中位PFS。分析原因,一方面在于两个研究中患者年龄上的差异,KEYNOTE-010和本研究中患者的中位年龄分别为63岁和71岁,部分研究结果提示年龄较大一定程度上会伴随较差的预后[17]。另一方面KEYNOTE-010研究中纳入的基本上全是ECOG体质状态评分为0~1分的患者,而本研究中有46% ECOG体质状态评分为2分的患者。既往的研究中已经证实了ECOG体质状态评分是晚期NSCLC患者PFS和OS的影响因素[18]。而且本研究的多因素Cox比例风险回归分析结果也提示了ECOG体质状态评分为2分的患者预后显著较差。还有可能本研究为回顾性研究,和设计严谨的Ⅲ期研究相比,回顾性研究中患者管理和患者依从性均较差,进而也会一定程度上影响患者的预后,这在既往的回顾性研究中也得到了证实[19]。此外GALLI等[20]在意大利老年晚期NSCLC患者中开展了免疫治疗的回顾性研究,纳入了180例<70岁和110例≥70岁的晚期NSCLC患者,结果表明70岁以上的NSCLC患者接受免疫治疗后ORR约为20%,中位PFS为3.5个月,中位OS为11.3个月,本研究结果与之基本一致。此外,邵佳康等[21]开展了年龄校正查尔森合并症指数对老年晚期NSCLC患者接受抗PD1免疫治疗的预后影响的回顾性研究,纳入了118例≥70岁的接受PD-1抑制剂治疗的老年晚期NSCLC患者,结果表明ORR为22.9%,DCR为76.3%,本研究结果与之一致。而该研究的中位PFS为6.1和10.6个月,中位OS为11.7和33.9个月,显著优于本研究结果,可能是该研究中ECOG体质状态评分2分的患者相对较少,或纳入患者的异质性造成的。总之,以上的研究结果提示老年晚期NSCLC患者可能从PD-1抑制剂的治疗中获益。
此外,本研究中的Cox比例风险回归分析结果提示ECOG体质状态评分和转移病灶数目是影响老年晚期NSCLC患者PD-1抑制剂治疗后PFS的独立风险因素,与既往研究结果基本一致[22]。然而,ECOG体质状态评分和转移病灶数目能否成为预测老年晚期NSCLC患者PD-1抑制剂治疗后PFS的生物标志物尚需要大样本研究结果进一步验证。
此外,本研究也对老年晚期NSCLC患者接受PD-1抑制剂治疗的安全性做了分析,结果表明不同级别的毒副作用发生率为73.0%,3级以上毒副作用发生率为14.3%,总体不良事件安全可控。这与既往研究中晚期NSCLC患者应用PD-1抑制剂单药治疗的安全性事件基本一致[23]。不过需要注意的是,本研究中发现接受PD-1抑制剂治疗的老年晚期NSCLC患者中有9例肝功能出现异常,其中4例表现为3级以上的天冬氨酸氨基转移酶/丙氨酸氨基转移酶(AST/ALT)升高,高于KEYNOTE-010研究中肝功能异常的发生率[10],可能是由于老年患者通常基础疾病较多,肝肾功能相对较差,从而在接受PD-1抑制剂治疗时会出现较多的肝功能异常。老年患者接受PD-1抑制剂单药治疗时安全性基本可控,但尚需要前瞻性临床研究进一步验证。
本研究存在一定的局限性。首先,本研究为回顾性分析,纳入的老年晚期NSCLC患者相对较少,研究结果尚需要在大样本研究中进行验证。回顾性分析中PFS及OS数据的成熟度相对较低,患者管理也相对较差,造成了一定偏倚。其次,研究并未对患者的PD-L1表达进行检测,分析PD-L1表达和PD-1抑制剂疗效的关联。
综上所述,本研究初步探讨了老年晚期NSCLC患者接受PD-1抑制剂治疗的疗效和安全性。研究结果为老年晚期NSCLC患者在临床上使用PD-1抑制剂提供了可以参考的研究数据。
本文无利益冲突。































