
支气管肺发育不良(BPD)是早产儿最常见的严重肺部疾病,是多种因素对未成熟肺的损伤,识别BPD的危险因素对制定预防策略至关重要。目前BPD的危险因素尚存争议,且国内外鲜有系统评价。
系统分析早产儿BPD的危险因素。
计算机检索中国知网(CNKI)、万方数据知识服务平台(Wanfang Data)、中国生物医学文献数据库(CBM)、维普网(VIP)、PubMed、EmBase、Web of Science和Cochrane Library中有关早产儿BPD危险因素的文献,检索时限为建库至2021年10月。采用RevMan 5.3软件进行Meta分析。
共纳入23篇文献,BPD早产儿累计33 508例,各文献纽尔卡斯-渥太华量表(NOS)评分总体质量较高。Meta分析结果显示,母亲合并绒毛膜羊膜炎〔比值比(OR)=1.46,95%CI(1.18,1.80),P=0.000 6〕、母亲合并妊娠期高血压〔OR=1.26,95%CI(1.15,1.37),P<0.000 01〕、母亲合并胎膜早破〔OR=1.18,95%CI(1.10,1.26),P<0.000 01〕、早产儿小于胎龄儿(SGA)〔OR=2.64,95%CI(1.85,3.77),P<0.000 01〕、早产儿产房气管插管〔OR=2.50,95%CI(1.39,4.50),P=0.002〕、早产儿5 min Apgar评分<7分〔OR=2.47,95%CI(1.36,4.47),P=0.003〕、男性早产儿〔OR=1.49,95%CI(1.43,1.55),P<0.000 01〕、早产儿机械通气〔OR=1.59,95%CI(1.28,1.96),P<0.000 1〕、早产儿机械通气>7 d〔OR=7.99,95%CI(4.47,14.29),P<0.000 01〕、早产儿使用肺表面活性物质〔OR=3.46,95%CI(1.96,6.11),P<0.000 1〕、早产儿使用类固醇〔OR=2.42,95%CI(1.93,3.03),P<0.000 01〕、早产儿呼吸窘迫综合征(RDS)〔OR=3.40,95%CI(2.01,5.75),P<0.000 01〕、早产儿动脉导管未闭(PDA)〔OR=1.96,95%CI(1.38,2.79),P=0.000 2〕、早产儿败血症〔OR=1.82,95%CI(1.36,2.44),P<0.000 1〕、早产儿坏死性小肠结肠炎(NEC)〔OR=1.62,95%CI(1.18,2.22),P=0.003〕是早产儿发生BPD的危险因素。早产儿出生体质量高〔OR=0.79,95%CI(0.76,0.83),P<0.000 01〕、早产儿胎龄高〔OR=0.80,95%CI(0.73,0.87),P<0.000 01〕是早产儿发生BPD的保护因素。漏斗图结合Begg's检验和Egger's检验显示无发表偏倚(P>0.05)。
当前证据表明,母亲合并绒毛膜羊膜炎、妊娠期高血压、胎膜早破及早产儿SGA、产房气管插管、5 min Apgar评分<7分、男性、机械通气、机械通气>7 d、使用肺表面活性物质、使用类固醇、RDS、PDA、败血症、NEC是早产儿BPD发生的危险因素,高出生体质量、高胎龄是早产儿发生BPD的保护因素,医护人员应及时识别并处理相关危险因素,预防早产儿BPD的发生。

本刊2023年版权归中国全科医学杂志社所有
未经编辑部许可,不得任意转载和摘编
本刊所发表作品仅为作者观点,并不代表编委会和编辑部意见
如有印装质量问题请向本刊发行部调换
据世界卫生组织(WHO)统计,全球每年约有1 500万婴儿早产,早产并发症是导致5岁以下儿童死亡的最主要原因[1]。支气管肺发育不良(bronchopulmonary dysplasia,BPD)是早产儿最常见的并发症[2],其发生是多种危险因素综合作用的结果。当代围生医学及新生儿护理技术的快速发展明显改善了早产儿特别是极早产儿和超早产儿的出生率及存活率,BPD的发病率在全球范围内也随之逐年上升[3]。据报道,全球每年极早产儿BPD的发生率在10%~89%[4]。BPD不仅会增加早产儿的呼吸系统疾病发病率、药物使用率以及再入院率,而且会导致神经发育障碍等,严重影响其出生后数年的生活质量同时增加家庭经济和心理负担[5]。目前对于BPD尚缺乏特效的治疗手段[6],因此,探究BPD的危险因素,从根本上降低BPD的发生至关重要。此前关于BPD危险因素的单中心研究较多,但考虑到多中心研究的病例范围更广,样本更具代表性,研究结论的外推性更强,故而本研究通过收集国内外公开发表的关于早产儿BPD危险因素的多中心研究进行Meta分析,以期为临床预防和管理早产儿BPD提供参考依据。
检索英文数据库Cochrane Library、PubMed、EmBase、Web of Science及中文数据库中国知网(CNKI)、万方数据知识服务平台(Wanfang Data)、中国生物医学文献数据库(CBM)、维普网(VIP)中关于BPD危险因素的文献,检索时间为建库至2021年10月。检索方式为主题词与自由词结合检索。中文检索词为:"早产儿/未成熟儿/低出生体重儿/低出生体质量儿""支气管肺发育不良/支气管肺发育异常/围产期支气管肺的发育不良/新生儿慢性肺疾病""危险因素/高危因素/影响因素/相关因素/预测因素";英文检索词为:"Infant,preterm OR preterm OR Preterm Infants OR Infant,Low Birth Weight OR low birth weight infants"AND"bronchopulmonary dysplasia OR BPD OR chronic lung disease"AND"risk factor OR dangerous factors OR influencing OR relevant factors OR predictive factor"。并对纳入文献的参考文献进行二次检索,查找符合标准的相关研究。
(1)研究对象:胎龄≤32周和/或出生体质量≤1 500 g的早产儿;(2)研究类型:多中心观察性研究,包括病例对照研究和队列研究;(3)观察指标:早产儿发生BPD的危险因素;(4)病例组为BPD早产儿,对照组为非BPD早产儿。
(1)重复发表文献;(2)文献数据获取不全或经向原作者联系仍无法获取原文的研究;(3)非中、英文文献。
由2名研究者独立筛选文献、提取资料并交叉核对。如有异议,则通过讨论或与第3名研究者协商决定。文献筛选时首先阅读标题和摘要,以排除明显不相关的文献,再进一步阅读全文以确定是否最终纳入。对于未报告但对本研究非常重要的信息,尽量联系原始研究作者予以补充。对于符合标准的文献资料提取以下主要内容:(1)纳入研究的基本信息,包括第一作者、发表时间、国家/地区、中心数量;(2)研究对象的基线特征,包括研究类型、样本量、诊断标准及影响因素。
由2名研究者独立采用观察性研究质量评价工具纽卡斯尔-渥太华量表[7](the Newcastle-Ottawa Scale,NOS)对纳入文献质量进行评价并交叉核对结果,如遇分歧,则与第3名研究者协商解决。该量表包括人群的选择(0~4分)、组间可比性(0~2分)、结局的测量(0~3分)3个条目,共8项内容,满分9分,7分及以上为高质量研究。
应用RevMan 5.3软件进行Meta分析。采用比值比(odds ratio,OR)作为效应分析统计量,并提供其95%CI。纳入研究之间的异质性采用I2表示,若P>0.1且I2<50%,提示研究间异质性较小,采用固定效应模型进行Meta分析;反之,采用随机效应模型进行Meta分析,同时进行敏感性分析检验结果的稳定性。采用Stata 15.1软件绘制漏斗图,并结合Begg's检验和Egger's检验对纳入文献数量≥10篇的Meta分析结果进行发表偏倚检验。以P<0.05为差异有统计学意义。
共检索到9 948篇文献,剔除重复文献3 501篇。按照纳入和排除标准阅读标题和摘要后去除6 329篇文献,初筛剩余文献阅读全文后最终纳入23篇文献[8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30],文献筛选流程及结果见图1。


注:Wanfang Data=万方数据知识服务平台,WVIP=维普网,CBM=中国生物医学文献数据库,CNKI=中国知网
本研究纳入的23篇文献均为多中心研究,包括队列研究21项[8,9,10,11,12,13,14,15,16,18,19,20,21,22,23,24,25,27,28,29,30],病例对照研究2项[17,26]。这些研究发表于1998—2021年,共筛查了106 557例早产儿,BPD病例累计33 508例。研究人群分别来自美洲(美国、阿根廷、智利、巴拉圭、秘鲁、乌拉圭、哥伦比亚、智利)、欧洲(英国、德国、波兰、荷兰、法国、丹麦、比利时、瑞士、挪威、意大利、葡萄牙等)、亚洲(中国、韩国、以色列、日本)和大洋洲(澳大利亚、新西兰),其中美洲共筛查了40 571例早产儿,BPD病例累计13 406例;欧洲共筛查了7 894例早产儿,BPD病例累计1 535例;亚洲共筛查了46 639例早产儿,BPD病例累计15 857例;大洋洲共筛查了11 453例早产儿,BPD病例累计2 710例。23篇文献的NOS评分均≥7分,表明纳入文献总体质量较高。纳入文献[8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30]的基本特征及质量评价结果见表1[31,32,33]。
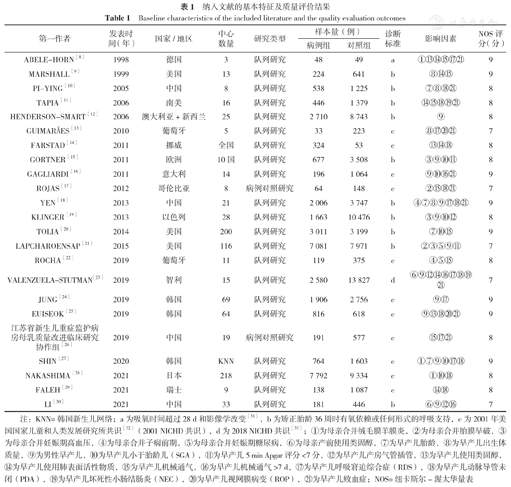
纳入文献的基本特征及质量评价结果
Baseline characteristics of the included literature and the quality evaluation outcomes
纳入文献的基本特征及质量评价结果
Baseline characteristics of the included literature and the quality evaluation outcomes
| 第一作者 | 发表时间(年) | 国家/地区 | 中心数量 | 研究类型 | 样本量(例) | 诊断标准 | 影响因素 | NOS评分(分) | |
|---|---|---|---|---|---|---|---|---|---|
| 病例组 | 对照组 | ||||||||
| ABELE-HORN[8] | 1998 | 德国 | 3 | 队列研究 | 48 | 49 | a | ①⑬⑭⑮⑰(21) | 9 |
| MARSHALL[9] | 1999 | 美国 | 13 | 队列研究 | 224 | 641 | b | ⑧⑭⑮ | 9 |
| PI-YING[10] | 2005 | 中国 | 8 | 队列研究 | 538 | 1 225 | b | ⑦⑧⑱(21) | 8 |
| TAPIA[11] | 2006 | 南美 | 16 | 队列研究 | 446 | 1 379 | b | ⑭⑮⑱⑲(21) | 8 |
| HENDERSON-SMART[12] | 2006 | 澳大利亚+新西兰 | 25 | 队列研究 | 2 710 | 8 743 | b | ⑨ | 8 |
| GUIMARÃES[13] | 2010 | 葡萄牙 | 5 | 队列研究 | 33 | 223 | c | ⑧⑰⑳(21) | 7 |
| FARSTAD[14] | 2011 | 挪威 | 全国 | 队列研究 | 324 | 53 | c | ⑬⑭⑱ | 8 |
| GORTNER[15] | 2011 | 欧洲 | 10国 | 队列研究 | 677 | 3 508 | b | ③⑨⑩⑪ | 8 |
| GAGLIARDI[16] | 2011 | 意大利 | 14 | 队列研究 | 196 | 1 064 | c | ⑨⑩⑯(21) | 9 |
| ROJAS[17] | 2012 | 哥伦比亚 | 8 | 病例对照研究 | 64 | 148 | c | ②⑮⑱(21) | 7 |
| YEN[18] | 2013 | 中国 | 21 | 队列研究 | 2 006 | 3 747 | b | ④⑦⑧⑨⑰⑱(21) | 9 |
| KLINGER[19] | 2013 | 以色列 | 28 | 队列研究 | 1 663 | 10 476 | b | ③⑨⑩⑫ | 8 |
| TOLIA[20] | 2014 | 美国 | 200 | 队列研究 | 3 011 | 3 199 | b | ⑦⑩⑮ | 9 |
| LAPCHAROENSAP[21] | 2015 | 美国 | 116 | 队列研究 | 7 081 | 7 971 | b | ②③⑤⑨⑪ | 7 |
| ROCHA[22] | 2019 | 葡萄牙 | 11 | 队列研究 | 119 | 375 | c | ④⑤⑮ | 8 |
| VALENZUELA-STUTMAN[23] | 2019 | 智利 | 15 | 队列研究 | 2 580 | 13 827 | d | ⑥⑨⑫⑭⑯⑰⑱⑲(21) | 7 |
| JUNG[24] | 2019 | 韩国 | 69 | 队列研究 | 1 906 | 2 756 | c | ⑨⑰ | 9 |
| EUISEOK[25] | 2019 | 韩国 | 64 | 队列研究 | 816 | 618 | c | ⑨⑬⑱⑳(21) | 9 |
| 江苏省新生儿重症监护病房母乳质量改进临床研究协作组[26] | 2019 | 中国 | 19 | 病例对照研究 | 191 | 577 | c | ⑮⑰(21) | 8 |
| SHIN[27] | 2020 | 韩国 | KNN | 队列研究 | 764 | 1 603 | c | ①⑦⑨⑩⑰⑱ | 9 |
| NAKASHIMA[28] | 2021 | 日本 | 218 | 队列研究 | 7 792 | 9 334 | c | ①⑩⑱ | 8 |
| FALEH[29] | 2021 | 瑞士 | 9 | 队列研究 | 138 | 1 087 | c | ⑭⑱ | 8 |
| LI[30] | 2021 | 中国 | 33 | 队列研究 | 181 | 446 | b | ⑥⑨⑫⑯ | 7 |
注:KNN=韩国新生儿网络;a为吸氧时间超过28 d和影像学改变[31],b为矫正胎龄36周时有氧依赖或任何形式的呼吸支持,c为2001年美国国家儿童和人类发展研究所共识[32](2001 NICHD共识),d为2018 NICHD共识[33];①为母亲合并绒毛膜羊膜炎,②为母亲合并胎膜早破,③为母亲合并妊娠期高血压,④为母亲合并子痫前期,⑤为母亲合并妊娠期糖尿病,⑥为母亲产前使用类固醇,⑦为早产儿胎龄,⑧为早产儿出生体质量,⑨为男性早产儿,⑩为早产儿小于胎龄儿(SGA),⑪为早产儿5 min Apgar评分<7分,⑫为早产儿产房气管插管,⑬为早产儿使用类固醇,⑭为早产儿使用肺表面活性物质,⑮为早产儿机械通气,⑯为早产儿机械通气>7 d,⑰为早产儿呼吸窘迫综合症(RDS),⑱为早产儿动脉导管未闭(PDA),⑲为早产儿坏死性小肠结肠炎(NEC),⑳为早产儿视网膜病变(ROP),(21)为早产儿败血症;NOS=纽卡斯尔-渥太华量表
3篇文献[8,27,28]对母亲合并绒毛膜羊膜炎进行了分析,共纳入8 604例BPD早产儿。各文献间有统计学异质性(I2=53%,P=0.12),采用随机效应模型进行Meta分析,结果显示,母亲合并绒毛膜羊膜炎是早产儿发生BPD的危险因素,差异有统计学意义〔OR=1.46,95%CI(1.18,1.80),P=0.000 6〕,见图2。


3篇文献[15,19,21]、2篇文献[17,21]分别对母亲合并妊娠期高血压、胎膜早破进行了分析,分别纳入9 421例、7 145例BPD早产儿。各文献间无统计学异质性(I2=0,P=0.41;I2=0,P=0.91),采用固定效应模型进行Meta分析,结果显示,母亲合并妊娠期高血压、胎膜早破是早产儿发生BPD的危险因素,差异均有统计学意义〔OR=1.26,95%CI(1.15,1.37),P<0.000 01;OR=1.18,95%CI(1.10,1.26),P<0.000 01〕,见图3,图4。




2篇文献[23,30]、2篇文献[18,22]、2篇文献[21,22]分别对母亲产前使用类固醇、合并子痫前期、合并妊娠期糖尿病进行了分析,分别纳入2 761例、2 125例、7 200例BPD早产儿。各文献间有统计学异质性(I2=99%,P<0.000 01;I2=90%,P=0.002;I2=83%,P=0.01),均采用随机效应模型进行Meta分析,结果显示,母亲产前使用类固醇、合并子痫前期、合并妊娠期糖尿病不是早产儿发生BPD的危险因素,差异均无统计学意义〔OR=2.38,95%CI(0.15,37.76),P=0.54;OR=1.74,95%CI(0.31,9.82),P=0.53;OR=1.50,95%CI(0.35,6.44),P=0.58〕,见图5,图6,图7。






4篇文献[9,10,13,18]对早产儿出生体质量进行了分析,共纳入2 801例BPD早产儿。各文献间无统计学异质性(I2=0,P=0.59),采用固定效应模型进行Meta分析,结果显示,早产儿出生体质量高是早产儿发生BPD的保护因素〔OR=0.79,95%CI(0.76,0.83),P<0.000 01〕,见图8。
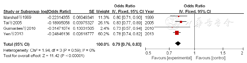

4篇文献[10,18,20,27]对早产儿胎龄进行了分析,共纳入6 319例BPD早产儿。各文献间存在统计学异质性(I2=91%,P<0.000 01),采用随机效应模型进行Meta分析,结果显示,早产儿胎龄高是早产儿发生BPD的保护因素〔OR=0.80,95%CI(0.73,0.87),P<0.000 01〕,见图9。


6篇文献[15,16,19,20,27,28],3篇文献[19,23,30],2篇文献[15,21]分别对早产儿小于胎龄儿(small for gestational age,SGA)、产房气管插管、5 min Apgar评分<7分进行了分析,分别纳入14 103例、4 424例、7 758例BPD早产儿。各文献间有统计学异质性(I2=97%,P<0.000 01;I2=98%,P<0.000 01;I2=95%,P<0.000 01),均采用随机效应模型进行Meta分析,结果显示,早产儿SGA、产房气管插管、5 min Apgar评分<7分是早产儿发生BPD的危险因素,差异均有统计学意义〔OR=2.64,95%CI(1.85,3.77),P<0.000 01;OR=2.50,95%CI(1.39,4.50),P=0.002;OR=2.47,95%CI(1.36,4.47),P=0.003〕,见图10,图11,图12。
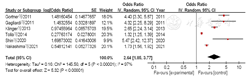




11篇文献[12,15,16,18,19,21,23,24,25,27,30]对男性早产儿进行了分析,共纳入了20 580例BPD早产儿。各文献间无统计学异质性(I2=0,P=0.93),采用固定效应模型进行Meta分析,结果显示,男性是早产儿发生BPD的危险因素,差异有统计学意义〔OR=1.49,95%CI(1.43,1.55),P<0.000 01〕,见图13。
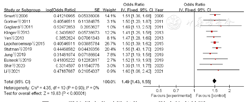

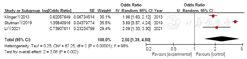
7篇文献[8,9,11,17,20,22,26]、3篇文献[16,23,30]分别对早产儿机械通气、机械通气>7 d进行了分析,分别纳入4 103例、2 957例BPD早产儿。各文献间有统计学异质性(I2=95%,P<0.000 1;I2=83%,P=0.003),均采用随机效应模型进行Meta分析,结果显示,早产儿机械通气、机械通气>7 d是早产儿发生BPD的危险因素,差异有统计学意义〔OR=1.59,95%CI(1.28,1.96),P<0.000 1;OR=7.99,95%CI(4.47,14.29),P<0.000 01〕,见图14,图15。




6篇文献[8,9,11,14,23,29]对早产儿使用肺表面活性物质进行了分析,共纳入3 760例BPD早产儿。6篇文献间有统计学异质性(I2=94%,P<0.000 01),采用随机效应模型进行Meta分析,结果显示,早产儿使用肺表面活性物质是早产儿发生BPD的危险因素,差异有统计学意义〔OR=3.46,95%CI(1.96,6.11),P<0.000 1〕,见图16。


3篇文献[8,14,25]对早产儿使用类固醇进行了分析,共纳入1 188例BPD早产儿。3篇文献间无统计学异质性(I2=16%,P=0.30),采用固定效应模型进行Meta分析,结果显示,早产儿使用类固醇是早产儿发生BPD的危险因素,差异有统计学意义〔OR=2.42,95%CI(1.93,3.03),P<0.000 01〕,见图17。


7篇文献[8,13,18,23,24,26,27]、10篇文献[10,11,14,17,18,23,27,28,29]、10篇文献[8,10,11,13,16,17,18,23,25,26]、2篇文献[11,23]分别对早产儿呼吸窘迫综合征(respiratory distress syndrome,RDS)、动脉导管未闭(patent ductus arteriosus,PDA)、败血症、坏死性小肠结肠炎(necrotizing enterocolitis,NEC)进行了分析,分别纳入7 528例、14 652例、6 918例、3 026例BPD早产儿。各文献间有统计学异质性(I2=94%,P<0.000 01;I2=98%,P<0.000 01;I2=94%,P<0.000 01;I2=85%,P=0.010),均采用随机效应模型进行Meta分析,结果显示,早产儿合并RDS、PDA、败血症、NEC是早产儿发生BPD的危险因素,差异均有统计学意义〔OR=3.40,95%CI(2.01,5.75),P<0.000 01;OR=1.96,95%CI(1.38,2.79),P=0.000 2;OR=1.82,95%CI(1.36,2.44),P<0.000 1;OR=1.62,95%CI(1.18,2.22),P=0.003〕,见图18,图19,图20,图21。
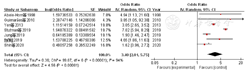



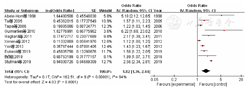



2篇文献[13,25]对早产儿视网膜病变(retinopathy of prematurity,ROP)进行了分析,共纳入849例BPD早产儿。2篇文献间有统计学异质性(I2=53%,P=0.14),采用随机效应模型进行Meta分析,结果显示,早产儿ROP不是早产儿发生BPD的危险因素,差异无统计学意义〔OR=1.83,95%CI(0.80,4.14),P=0.15〕,见图22。


分别对每个影响因素采用固定效应模型和随机效应模型进行敏感性分析,结果显示,所有危险因素改变模型前后的合并结果没有实质性变化,说明各项影响因素在两种模型下的合并结果具有较高的稳定性和可信性。详见表2。
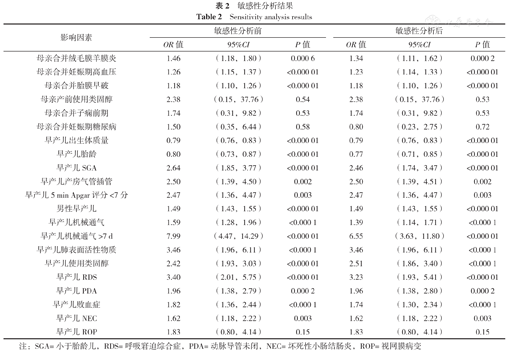
敏感性分析结果
Sensitivity analysis results
敏感性分析结果
Sensitivity analysis results
| 影响因素 | 敏感性分析前 | 敏感性分析后 | ||||
|---|---|---|---|---|---|---|
| OR值 | 95%CI | P值 | OR值 | 95%CI | P值 | |
| 母亲合并绒毛膜羊膜炎 | 1.46 | (1.18,1.80) | 0.000 6 | 1.34 | (1.11,1.62) | 0.000 2 |
| 母亲合并妊娠期高血压 | 1.26 | (1.15,1.37) | <0.000 01 | 1.23 | (1.14,1.33) | <0.000 01 |
| 母亲合并胎膜早破 | 1.18 | (1.10,1.26) | <0.000 01 | 1.18 | (1.10,1.26) | <0.000 01 |
| 母亲产前使用类固醇 | 2.38 | (0.15,37.76) | 0.54 | 2.38 | (0.15,37.76) | 0.53 |
| 母亲合并子痫前期 | 1.74 | (0.31,9.82) | 0.53 | 1.74 | (0.31,9.82) | 0.53 |
| 母亲合并妊娠期糖尿病 | 1.50 | (0.35,6.44) | 0.58 | 0.80 | (0.23,2.75) | 0.72 |
| 早产儿出生体质量 | 0.79 | (0.76,0.83) | <0.000 01 | 0.79 | (0.76,0.83) | <0.000 01 |
| 早产儿胎龄 | 0.80 | (0.73,0.87) | <0.000 01 | 0.77 | (0.71,0.85) | <0.000 01 |
| 早产儿SGA | 2.64 | (1.85,3.77) | <0.000 01 | 2.46 | (1.74,3.47) | <0.000 01 |
| 早产儿产房气管插管 | 2.50 | (1.39,4.50) | 0.002 | 2.50 | (1.39,4.51) | 0.002 |
| 早产儿5 min Apgar评分<7分 | 2.47 | (1.36,4.47) | 0.003 | 2.47 | (1.36,4.47) | 0.003 |
| 男性早产儿 | 1.49 | (1.43,1.55) | <0.000 01 | 1.49 | (1.43,1.55) | <0.000 01 |
| 早产儿机械通气 | 1.59 | (1.28,1.96) | <0.000 1 | 1.39 | (1.14,1.71) | <0.000 1 |
| 早产儿机械通气>7 d | 7.99 | (4.47,14.29) | <0.000 01 | 6.55 | (3.63,11.80) | <0.000 01 |
| 早产儿肺表面活性物质 | 3.46 | (1.96,6.11) | <0.000 1 | 3.46 | (1.96,6.11) | <0.000 1 |
| 早产儿使用类固醇 | 2.42 | (1.93,3.03) | <0.000 01 | 2.51 | (1.86,3.40) | <0.000 1 |
| 早产儿RDS | 3.40 | (2.01,5.75) | <0.000 01 | 3.23 | (1.93,5.41) | <0.000 01 |
| 早产儿PDA | 1.96 | (1.38,2.79) | 0.000 2 | 1.96 | (1.38,2.80) | 0.000 2 |
| 早产儿败血症 | 1.82 | (1.36,2.44) | <0.000 1 | 1.74 | (1.30,2.34) | <0.000 1 |
| 早产儿NEC | 1.62 | (1.18,2.22) | 0.003 | 1.62 | (1.18,2.22) | 0.003 |
| 早产儿ROP | 1.83 | (0.80,4.14) | 0.15 | 1.83 | (0.80,4.14) | 0.15 |
注:SGA=小于胎龄儿,RDS=呼吸窘迫综合症,PDA=动脉导管未闭,NEC=坏死性小肠结肠炎,ROP=视网膜病变
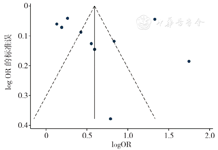
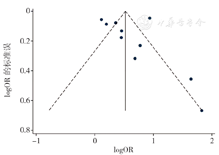
采用漏斗图结合Begg's检验和Egger's检验对纳入文献数量≥10篇的Meta分析结果进行发表偏倚评估,结果显示,漏斗图中男性早产儿、早产儿PDA、早产儿败血症左右分布基本对称,提示存在发表偏倚的可能性较小,见图23,图24,图25。Begg's检验结果显示,男性早产儿(Z=0.16,P=0.876),早产儿PDA(Z=1.79,P=0.074),早产儿败血症(Z=1.79,P=0.074)无发表偏倚;Egger's检验结果显示,男性早产儿(t=-0.25,P=0.806),早产儿PDA(t=0.15,P=0.882),早产儿败血症(t=0.10,P=0.922)无发表偏倚。




本研究仅纳入国内外的多中心病例对照研究或队列研究,在一定程度上降低了单中心研究的偏倚风险,提高了研究结果的准确性。本Meta分析结果显示,母亲产前因素、早产儿产时因素以及产后因素(包括早产儿治疗因素和合并症)均可促进早产儿BPD的发生发展。
本研究共纳入6项产前危险因素,其中母亲合并绒毛膜羊膜炎、妊娠期高血压以及胎膜早破是早产儿发生BPD的主要危险因素。一项纳入158项研究的Meta分析结果显示[34],母亲合并绒毛膜羊膜炎与早产儿BPD风险增加有关,本研究结果与之一致。可能的机制是暴露于绒毛膜羊膜炎可加速功能性肺成熟,但同时也增加了早产儿肺对出生后损伤的敏感性[35]。研究发现,胎盘炎性反应与血管病理及BPD发病机制之间存在相互作用[36]。宫内炎症影响胎儿肺发育,炎症介导的胎儿肺血管重塑影响肺收缩功能,使肺血流阻力增加,最终导致BPD[37]。有证据表明,肺血管的生成可促进肺泡生长,并有助于维持出生后的肺泡结构,破坏或阻碍血管生成的母体因素可能导致胎儿肺血管发育受阻和肺泡化障碍,从而增加早产儿BPD的发生率[38],而母亲妊娠期合并高血压有较低的血管生长因子水平[39],这可能解释了妊娠期高血压与BPD之间的关系。本研究发现,早产儿BPD的发生与母亲合并胎膜早破相关,考虑胎膜早破后羊水减少、感染增加、炎性反应等因素导致肺发育成熟障碍,增加BPD的发生率。
本研究结果显示,早产儿出生体质量高、胎龄高是早产儿发生BPD的保护因素,而早产儿SGA、产房气管插管、5 min Apgar评分<7分、男性早产儿是早产儿发生BPD的主要危险因素。研究发现,在患有BPD的婴儿中,近95%为极低出生体质量儿(very low birth weight infant,VLBW),近80%胎龄在22~24周[5]。当早产儿的肺发育处于小管期(胎龄17~27周)或囊泡期(胚胎28~35周)时容易受到氧化应激、炎性反应等损伤,导致肺结构发育受阻和关键阶段的修复中断,肺发育不成熟是早产儿BPD发生的关键因素[40]。因此,加强围生期保健管理,尽可能延长孕周对极早产儿和VLBW的短期结局和长期预后具有重要意义。早产儿SGA可能通过抑制肺生长对BPD产生影响,可能涉及肺血管生成的改变[41]。ROCHA等[42]在葡萄牙11家三级新生儿中心对胎龄在24~30周的早产儿数据进行分析,经调整BPD其他危险因素后,发现SGA与BPD之间存在显著相关性〔OR=5.20,95%CI(1.46,18.58),P<0.01〕,本研究结果与之一致。本研究发现,早产儿产房气管插管与BPD的风险增加有关。复苏过程中存在肺损伤的可能性,在出生后关键的最初几分钟内,早产儿接受面罩正压通气不足可能导致持续缺氧和心动过缓,需要紧急插管。有研究表明,产房气管插管率高的中心往往有较高的通气率和BPD发生率[16]。因此,加强产房复苏策略,减少产房气管插管率十分必要[43]。本研究结果显示,早产儿5 min Apgar评分<7分是早产儿BPD的危险因素,考虑低Apgar评分婴儿伴有出生窒息、全身脏器灌注不足,可导致肺循环阻力增加、血流减少,从而造成肺血管重构、肺发育阻滞[44]。本研究发现,男性与早产儿BPD的发生密切相关。极早产儿的肺发育存在性别差异,肺处于小管期时女性胎肺发育更快,因此,男性早产儿患BPD的风险更高[45]。小鼠实验表明,与雌性相比,雄性小鼠的肺泡化和肺血管生成更容易停滞,炎性反应也更多[46]。
本研究结果显示,早产儿的产后治疗措施(包括机械通气、机械通气>7 d、使用肺表面活性物质、使用类固醇)以及合并症(包括RDS、PDA、败血症、NEC)是早产儿发生BPD的主要危险因素。本研究发现,早产儿机械通气是早产儿BPD的主要危险因素,具有明显的剂量-反应效应,且机械通气>7 d与早产儿BPD之间关联性更加显著〔OR=7.99,95%CI(4.47,14.29),P<0.000 01〕。实验证据表明,机械通气诱导的气压性创伤和容积性创伤与动物肺中模拟人类BPD的病理结构和炎性反应变化之间存在明显联系[47]。持续机械通气不仅干扰肺发育、引起肺泡发育停滞,还可介导肺部的炎性损伤、导致肺部感染、延长通气时间并进一步加重BPD的发病风险,形成恶性循环。因此,积极预防和控制肺部感染、减少机械通气、缩短机械通气时间至关重要。肺表面活性物质是磷脂和表面活性物质蛋白形成的复杂混合物,其脂质和蛋白质的合成取决于肺泡2型细胞(AT2)的分化,而这种分化通常发生在妊娠晚期,因此,由于早产儿AT2细胞分化不完全,导致表面活性物质缺乏,从而导致早产儿出现RDS[48]。外源性表面活性物质的应用有效降低了RDS的严重程度和致死率,但无法治疗极早产儿肺结构发育不成熟,因此极早产儿存活率的提高可能会增加患慢性肺部疾病早产儿的总体比例。本研究结果显示,早产儿使用类固醇治疗增加了BPD的发生,考虑其原因为类固醇治疗通常应用于病情最严重的早产儿,类固醇在肺疾病早期可暂时改善肺功能,但长期应用可能影响肺预后,但因纳入文献较少,该结果解读尚不严谨。"经典BPD"多发生于RDS患儿,主要由于表面活性物质的缺乏,未成熟肺早期需要机械通气或者氧疗,导致氧化应激损伤、肺血管重塑和肺纤维化,最终进展成BPD。早产儿娩出后氧气诱导动脉导管收缩机制不成熟,导管持续开放与BPD的发生密切相关,PDA持续开放时间越长则BPD发生风险越大[49]。败血症引起的全身炎性反应与肺发育相互作用,导致肺泡发育不全和肺血管畸形,是BPD的组织学特征,两者之间的关联已经被证实[50]。感染控制策略不仅可以预防败血症,还可以预防早产儿BPD的发生。LAPCHAROENSAP等[51]研究发现,医院感染的减少对降低早产儿BPD的发生有积极影响。因此,控制感染是预防BPD的要素,医护人员平时需注重手卫生,强化无菌操作。本研究结果显示,早产儿NEC可能增加BPD的发病风险,考虑因肠道缺血坏死引发的后续炎性反应可能导致肺损伤,但因纳入文献较少,还需更多大样本研究验证此结论。
本Meta分析结果显示:母亲产前因素如母亲合并绒毛膜羊膜炎、妊娠期高血压、胎膜早破,早产儿产时因素如SGA、产房气管插管、5 min Apgar评分<7分、男性,早产儿产后因素如机械通气、机械通气>7 d、使用肺表面活性物质、使用类固醇、RDS、PDA、败血症、NEC是早产儿发生BPD的主要危险因素;高出生体质量、高胎龄是早产儿发生BPD的保护因素。BPD是多种因素共同作用下的早产儿慢性肺部疾病,在VLBW中易造成严重的近期、远期后遗症且病死率极高,医护人员在临床工作中应注意识别高危患儿,针对高危因素进行早期预防和控制,可减少早产儿BPD的发生,改善其预后结局。
本研究的局限性:(1)本研究纳入的文献样本量差异较大,各结局指标定义标准不尽相同,存在一定的异质性;(2)由于单中心研究低泛化性和高偏倚风险,故本研究仅纳入多中心研究,使得研究结果不够全面;(3)部分观察指标进行分析时纳入文献数量较少,分析结果在一定程度上存在局限性。因此,今后仍需采取多中心研究,以进一步明确各种危险因素与早产儿BPD的关系。
本文无利益冲突。



























