
2023年慢性阻塞性肺疾病全球倡议(GOLD)维持了2022年的基本框架,但在慢性阻塞性肺疾病(以下简称慢阻肺)定义、评估、初始治疗和随访期管理等方面进行了较大修订,主要包括:(1)第1章定义和概述部分被重写,提出慢阻肺新定义,纳入慢阻肺新的背景信息、治疗策略和分类,新增慢性支气管炎的内容;(2)第2章诊断和评估部分增加慢阻肺筛查和病例发现的相关内容,将ABCD评估工具修订为ABE评估工具(即慢阻肺急性加重高风险人群不再根据症状水平进一步分组),更新影像学和计算机断层扫描(CT)信息;(3)第3章预防和维持治疗部分更新了肺炎链球菌疫苗接种建议,新增了降低慢阻肺死亡率的干预措施的信息,更新吸入制剂递送相关问题,新增吸入药物依从性的内容,更新了远程康复相关证据,扩充了慢阻肺介入和手术治疗的内容;(4)第4章慢阻肺稳定期管理部分新增吸入装置选择的内容,更新了初始药物治疗和随访期药物治疗的信息;(5)第5章慢阻肺急性加重管理部分提出慢阻肺急性加重的新定义和一套新参数以评估慢阻肺急性加重严重程度,扩展了慢阻肺急性加重鉴别诊断的内容;(6)第6、7章根据最新证据更新了关于慢阻肺与合并症、慢阻肺与新型冠状病毒感染的内容。以上更新对慢阻肺的临床诊疗具有重要的指导意义。

本刊2023年版权归中国全科医学杂志社所有
未经编辑部许可,不得任意转载和摘编
本刊所发表作品仅为作者观点,并不代表编委会和编辑部意见
如有印装质量问题请向本刊发行部调换
慢性阻塞性肺疾病全球倡议(Global Initiative for Chronic Obstructive Lung Disease,GOLD)2023年修订版(以下简称GOLD 2023)于当地时间2022-11-14在线发布[1]。与GOLD 2022相比,GOLD 2023基本框架未变,但新增387篇文献,在关于慢性阻塞性肺疾病(以下简称慢阻肺)相关定义、诊断、评估、初始治疗和随访期管理等方面均进行了重大修订。本文对GOLD 2023重要更新内容进行简介和解读。
本章新增106篇文献,内容被重写,纳入有关慢阻肺的新背景信息以及术语,并增加分类学新策略。
GOLD 2023与GOLD 2022的慢阻肺定义(英文原文)对比见图1。


GOLD 2023的慢阻肺定义:慢阻肺是一种异质性肺部状态,以慢性呼吸道症状(呼吸困难、咳嗽、咳痰)为特征,是由于气道异常(支气管炎,细支气管炎)和/或肺泡异常(肺气肿)导致的持续性(常为进展性)气流阻塞[2]。与既往定义不同之处在于:
(1)定义中删除了"常见的、可预防、可治疗"的表述,但在正文中保留,这种改变使定义更加简明,重点突出了临床与病理生理学特点。
(2)增加了"异质性(heterogeneous)",从而凸显慢阻肺的病因学、病理学、病理生理学及临床表现存在显著的多样性及个体差异。这一点也体现在下文提出的慢阻肺新分类上。
(3)把慢阻肺从称为"疾病(disease)"修订为"肺部状态(lung condition)"。这种改变主要是为了体现慢阻肺的异质性。慢阻肺不同阶段和表型的多样性表现,用肺部状态表述更为贴切。在GOLD 2023正文中也谈到,慢阻肺的早期肺部异常,例如:高分辨CT上显示的肺气肿、肺大疱、气体陷闭,肺功能上表现为"保留比率的肺功能减损(preserved ratio impaired spirometry,PRISm)",这些状态并不符合目前的疾病诊断标准,但可能是慢阻肺前期改变。
(4)将"持续性呼吸道症状"修订为"慢性呼吸道症状",表明慢阻肺的呼吸道症状是慢性状态(持续性、间断性、不典型或较为隐匿等),而不一定均为"持续性"。新定义的表述更为严谨。
(5)更准确地表述了慢阻肺的主要病理改变,即"气道异常(支气管炎,细支气管炎)和/或肺泡异常(肺气肿)"。
(6)删除了此前关于慢阻肺病因学的表述。慢阻肺的病因复杂,此前GOLD 2022[3]定义的相关表述"……通常由大量暴露于有毒颗粒物或气体引起,并受宿主因素(包括肺发育异常)的影响"显然不够全面且过于简化。因此,GOLD 2023并未纠结于在慢阻肺定义中涵盖病因学,而是用"异质性"让读者意识到慢阻肺病因的复杂性与多样性。
(7)病理生理方面,GOLD 2023用"持续性(常为进行性)气流阻塞",体现多数慢阻肺患者的"气流阻塞"会逐渐加重的演变规律。相比GOLD 2022[3]仅用"持续性气流受限",GOLD 2023的表述更严谨。
慢阻肺是由基因(G)-环境(E)在个体一生(T)中发生相互作用的结果,这种相互作用可能损害肺部和/或改变其正常的发育/衰老过程[4]。导致慢阻肺的主要环境暴露是吸烟和吸入来自家庭、室外空气污染的有毒颗粒和气体,但其他环境和宿主因素(包括肺发育异常和肺老化加速)也可能起作用[5]。迄今为止的研究发现与慢阻肺最相关的遗传风险因素是导致α-1抗胰蛋白酶缺乏的SERPINA1基因突变(尽管罕见),但其他一些遗传变异也与肺功能降低和慢阻肺风险相关,虽然其个体效应很小[6]。
GOLD 2023首次写入PRISm,即一秒率正常〔吸入支气管舒张剂后第1秒用力呼气容积/用力肺活量(FEV1/FVC)≥0.7〕但肺通气功能减损〔吸入支气管舒张剂后第1秒用力呼气容积占预计值百分比(FEV1%)和/或用力肺活量占预计值百分比(FVC%)<80%〕的人群,同时有肺结构性改变(例如肺气肿)和/或生理异常(例如过度充气、弥散功能降低、FEV1快速下降)。PRISm的患病率为7.1%~20.3%,在当前和既往吸烟者中较高,与体质指数(BMI)过高和过低均相关,并且与全因死亡率的增加有关[7]。然而,PRISm并非总是稳定的表型,随时间的推移肺功能可转变为正常或阻塞性气流受限[7]。GOLD 2023同时指出,虽然并非所有PRISm人群最终会发展为固定气流阻塞(慢阻肺),但因其已出现症状和/或有功能和/或结构异常,因此该人群应被视为"患者"并得到照护和治疗。
多项针对慢阻肺患者的大型研究显示,CB的患病率为27%~35%[8,9,10],与CB发病率增高相关的因素包括男性、年轻人、更高的吸烟量(包年)、更严重的气流受限、农村和职业暴露。CB的危险因素除最主要的吸烟外,还包括接触粉尘、生物燃料、化学烟雾、室内烹饪、取暖燃料和患有胃食管反流(GER)等[8,9,10,11,12,13,14]。
咳嗽和咳痰主要与大气道黏液分泌有关,然而,小气道也会发生黏液分泌增加,并且与管腔阻塞有关,其特征是有呼吸困难但咳嗽、咳痰较少[15,16]。无CB症状的慢阻肺患者也可存在黏液栓的影像学表现,并与生活质量恶化相关[17,18]。影像学黏液栓与临床症状(无CB症状)不一致是否代表不同表型需进一步研究。
对于50岁以下的成人,不伴气流受限的CB是慢阻肺患病的长期风险和全因死亡率的早期标志[19]。36~43岁存在慢性黏液分泌的吸烟者,气流受限的风险显著增高,但戒烟后黏液分泌可恢复至与从不吸烟者相同的水平[19]。慢性黏液高分泌时间越长,FEV1下降越多。然而,慢性黏液高分泌与死亡率之间的关联尚不明确。有研究显示,在校正呼吸功能损害和吸烟的情况下,黏液分泌对病死率无预测价值[20,21,22];但也有研究表明,痰的产生在预测总死亡率和慢阻肺特定死亡率方面具有独立作用[23,24,25]。哥本哈根心脏研究发现,慢性黏液高分泌人群的肺部感染风险增加,访视10年后,有54%的患者死亡与肺部感染有关[25]。此外,慢性黏液高分泌可引起FEV1下降速率加快、住院次数增加[26],伴有严重肺气肿的患者,合并CB会增加住院次数和病死率[27]。PRESCOTT等[25]发现非阻塞性CB患者的全因及呼吸相关病死率均增加。综上,GOLD 2023表明需要关注CB与慢阻肺的关系,以及黏液高分泌症状对疾病的影响。
慢阻肺传统被理解为由吸烟引起的单一"疾病"[28]。大部分研究均基于吸烟相关的慢阻肺发病机制,而未能扩展到其他已知的可能机制[4]。因此,将慢阻肺的分类扩大到包括非吸烟相关的类型很重要。GOLD 2023根据最新的研究更新了背景信息,提出了不同发病危险因素的慢阻肺分型和相应的新术语。慢阻肺新分类见表1,包括:(1)遗传决定的慢阻肺(慢阻肺-G);(2)肺发育异常导致慢阻肺(慢阻肺-D);(3)环境性慢阻肺:包括吸烟相关慢阻肺(慢阻肺-C)和生物燃料与污染暴露相关慢阻肺(慢阻肺-P);(4)感染导致慢阻肺(慢阻肺-I);(5)慢阻肺合并哮喘(慢阻肺-A);(6)不明原因的慢阻肺(慢阻肺-U)。
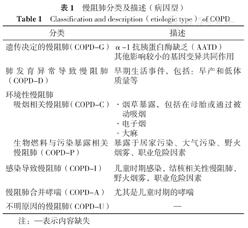
慢阻肺分类及描述(病因型)
Classification and description(etiologic type) of COPD
慢阻肺分类及描述(病因型)
Classification and description(etiologic type) of COPD
| 分类 | 描述 | |
|---|---|---|
| 遗传决定的慢阻肺(COPD-G) | α-1抗胰蛋白酶缺乏(AATD)其他影响较小的基因变异共同作用 | |
| 肺发育异常导致慢阻肺(COPD-D) | 早期生活事件,包括:早产和低体质量等 | |
| 环境性慢阻肺 | ||
| 吸烟相关慢阻肺(COPD-C) | ·烟草暴露,包括在母胎或通过被动吸烟 | |
| ·电子烟 | ||
| ·大麻 | ||
| 生物燃料与污染暴露相关慢阻肺(COPD-P) | 暴露于居家污染、大气污染、野火烟雾、职业危险因素 | |
| 感染导致慢阻肺(COPD-I) | 儿童时期感染,结核相关性慢阻肺,野火烟雾,职业危险因素 | |
| 慢阻肺合并哮喘(COPD-A) | 尤其是儿童时期的哮喘 | |
| 不明原因的慢阻肺(COPD-U) | — | |
注:—表示内容缺失
本章新增26篇文献,主要更新内容:(1)增加了针对"筛查和病例发现"的内容;(2)修订了慢阻肺稳定期综合评估工具,将C、D组合并为E组,慢阻肺急性加重高风险患者不再根据症状进行区分;(3)更新了慢阻肺筛查及胸部CT应用。
本部分围绕不同人群(一般人群、无症状人群、有症状/高风险人群),从"成本-效益"角度出发,阐述了肺功能筛查、病例发现工具对慢阻肺诊断率、医疗行为和预后的影响。对于无症状也没有危险因素的人群不推荐做肺功能筛查,而有症状或危险因素者做肺功能筛查有助于早期发现病例[29,30]。FEV1和FVC均可预测慢性呼吸系统疾病和其他慢性非传染病的全因死亡率(独立于吸烟)[31],且肺功能异常可识别出肺癌风险增加的吸烟者亚组[32,33]。然而,目前支持人群肺功能筛查(在出现显著症状前得以识别慢阻肺)指导管理决策或改善疾病预后的数据仍较薄弱。
新型筛查工具包含危险因素暴露、症状、健康资源利用、简单的呼气峰流速测定,应用于中低收入国家有助于发现慢阻肺患者[34,35]。在基层医疗卫生机构开展慢阻肺筛查和病例发现提高了医生对慢阻肺的诊断率,改变了医生的临床处置,但对疾病预后影响的数据有限。未来需要评估这些工具对改善医生临床行为、医疗资源利用和患者预后的影响,同时关注对于患者是否有可负担、成本-效益比相对较好的干预方法。
一旦通过肺功能检查确诊慢阻肺,必须着重评估以下4个基本方面从而指导治疗:(1)气流受限的严重程度;(2)当前症状的性质和严重程度;(3)既往中重度慢阻肺急性加重史;(4)其他疾病的存在和类型(合并症)。GOLD 2011根据肺功能(FEV1%指标)、症状和慢阻肺急性加重史对稳定期慢阻肺进行综合评估,提出ABCD分组方法,较之前仅依据肺功能分级有很大的进步。考虑到肺功能与慢阻肺患者症状、活动能力、慢阻肺急性加重等之间的相关性较弱且使分类复杂化,GOLD 2017将肺功能分级从ABCD分组中剥离出来,综合评估仅包含症状和慢阻肺急性加重史,以避免用肺功能和慢阻肺急性加重史双重评估导致分组混乱,从而在没有肺功能检查的情况下依然能进行慢阻肺评估和治疗。GOLD 2023将C、D组合并为E组,将ABCD评估方法修订为ABE评估,对于慢阻肺急性加重高风险人群不再按照症状程度进行区分。这种评估方法使临床医生对慢阻肺急性加重高风险人群的评估更简单明了,同时也突出了慢阻肺急性加重高风险人群管理的重要性和紧迫性(图2)。
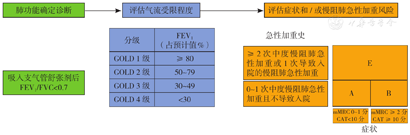

注:GOLD=慢性阻塞性肺疾病全球倡议,FEV1=第1秒用力呼气容积,FVC=用力肺活量,mMRC=改良的医学研究委员会呼吸困难量表,CAT=慢阻肺评估测试
近年来,CT检查普及率越来越高,为慢阻肺存在的结构病理生理异常提供了大量信息。从临床角度来看,肺气肿的分布和严重程度很容易辨别,可用于肺减容术(LVRS)或支气管内活瓣(EBV)置入的辅助决策。肺气肿的存在还与FEV1快速下降、病死率以及肺癌发生风险增加有关[36]。此外,约30%慢阻肺患者胸部CT可见支气管扩张,并与加重频率和病死率增加有关[37]。尽管其他定量CT指标的标化程度不如肺气肿定量,但GOLD 2023也提到气道异常、非肺气肿气体陷闭、冠状动脉钙化、肺动脉扩张、骨密度、纹理特征等定量CT参数与慢阻肺的众多临床结局相关。最后,GOLD 2023建议对有反复慢阻肺急性加重史、症状与气流受限严重程度不符、FEV1低于预计值45%同时伴有显著过度充气或符合肺癌筛查标准的慢阻肺患者,应考虑胸部CT检查(表2)。可以预见,完善的定量CT参数体系将在慢阻肺的个体化诊疗及评估中逐渐发挥重要作用。

CT在稳定期慢阻肺中的应用
Application of CT in stable COPD
CT在稳定期慢阻肺中的应用
Application of CT in stable COPD
| 应用场景 | 描述 |
|---|---|
| 鉴别诊断 | ·伴有大量咳痰的频繁慢阻肺急性加重,需要警惕支气管扩张或不典型的感染 |
| ·症状超出了基于肺功能的疾病严重程度 | |
| 肺减容术评价 | ·如患者吸入支气管舒张剂后FEV1%在15%~45%并且有过度充气的证据,支气管内活瓣置入可作为治疗选择 |
| ·对于伴有过度充气、严重的上叶为主的肺气肿以及肺康复后仍为低活动耐量的患者,外科肺减容术作为治疗选择 | |
| 肺癌筛查 | ·对于由吸烟导致的慢阻肺患者,推荐以低剂量CT扫描进行肺癌筛查 |
注:FEV1%=第1秒用力呼气容积占预计值百分比
为解决临床实践中慢阻肺的异质性和复杂性,GOLD 2023提出一种基于"可治疗特征"的策略[38]。这个概念类似于中国医生在临床上常说的"治疗空间"。可治疗特征可通过2种方式识别:基于表型识别和/或通过已验证的生物标志物〔如血嗜酸粒细胞计数(EOS)〕对关键的因果通路(内型)的深入理解[39]。多种可治疗特征可存在于同一患者并自发地或由于治疗而随时间变化[40]。GOLD 2023强调了"持续性呼吸困难"和"慢阻肺急性加重"两个关键的可治疗特征在药物治疗后访视流程中的作用,但还有更多值得关注和治疗的可治疗特征,如肺部和肺外特征、行为/社会风险因素等。基于"可治疗特征"的策略,有望对每个患者实现"量体裁衣式"的诊疗方案制定,体现了个体化医学逐渐趋于精细化。
本章新增了可降低慢阻肺死亡率的治疗干预措施的支持证据,扩充了吸入制剂递送内容,新增了吸入药物依从性评估和改善措施,并对其他治疗措施补充了新的证据。
GOLD 2023汇总了近年关于可降低慢阻肺患者病死率的干预措施的研究报道,新增了一个"可降低病死率的药物与非药物治疗"表格,其中包括:长效β2受体激动剂(LABA)+长效抗胆碱能药物(LAMA)+吸入糖皮质激素(ICS)三联吸入治疗,戒烟,肺康复,长期氧疗,无创正压通气,肺移植和LVRS。其意义在于提示临床实践中需要关注"最大限度降低慢阻肺病死率"的问题,同时认可了三联吸入制剂是唯一可降低慢阻肺死亡率的药物治疗方案。
慢阻肺患者应根据当地相关指南接种所有推荐的疫苗。GOLD 2023根据当前美国疾病控制与预防中心(CDC)指南调整了对肺炎链球菌疫苗的推荐意见,流感疫苗、新冠疫苗、百白破疫苗接种推荐与GOLD 2022相同。
肺炎球菌疫苗〔肺炎球菌结合疫苗(PCV20或PCV15)和肺炎球菌多糖疫苗(PPSV23)〕被获批用于≥65岁的成人;也被批准用于患有基础疾病的19~64岁成人,即取消了接种人群的年龄限制。目前,美国CDC建议慢阻肺患者接种1剂PCV20;或接种1剂PCV15,随后序贯接种PPSV23。此外,PCV15、PCV20或PPSV23可以在成人免疫计划中与流感疫苗共同给药[41]。可见,GOLD 2023对各类疫苗接种的推荐更趋于积极。
吸入给药是慢阻肺治疗的核心,目前吸入装置和药物种类多,不同的吸入装置吸入方法不同。超过2/3的患者在使用吸入装置时至少会犯一次错误[42,43,44,45]。GOLD 2023重点阐述了"正确使用药物递送体系的能力"和"递送体系的选择",包括不同粒径药物的呼吸道递送、沉积及影响因素,以及不同递送体系(吸入装置)的影响因素、常见使用错误及临床选择等,并建议从"气溶胶药物管理改进小组(Aerosol Drug Management Improvement Team,ADMIT)"的网站获取更多相关信息。可见,GOLD 2023对吸入装置使用的指引和评估更为精细化。
这是GOLD 2023的新增内容,主要围绕4个方面对吸入治疗依从性进行了阐述:(1)治疗依从性的定义;(2)依从性不佳可能带来的各种不良后果;(3)影响治疗依从性的因素;(4)改善吸入治疗依从性的措施。
依从性是指一个人按照医疗保健提供者的处方用药的过程[46]。在包括慢阻肺在内的任何慢性病中,坚持治疗是一个有挑战性的问题。虽然吸入疗法是慢阻肺管理的关键组成部分,但吸入药物的依从性普遍较低,即使是在非常严重的患者中也是如此。不坚持药物治疗与慢阻肺症状控制不佳、慢阻肺急性加重风险增加、医疗保健利用率和成本增加、健康相关生活质量下降和死亡风险增加相关[47,48,49,50,51,52,53,54,55]。
与GOLD 2022相比,GOLD 2023在远程康复方面的内容基本相同,主要是增加了新的参考文献。传统的线下康复治疗的实施存在诸多挑战,如医保支付问题、频繁的交通往来等。GOLD 2022、GOLD 2023均提到远程康复可作为传统康复的替代方法,这在新型冠状病毒感染(COVID-19)大流行期间更加贴合时代需求。多项临床研究表明远程康复是安全的,一系列临床结局具有与基于中心的肺康复相似的获益。该领域的证据库仍在不断发展,目前尚未建立最佳实施方法[56]。
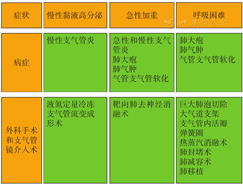
GOLD 2023扩充了慢阻肺支气管镜介入术和外科手术的内容,尤其对支气管镜介入术内容进行了细化叙述,包括:(1)肺气肿外科手术治疗:肺大疱切除,LVRS,肺移植。(2)慢阻肺支气管镜介入术:通过支气管镜介入减少严重肺气肿患者的肺过度充气,包括EBV,气道旁路支架,肺封堵术,热蒸汽消融术,弹簧圈肺减容术,肺移植前、后LVRS或内镜肺减容术(ELVR)序贯治疗,气道病变为主的治疗,过度动态气道塌陷(EDAC)的治疗,液氮定量冷冻治疗,靶向肺去神经消融术。以表格的形式归纳了不同外科手术和支气管镜介入手术的主要适应证(图3)。

本章在对慢阻肺患者初始用药及随访用药的推荐上发生了较大变化:(1)不再推荐LABA+ICS的单独使用,主要以LABA+LAMA及LABA+LAMA+ICS为主。(2)多次提到按前述的"可治疗特征"进行管理。(3)对于无ICS禁忌证的患者,ICS的启用更为积极。
GOLD 2023从药物及装置可及性、患者因素(理念、偏好、认知能力、吸气力量、操作能力等)、医护团队等方面,系统介绍了选择恰当的吸入装置的基本原则(表3)。

选择恰当的吸入装置的基本原则
Basic principles for appropriate inhalation device choice
选择恰当的吸入装置的基本原则
Basic principles for appropriate inhalation device choice
| ◆药物在该装置的可及性 | |
| ◆需要评估和考量患者的理念、对当前和以往使用装置的满意度和偏好 | |
| ◆尽量减少每个患者使用的不同装置类型的数量,理想情况是只需要一种装置 | |
| ◆在没有临床判断或没有给予适当的信息、宣教和随访的情况下,不应更换装置类型 | |
| ◆共享决策是吸入装置选择的最合适的策略 | |
| ◆必须考虑到患者的认知能力、操作灵巧性和吸气力量 | |
| ◆必须评估患者对该装置进行正确吸入操作的能力: | |
| ·患者能用力深吸气时,才适合使用干粉吸入器。检查患者能否通过装置用力吸气,如存疑,则应客观评估或选择替代装置 | |
| ·MDI和SMI需要在装置触发和吸气之间的协调,患者需要能进行缓慢深吸气。检查患者能否从装置上缓慢深吸气,如存疑,则考虑增加储雾罐或选择替代装置 | |
| ·对于不能使用MDI(带或不带储雾罐)、SMI或DPI的患者,应考虑使用雾化器 | |
| ◆其他需要考虑的因素包括装置尺寸大小、便携性、花费 | |
| ◆如果在依从性/持久性或吸入技术存在问题,可以考虑使用智能吸入装置 | |
| ◆医生应该只开具他们(以及护理团队的其他成员)知道如何使用的吸入装置 | |
注:MDI=定量吸入剂,SMI=软雾吸入剂,DPI=干粉吸入剂
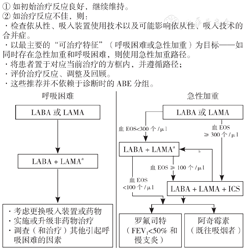
GOLD 2023根据新的ABE分组在初始治疗推荐上有重大更新。与既往一样,并没有太多高质量的证据〔如随机对照试验(RCT)〕来支持不同分组慢阻肺患者的初始药物治疗策略(图4)。
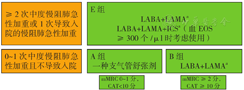

注:a单个吸入装置治疗可能比多个装置更方便和有效;EOS=嗜酸粒细胞,LABA=长效β2受体激动剂,LAMA=长效抗胆碱能药物,ICS=吸入糖皮质激素
A、B、E组治疗策略如下:
A组:初始治疗推荐不变,给予一种支气管舒张剂(短效或者长效)治疗,优选长效。
B组:初始治疗推荐LABA+LAMA,而删除了单一支气管舒张剂推荐。一项RCT显示,在研究前一年发生≤1次中度慢阻肺急性加重、慢阻肺评估测试(CAT)≥10分的患者中,LABA+LAMA在改善症状、肺功能和降低慢阻肺急性加重率上均优于单一支气管舒张剂。因此,在不存在可及性、成本和不良反应问题的情况下,LABA+LAMA被推荐为初始用药选择。
E组:推荐LABA+LAMA,并首次将LABA+LAMA+ICS纳入初始治疗推荐(血EOS≥300个/μl时考虑)。因此,在没有可及性、成本和不良反应问题的情况下,LABA+LAMA是E组的初始治疗首选。
如有ICS适应证应首选LABA+LAMA+ICS治疗。ETHOS研究[57]和IMPACT研究[58]均证明LABA+LAMA+ICS的组合在改善肺功能、降低慢阻肺急性加重方面均优于LABA+ICS。因此,GOLD 2023不推荐在慢阻肺患者中单独使用LABA+ICS,但对于已使用ICS+LABA的患者,如治疗效果好,可继续维持治疗。
当血EOS≥300个/μl,E组患者可考虑LABA+LAMA+ICS初始治疗(实践性建议)。尽管文献中没有关于新诊断患者初始使用三联治疗的直接证据,但GOLD 2023认为对EOS计数高的患者(血EOS≥300个/μl)推荐初始使用三联治疗是合理的。多项大型RCT研究已证明对于慢阻肺急性加重高风险患者,LABA+LAMA+ICS较双联支气管舒张剂显著获益。因此,使用血EOS预测ICS疗效时必须始终结合患者慢阻肺急性加重史进行考量。吸烟、种族和地理差异是否会影响ICS在血EOS中的获益,尚有待考证。如慢阻肺患者伴有哮喘,应像哮喘患者一样接受ICS治疗。此外对于100个/μl≤血EOS<300个/μl的患者,GOLD 2023对于ICS的推荐从"考虑使用(consider use)"修订为"赞成使用(favors use)"。可见,在无反指征(反复发生肺炎、血EOS<100个/μl、分枝杆菌感染史)的前提下,GOLD 2023对ICS的启用态度更为积极。
GOLD 2023随访期药物治疗路径仍分2条路径:呼吸困难和慢阻肺急性加重。对于呼吸困难为主要表现的路径,删除了含ICS的方案(包括LABA+ICS和LABA+LAMA+ICS)。对于频繁慢阻肺急性加重为主的路径,删除了LABA+ICS;使用单一支气管舒张剂吸入治疗后仍发生慢阻肺急性加重的患者,若患者血EOS≥300个/μl可直接升级为LABA+LAMA+ICS(图5)。

注:a单个吸入装置治疗可能比多个装置更方便和有效;b如出现肺炎或其他明显不良反应,在血EOS≥300个/μl时,降级ICS更可能与急性加重发生相关
COVID-19大流行极大地改变了医疗保健门诊服务的实施方式,而远程医疗则可建立患者与医疗保健服务之间的桥梁。然而,目前尚缺乏证据表明远程医疗在慢阻肺急性加重、住院、健康状况和死亡率的获益优于常规医疗[59]。
本章新增15篇文献,主要的变化是对慢阻肺急性加重的定义进行了较大修订,并扩充了慢阻肺急性加重的评估及鉴别诊断内容。
慢阻肺加重(ECOPD)被定义为14 d内以呼吸困难和/或咳嗽和咳痰增加为特征的事件,可伴有呼吸急促和/或心动过速,通常与感染、污染或其他气道损伤因素引起的局部和全身炎症增加有关。该定义与2021年美国胸科学会(ATS)的"罗马提案"基本一致[60]。新定义增加了"14 d内",强调ECOPD是一个急性的过程,有别于缓慢进展的慢阻肺疾病进展。该修订主要基于一项前瞻性队列研究,212例慢阻肺患者每日记录症状,中位随访时间2.8年,发现90%的患者从呼吸道症状首发至完整的ECOPD的时间为0~5 d,总体范围为0~14 d[61]。此外,新定义删除了过去定义中"导致需要额外治疗",因此可涵盖"未被识别和未被治疗"的ECOPD,使该定义更客观、全面。
GOLD 2023提出慢阻肺急性加重时其他急性事件的风险增加,尤其是失代偿性心力衰竭、肺炎和肺栓塞,这些事件可能与慢阻肺急性加重相似或可进一步加重患者病情。因此诊断慢阻肺急性加重时,需要鉴别临床表现类似的其他病因,根据其常见程度分为"最常见"(肺炎、肺栓塞、心力衰竭)和"次常见"(气胸、胸腔积液、心肌梗死和心律失常),使医生在处理慢阻肺患者呼吸道症状加重时的鉴别诊断思路更清晰(表4)。
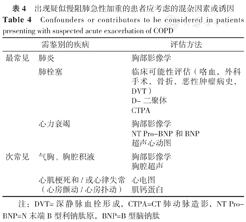
出现疑似慢阻肺急性加重的患者应考虑的混杂因素或诱因
Confounders or contributors to be considered in patients presenting with suspected acute exacerbation of COPD
出现疑似慢阻肺急性加重的患者应考虑的混杂因素或诱因
Confounders or contributors to be considered in patients presenting with suspected acute exacerbation of COPD
| 需鉴别的疾病 | 评估方法 | |
|---|---|---|
| 最常见 | 肺炎 | 胸部影像学 |
| 肺栓塞 | 临床可能性评估(咯血,外科手术,骨折,恶性肿瘤病史,DVT)D-二聚体CTPA | |
| 心力衰竭 | 胸部影像学NT Pro-BNP和BNP超声心动图 | |
| 次常见 | 气胸、胸腔积液 | 胸部影像学胸腔超声 |
| 心肌梗死和/或心律失常(心房颤动/心房扑动) | 心电图肌钙蛋白 | |
注:DVT=深静脉血栓形成,CTPA=CT肺动脉造影,NT Pro-BNP=N末端B型利钠肽原,BNP=B型脑钠肽
目前,慢阻肺急性加重的严重程度分级为:轻度(仅需要短效支气管舒张剂治疗)、中度(使用短效支气管舒张剂并加用抗生素和/或口服糖皮质激素治疗)和重度(需要住院或急诊就诊、ICU治疗)。GOLD 2023在沿用上述分级标准的同时,指出了这种分级明显的局限性:分级方法基于医疗资源的使用进行的事后评估,受到医疗资源可及性以及当地习俗等因素的影响,夹杂了大量的非疾病因素。研究显示由于治疗患者的可用资源和当地习俗对医院就诊和入院标准的影响存在全球差异,导致慢阻肺急性加重报告结果差异很大[62]。因此,GOLD 2023提出了一系列评估指标及流程,包含了4步:(1)诊断及鉴别诊断;(2)症状、体征评估;(3)辅助检查;(4)病因判断。该流程明显减少了非疾病因素对病情评估的影响,提示未来有可能通过这种评估,形成相应的评分,从而量化评估慢阻肺急性加重的严重程度(表5)。

慢阻肺急性加重的诊断及评估
Diagnosis and assessment of acute exacerbation of COPD
慢阻肺急性加重的诊断及评估
Diagnosis and assessment of acute exacerbation of COPD
| 步骤 | 实施内容 |
|---|---|
| 1 | 对慢阻肺和潜在的呼吸系统及非呼吸系统伴随疾病的证据进行全面的临床评估,包括考虑引起患者症状、体征的其他原因:主要有肺炎、心力衰竭和肺栓塞 |
| 2 | 评估: |
| a.症状,可以通过视觉模拟评分法(VAS)确定呼吸困难的严重程度,以及记录咳嗽的存在 | |
| b.体征(呼吸急促、心动过速)、痰量和颜色、呼吸窘迫(辅助呼吸肌参与呼吸) | |
| 3 | 使用恰当的额外检查来评估严重程度,如脉氧仪、实验室评估、CRP、动脉血气分析 |
| 4 | 确定事件的原因(病毒、细菌、环境、其他) |
注:CRP=C反应蛋白
与GOLD 2022一致,推荐的抗生素治疗时间为5~7 d。新增建议:对于慢阻肺急性加重的门诊患者抗生素治疗不超过5 d。一项荟萃分析发现在40岁以上的慢阻肺急性加重门诊患者中,短疗程抗生素治疗(≤5 d)与较长疗程抗生素治疗(≥6 d)的疗效相当[63]。此外,短时间接触抗生素可能降低产生微生物耐药性的风险,因此,可能成为治疗非卧床慢阻肺患者的一线疗法。
本章新增36篇文献,补充了新证据及增加了新的合并症(牙周炎、贫血、红细胞增多症、衰弱等)。合并症的存在不应改变慢阻肺的治疗,而合并症应按照通常的标准进行治疗。
胰岛素抵抗与女性罹患慢阻肺的风险增加有关,但与男性无关[68]。
SAPEY等[69]研究支持牙周炎和慢阻肺之间存在共同的病理生理学,均具有相似的中性粒细胞功能异常,但两者之间的联系仍有待阐明。牙周炎在慢阻肺中很常见,常需自行治疗,可能会减少慢阻肺急性加重发生。
7%~34%的慢阻肺患者合并贫血,其最常见类型为慢性病性贫血,其次为缺铁性贫血,主要与慢性全身性炎症、铁利用障碍有关。然而,慢阻肺患者的血红蛋白及血细胞比容的最佳水平仍未确定,也不清楚纠正贫血能否改善该类患者的预后。如慢阻肺患者诊断为贫血,建议系统寻找可治疗的病因。
继发性红细胞增多症(男性血红蛋白≥170 g/L,女性血红蛋白≥150 g/L)存在于6%~10.2%的门诊慢阻肺患者中。男性、当前吸烟、居住于高海拔、弥散功能减损、严重低氧血症、OSA与红细胞增多症风险增高相关,而长期氧疗则与其风险降低相关。在慢阻肺患者中,继发性红细胞增多症与肺动脉高压、静脉血栓及死亡相关,但这些关联应谨慎解释。当慢阻肺合并红细胞增多症,应仔细评估有无未纠正的低氧血症,并排查是否有其他需要干预的合并症。
在诊断慢阻肺后,患者更有可能发展为抑郁症,而且呼吸困难程度更严重的患者发生抑郁症的风险更高[70]。
可以定义为以下5种状态,包括:虚弱、行动迟缓、疲乏、低体力活动和非意愿性体质量下降。该状态可能有助于识别出不良预后风险的慢阻肺患者。
相较GOLD 2022,GOLD 2023本章节无原则性的修订,共新增19篇文献,主要是补充了慢阻肺与COVID-19的新证据。世界卫生组织制定了COVID-19治疗生活指南,目前推荐使用抗病毒药物、糖皮质激素、白介素6(IL-6)受体阻滞剂和巴瑞克替尼等治疗COVID-19。欧洲呼吸学会还制定了一份关于COVID-19住院成人管理的实施指南[71],但尚未对上述疗法在慢阻肺患者的有效性进行分析。
本文无利益冲突。



























