
糖尿病和慢性肾脏病(CKD)患者是肾衰竭、动脉粥样硬化性心血管疾病、心力衰竭和过早死亡的高危人群。美国糖尿病协会(ADA)和改善全球肾脏病预后组织(KDIGO)成立联合专家小组,根据ADA 2022年发布的糖尿病管理标准和KDIGO 2022年发布的《KDIGO临床实践指南:慢性肾脏病患者的糖尿病管理》中基于证据的CKD患者糖尿病管理建议进行整合,形成了2022版《ADA/KDIGO共识报告:慢性肾脏病患者的糖尿病管理》(简称共识)。该共识不仅重新强调了已发布指南更新的CKD筛查和诊断、血糖监测、生活方式干预、治疗目标和药物管理内容,还特别强调了健康生活方式基础上的药物治疗综合管理的重要性。该共识声明了7项核心建议,对肾素-血管紧张素系统抑制剂、二甲双胍、钠-葡萄糖共转运蛋白-2抑制剂、胰高血糖素样肽1受体激动剂和非甾体盐皮质激素受体拮抗剂的使用提供了具体指导,为改善糖尿病合并CKD患者临床结局的管理提供了明确方向。本文对该共识的主要内容进行解读,以期为临床医生提供简洁、实用的指导,改善糖尿病合并CKD患者的预后。

本刊2023年版权归中国全科医学杂志社所有
未经编辑部许可,不得任意转载和摘编
本刊所发表作品仅为作者观点,并不代表编委会和编辑部意见
如有印装质量问题请向本刊发行部调换
据国际糖尿病联合会估计,2021年有5.37亿人患有糖尿病,预计到2045年将增加到7.84亿[1]。慢性肾脏病(chronic kidney disease,CKD)在糖尿病患者中的发病率>25%,据估计,有40%的糖尿病患者最终可能会发展为CKD[2]。糖尿病是导致肾衰竭患者肾移植或透析的常见原因[3],CKD是糖尿病患者动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)、心力衰竭(heart failure,HF)、心血管死亡和全因死亡率显著增加的高危因素[4,5]。
筛查、诊断和认识不足会影响疾病的治疗和结局,并加剧种族、社会经济的差异。据估计,2019年全球糖尿病直接健康支出为7 600亿美元,伴有或不伴有肾衰竭的CKD是糖尿病护理的主要成本来源[6]。为明确和强调以及共享来自美国糖尿病协会(American Diabetes Association,ADA)2022年的糖尿病管理标准[7]以及改善全球肾脏病预后组织(Kidney Disease:Improving Global Outcomes,KDIGO)2022年《KDIGO临床实践指南:慢性肾脏病患者的糖尿病管理》[8]中提供的基于证据的管理建议,ADA和KDIGO代表组成的联合小组审查并制定了2022版《ADA/KDIGO共识报告:慢性肾脏病患者的糖尿病管理》[9](简称共识)。该共识不仅重新强调了已发布指南更新的CKD筛查和诊断、血糖监测、生活方式干预、治疗目标和药物管理,还特别强调了健康生活方式基础上的药物治疗综合管理的重要性。共识声明形成了7项核心建议,对肾素-血管紧张素系统(renin-angiotensin system,RAS)抑制剂、二甲双胍、钠-葡萄糖共转运蛋白-2抑制剂(sodium-glucose cotransporter-2 inhibitors,SGLT2i)、胰高血糖素样肽1受体激动剂(glucagon-like peptide 1 receptor agonists,GLP-1RA)和非甾体盐皮质激素受体拮抗剂(nonsteroidal mineral corticoid receptor antagonist,ns-MRA)的使用提供了具体指导,为改善糖尿病合并CKD患者临床结局的管理实施提供了明确方向。本文对共识内容进行解读,为临床医生提供简洁、实用的指导,以期改善糖尿病合并CKD患者的预后。
ADA和KDIGO均建议每年对糖尿病患者进行CKD筛查[7,8,9,10]。本共识继续沿用了KDIGO制定的CKD诊断标准,定义为估计肾小球滤过率(estimated glomerular filtration rate,eGFR)<60 ml·min-1·(1.73 m2)-1和/或尿白蛋白/肌酐比值(albumin-to-creatinine ratio,ACR)≥30 mg/g和/或其他肾脏损害标志物持续异常时间≥3个月[11]。
共识主张2型糖尿病(type 2 diabetes mellitus,T2DM)患者确诊后每年筛查CKD,而1型糖尿病(type 1 diabetes mellitus,T1DM)患者确诊5年后每年筛查CKD,筛查项目包括ACR和eGFR。若因ACR或eGFR(或两者)的持续异常被确诊CKD后,应立即开始治疗。共识再次强调CKD分期和对应的风险类别可用于指导CKD筛查、治疗和转诊至肾脏科治疗的频次[12],并主张将G1A3和G2A3人群的CKD筛查频次由2次/年调整为3次/年(表1)。
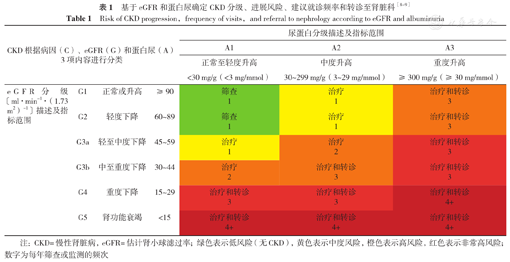
Risk of CKD progression,frequency of visits,and referral to nephrology according to eGFR and albuminuria
| CKD根据病因(C)、eGFR(G)和蛋白尿(A)3项内容进行分类 | 尿蛋白分级描述及指标范围 | |||||
|---|---|---|---|---|---|---|
| A1 | A2 | A3 | ||||
| 正常至轻度升高<30 mg/g(<3 mg/mmol) | 中度升高30~299 mg/g(3~29 mg/mmol) | 重度升高≥300 mg/g(≥30 mg/mmol) | ||||
| eGFR分级〔ml·min-1·(1.73 m2)-1〕描述及指标范围 | G1 | 正常或升高 | ≥90 | 筛查1 | 治疗1 | 治疗和转诊3 |
| G2 | 轻度下降 | 60~89 | 筛查1 | 治疗1 | 治疗和转诊3 | |
| G3a | 轻至中度下降 | 45~59 | 治疗1 | 治疗2 | 治疗和转诊3 | |
| G3b | 中至重度下降 | 30~44 | 治疗2 | 治疗和转诊3 | 治疗和转诊3 | |
| G4 | 重度下降 | 15~29 | 治疗和转诊3 | 治疗和转诊3 | 治疗和转诊4+ | |
| G5 | 肾功能衰竭 | <15 | 治疗和转诊4+ | 治疗和转诊4+ | 治疗和转诊4+ | |
注:CKD=慢性肾脏病,eGFR=估计肾小球滤过率;绿色表示低风险(无CKD),黄色表示中度风险,橙色表示高风险,红色表示非常高风险;数字为每年筛查或监测的频次
患者自我管理、教育和综合治疗方法有助于糖尿病合并CKD患者的治疗,ADA和KDIGO一致强调了全面、整体、以患者为中心的医疗管理在改善糖尿病合并CKD患者预后的重要性。
共识声明:所有T1DM或T2DM合并CKD患者应采取综合策略进行治疗,该计划由医疗保健专业人员和患者共同制定,在优化营养、运动、戒烟和体质量基础上,进行分层循证药物治疗,旨在保护器官功能,并控制血糖、血压和血脂水平达标。
值得注意的是,共识在综合管理章节中增加了关于ns-MRA的内容使用建议[9](图1)。多学科团队包括糖尿病护理和教育专家、医生、执业护士、医师助理、护士、营养师、运动专家、药剂师、牙医、足病医生和/或心理健康专业人员参与的综合管理和管理障碍的克服(图2)是本共识的另一大亮点。
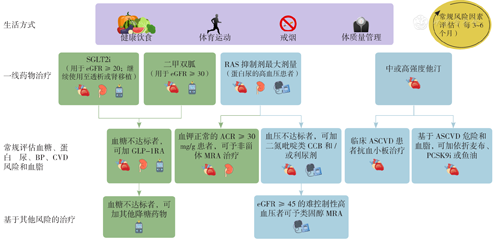

注:CKD=慢性肾脏病,eGFR=估计肾小球滤过率,SGLT2i=钠-葡萄糖共转运蛋白-2抑制剂,RAS=肾素-血管紧张素系统,BP=血压,CVD=心血管疾病,GLP-1RA=胰高血糖素样肽1受体激动剂,ACR=尿白蛋白/肌酐比值,CCB=钙通道阻滞剂,MRA=盐皮质激素受体拮抗剂,ASCVD=动脉粥样硬化性心血管疾病,PCSK9i=前蛋白转化酶枯草杆菌蛋白酶/kexin9型抑制剂,T2DM=2型糖尿病,T1DM=1型糖尿病;eGFR的单位为ml·min-1·(1.73 m2)-1

共识再次强调了饮食干预的重要性,推荐个性化和均衡的饮食,饮食应富含蔬菜、水果和全谷物。建议低钠饮食(KDIGO:<2 000 mg/d,ADA:1 500~<2 300 mg/d),并将膳食蛋白质摄入量定为0.8 g·kg-1·d-1,不过,对于接受维持透析治疗的肾衰竭患者推荐摄入更高水平的蛋白质(例如1.0~1.2 g·kg-1·d-1)[13]。在运动方面,共识建议进行中度至高强度/剧烈的体力活动,每周累积持续时间为≥150 min,并避免久坐不动的活动;同时也强烈建议戒烟。
ADA和KDIGO均建议对达到治疗要求的稳定型T2DM患者使用糖化血红蛋白(glycated hemoglobin,HbA1c)评估血糖,2次/年,对接受强化治疗、治疗方案改变或未达到治疗目标的患者应每季度进行血糖评估。同时ADA和KDIGO均指出,HbA1c无法充分反映血糖变异性和低血糖事件,尤其是在晚期CKD和接受透析治疗的肾衰竭患者中,而连续血糖监测(continuous glucose monitoring,CGM)作为识别和纠正血糖紊乱、预防低血糖、指导药物管理和指导医学营养治疗和体育活动的工具,在改善糖尿病管理方面发挥着重要作用。因此,该共识强调将HbA1c作为评估指标的同时,也应将CGM和自我血糖监测纳入监测管理,尤其是接受胰岛素治疗的患者。
同时,与其他指南一样,该共识再次强调了血糖控制的个性化目标,KDIGO建议糖尿病合并CKD患者的个体化HbA1c目标为<6.5%~8.0%;ADA建议起始HbA1c目标为<7.0%,但对于预期寿命有限且治疗危害大的患者,可接受更高目标(如HbA1c<8.0%)。
血压管理是预防CKD进展、ASCVD和HF的关键目标。ADA在每份年度诊治标准中均纳入血压的建议,并在2017年发布关于糖尿病和高血压的相关声明[14]。在《2020 KDIGO临床实践指南:慢性肾脏病患者的糖尿病管理》[15]和2022年《KDIGO临床实践指南:慢性肾脏病患者的糖尿病管理》中,血压控制被强调为综合诊治的关键组成部分。针对糖尿病合并CKD患者的血压首选治疗药物,ADA和KDIGO达成共识声明。
共识声明:对于有高血压伴白蛋白尿的T1DM或T2DM患者,建议使用血管紧张素转换酶抑制剂(angiotensin-converting enzyme inhibitors,ACEi)或血管紧张素受体拮抗剂(angiotensin Ⅱ receptor blocker,ARB),逐渐调整至最大降压剂量或最高耐受剂量。
同时共识指出,血压目标个体化应考虑患者的预期获益和潜在风险:ADA建议对于糖尿病、高血压和高心血管风险的患者,如果可以安全达到血压目标,血压目标为<130/80 mm Hg(1 mm Hg=0.133 kPa),对于糖尿病、高血压和低心血管风险患者,血压目标为<140/90 mm Hg;而KDIGO 2021《慢性肾病血压管理临床实践指南》建议CKD患者的目标收缩压<120 mm Hg,并通过标准化指南推荐的门诊测量进行评估(2B级建议)[16]。
他汀类药物治疗是糖尿病合并CKD患者ASCVD一级和二级预防的基石。2013年KDIGO慢性肾脏病血脂管理临床实践指南建议对大多数未接受透析治疗的糖尿病伴CKD成人患者开始行他汀类药物治疗[17,18]。ADA和KDIGO基于既往指南和新增循证证据一致认为:≥50岁且eGFR≥60 ml·min-1·(1.73 m2)-1的CKD成人患者,年龄在18~49岁的CKD合并糖尿病、冠心病、既往缺血性脑卒中或评估有10年冠心病死亡发生率或非致死性心肌梗死>10%的成人患者,推荐使用他汀类药物,并形成共识声明建议。
共识声明:建议对所有T1DM或T2DM合并CKD患者使用他汀类药物,对ASCVD进行一级预防使用中等强度他汀类药物;对已知ASCVD患者和有多种ASCVD危险因素的患者推荐使用高强度他汀类药物。
依据ADA 2022年的糖尿病管理标准及2022年《KDIGO临床实践指南:慢性肾脏病患者的糖尿病管理》建议,大多数T2DM合并CKD患者推荐使用二甲双胍加SGLT2i治疗(表2),若血糖未达标者或不耐受上述药物者,可考虑联合其他降糖药物(表3)。本共识基于ADA和KDIGO建议,针对T2DM合并CKD患者的降糖方案提出了共识声明,并制定了首选降糖药物的不良反应、监测要点和风险缓解策略(表4)以及eGFR≤45 ml·min-1·(1.73 m2)-1时降糖药物的推荐使用剂量(表5)。

Key glucose-lowering agent recommendations for patients with T2DM and CKD from ADA and KDIGO
| 药物分类 | ADA 2022年的糖尿病管理标准 | 2022年《KDIGO临床实践指南:慢性肾脏病患者的糖尿病管理》 |
|---|---|---|
| 二甲双胍 | 一线治疗取决于合并症、患者为中心的治疗因素和管理需求,通常包括二甲双胍和全面的生活方式改变(A) | 推荐eGFR≥30 ml·min-1·(1.73 m2)-1的T2DM合并CKD患者使用二甲双胍(1B);eGFR <45 ml·min-1·(1.73 m2)-1和45~59 ml·min-1·(1.73 m2)-1部分患者需调整二甲双胍给药剂量 |
| SGLT2i | (1)不论HbA1c基线水平、个体化HbA1c目标或二甲双胍是否使用,均考虑使用SGLT2i用于器官保护(2)在已确诊ASCVD或肾脏疾病的T2DM患者,推荐SGLT2i作为降低心血管风险和/或降糖方案的一部分(A)(3)在已确诊ASCVD、多种ASCVD危险因素或糖尿病肾病的T2DM患者,建议使用具有心血管益处的SGLT2i以降低MACE和/或心力衰竭住院的风险(A)(4)对于T2DM和糖尿病肾病患者,推荐eGFR≥20 ml·min-1·(1.73 m2)-1且尿白蛋白≥200 mg/g肌酐的患者使用SGLT2i,以减少CKD进展和心血管事件(A)(5)对于T2DM和糖尿病肾病患者,推荐eGFR≥20 ml·min-1·(1.73 m2)-1且尿白蛋白<200 mg/g肌酐的患者使用SGLT2i,以减少CKD进展和心血管事件(B) | 推荐SGLT2i用于eGFR≥20 ml·min-1·(1.73 m2)-1的T2DM合并CKD患者(1A) |
| GLP-1RA | 已确诊ASCVD或肾脏疾病的T2DM患者,推荐GLP-1RA作为全面降低心血管风险和/或降糖方案的一部分(A) | 对于联合使用二甲双胍和SGLT2i治疗但仍未达标的T2DM合并CKD患者,或无法使用这些药物的患者,建议启用长效GLP-1RA(1B) |
注:ADA=美国糖尿病协会,KDIGO=改善全球肾脏病预后组织,T2DM=2型糖尿病,SGLT2i=钠-葡萄糖共转运蛋白-2抑制剂,HbA1c=糖化血红蛋白,GLP-1RA=胰高血糖素样肽1受体激动剂,MACE=主要不良心血管事件;A级证据为来自实施良好、可推广的随机对照试验的明确或支持性证据,B级证据为来自实施良好的队列或病例对照研究的支持性证据;1A表示基于高质量证据的强烈推荐,1B表示基于中等质量证据的强烈推荐
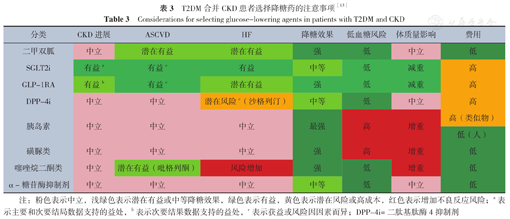
T2DM合并CKD患者选择降糖药的注意事项[13]
Considerations for selecting glucose-lowering agents in patients with T2DM and CKD
T2DM合并CKD患者选择降糖药的注意事项[13]
Considerations for selecting glucose-lowering agents in patients with T2DM and CKD
| 分类 | CKD进展 | ASCVD | HF | 降糖效果 | 低血糖风险 | 体质量影响 | 费用 |
|---|---|---|---|---|---|---|---|
| 二甲双胍 | 中立 | 潜在有益 | 潜在有益 | 强 | 低 | 中立 | 低 |
| SGLT2i | 有益a | 有益c | 有益 | 中等 | 低 | 减重 | 高 |
| GLP-1RA | 有益b | 有益c | 潜在有益 | 强 | 低 | 减重 | 高 |
| DPP-4i | 中立 | 中立 | 潜在风险c(沙格列汀) | 中等 | 低 | 中立 | 高 |
| 胰岛素 | 中立 | 中立 | 中立 | 最强 | 高 | 增重 | 高(类似物) |
| 低(人) | |||||||
| 磺脲类 | 中立 | 中立 | 中立 | 强 | 高 | 增重 | 低 |
| 噻唑烷二酮类 | 中立 | 潜在有益(吡格列酮) | 风险增加 | 强 | 低 | 增重 | 低 |
| α-糖苷酶抑制剂 | 中立 | 中立 | 中立 | 中等 | 低 | 中立 | 低 |
注:粉色表示中立,浅绿色表示潜在有益或中等降糖效果,绿色表示有益,黄色表示潜在风险或高成本,红色表示增加不良反应风险;a表示主要和次要结局数据支持的益处,b表示次要结果数据支持的益处,c表示获益或风险因因素而异;DPP-4i=二肽基肽酶4抑制剂

首选降糖药物的不良反应、监测要点和风险缓解策略[9]
Key monitoring and risk mitigation strategies for preferred glucose-lowering agents
首选降糖药物的不良反应、监测要点和风险缓解策略[9]
Key monitoring and risk mitigation strategies for preferred glucose-lowering agents
| 药物 | 不良反应 | 监测要点和风险缓解策略 |
|---|---|---|
| 二甲双胍 | 二甲双胍相关性乳酸酸中毒 | 当eGFR<60 ml·min-1·(1.73 m2)-1时,增加eGFR监测频次;根据eGFR适当调整二甲双胍剂量;当eGFR 45~59 ml·min-1·(1.73 m2)-1时,若患者易出现灌注不足和低氧血症,需考虑减少剂量;eGFR<30 ml·min-1·(1.73 m2)-1时需停药;制定病期(sick day)的计划 |
| 维生素B12吸收障碍 | 当接受二甲双胍治疗>4年时,需监测患者是否出现维生素B12缺乏 | |
| SGLT2i | 生殖器真菌感染 | 注意保持会阴部清洁 |
| 血容量不足 | 在高风险患者中需监测血容量不足,并考虑减少利尿剂剂量生病期间可维持SGLT2i | |
| 糖尿病酮症酸中毒 | 教育患者识别糖尿病酮症酸中毒的体征/症状;在风险极高情况下,监测血或尿酮;制定病期的计划;胰岛素治疗的患者,应维持低剂量的胰岛素 | |
| 低血糖 | 适当调整背景降糖药物(如胰岛素或磺脲类药物) | |
| GLP-1RA | 恶心/呕吐/腹泻 | 教育识别不良反应的症状和耐受性;从最低推荐剂量开始,逐渐调整剂量 |
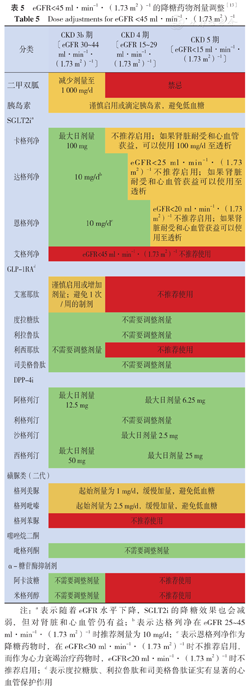
eGFR<45 ml·min-1·(1.73 m2)-1的降糖药物剂量调整[13]
Dose adjustments for eGFR <45 ml·min-1·(1.73 m2)-1
eGFR<45 ml·min-1·(1.73 m2)-1的降糖药物剂量调整[13]
Dose adjustments for eGFR <45 ml·min-1·(1.73 m2)-1
| 分类 | CKD 3b期〔eGFR 30~44 ml·min-1·(1.73 m2)-1〕 | CKD 4期〔eGFR 15~29 ml·min-1·(1.73 m2)-1〕 | CKD 5期〔eGFR<15 ml·min-1·(1.73 m2)-1〕 | |||
|---|---|---|---|---|---|---|
| 二甲双胍 | 减少剂量至1 000 mg/d | 禁忌 | ||||
| 胰岛素 | 谨慎启用或滴定胰岛素,避免低血糖 | |||||
| SGLT2ia | ||||||
| 卡格列净 | 最大日剂量100 mg | 不推荐启用;如果肾脏耐受和心血管获益,可以使用100 mg/d至透析 | ||||
| 达格列净 | 10 mg/db | eGFR<25 ml·min-1·(1.73 m2)-1不推荐启用;如果肾脏耐受和心血管获益可以使用至透析 | ||||
| 恩格列净 | 10 mg/dc | eGFR<20 ml·min-1·(1.73 m2)-1不推荐启用;如果肾脏耐受和心血管获益可以使用至透析 | ||||
| 艾格列净 | eGFR<45 ml·min-1·(1.73 m2)-1不推荐使用 | |||||
| GLP-1RAd | ||||||
| 艾塞那肽 | 谨慎启用或增加剂量;避免1次/周的制剂 | 不推荐使用 | ||||
| 度拉糖肽 | 不需要调整剂量 | |||||
| 利拉鲁肽 | 不需要调整剂量 | |||||
| 利西那肽 | 不需要调整剂量 | 不推荐使用 | ||||
| 司美格鲁肽 | 不需要调整剂量 | |||||
| DPP-4i | ||||||
| 阿格列汀 | 最大日剂量12.5 mg | 最大日剂量6.25 mg | ||||
| 利格列汀 | 不需要调整剂量 | |||||
| 沙格列汀 | 最大日剂量2.5 mg | |||||
| 西格列汀 | 最大日剂量50 mg | 最大日剂量25 mg | ||||
| 磺脲类(二代) | ||||||
| 格列美脲 | 起始剂量为1 mg/d,缓慢加量,避免低血糖 | |||||
| 格列吡嗪 | 起始剂量为2.5 mg/d,缓慢加量,避免低血糖 | |||||
| 格列苯脲 | 不推荐使用 | |||||
| 噻唑烷二酮 | ||||||
| 吡格列酮 | 不需要调整剂量 | |||||
| α-糖苷酶抑制剂 | ||||||
| 阿卡波糖 | 不需要调整剂量 | 不推荐使用 | ||||
| 米格列醇 | 不需要调整剂量 | 不推荐使用 | ||||
注:a表示随着eGFR水平下降,SGLT2i的降糖效果也会减弱,但对肾脏和心血管仍有益;b表示达格列净在eGFR 25~45 ml·min-1·(1.73 m2)-1时推荐剂量为10 mg/d;c表示恩格列净作为降糖药物时,在eGFR<30 ml·min-1·(1.73 m2)-1时不推荐启用,而作为心力衰竭治疗药物时,eGFR<20 ml·min-1·(1.73 m2)-1时不推荐启用;d表示度拉糖肽、利拉鲁肽和司美格鲁肽证实有显著的心血管保护作用
共识声明:二甲双胍推荐用于eGFR≥30 ml·min-1·(1.73 m2)-1的T2DM合并CKD患者,对于eGFR 30~44 ml·min-1·(1.73 m2)-1的患者和eGFR 45~59 ml·min-1·(1.73 m2)-1伴乳酸酸中毒风险高的部分患者二甲双胍使用剂量应减少至1 000 mg/d。
共识声明:对于eGFR≥20 ml·min-1·(1.73 m2)-1的T2DM合并CKD患者,建议使用经证实对肾脏或心血管有益的SGLT2i;一旦启动,SGLT2i可以在较低水平的eGFR下继续使用。
共识声明:对于使用二甲双胍和/或SGLT2i治疗未达到个体化血糖目标或无法服用这些药物的T2DM合并CKD患者,推荐使用经证实对心血管有益的GLP-1RA。
同时,本共识还特别提到了晚期CKD患者的血糖管理。共识指出,对于T1DM患者,胰岛素仍是唯一治疗方法,晚期CKD患者需要减少胰岛素剂量;对于T2DM患者,晚期CKD是低血糖的危险因素[19],应首选不增加低血糖风险的降糖药物。二甲双胍以原型随尿排出,肾功能不全时会使其排出减少而增加乳酸酸中毒的风险,故eGFR<30 ml·min-1·(1.73 m2)-1和透析的T2DM患者应禁用二甲双胍;重度肾功能不全时阿卡波糖、米格列醇等药物可引起蓄积,CKD4期和CKD5期患者不推荐使用。若患者肾脏耐受和有心血管获益,SGLT2i(除外艾格列净)可在eGFR 20~29 ml·min-1·(1.73 m2)-1的患者中启用或持续使用至透析。由于GLP-1RA可减少ASCVD事件和蛋白尿,可根据患者个体化血糖和eGFR水平选择使用(表5)。若不能耐受或使用GLP-1RA的eGFR<30 ml·min-1·(1.73 m2)-1和透析患者,可选择二肽基肽酶4抑制剂(DPP-4i)替代治疗。噻唑烷二酮类药物也可用于晚期CKD患者改善胰岛素抵抗。若上述推荐的药物患者不能使用、耐受或效果不佳时,通常需要考虑使用胰岛素或短效磺胺类药物。
最后,共识还提到了肾移植患者的血糖管理。对于肾移植的T2DM患者,可根据eGFR水平选择使用二甲双胍,SGLT2i因具有降低肾小球内压力而改善肾移植患者结局的效果也被推荐使用,但需要关注感染风险(如生殖器真菌感染、尿路感染等)。
本共识介绍的肾素-血管紧张素-醛固酮系统抑制剂包括ACEi或ARB在内的RAS抑制剂和ns-MRAs,并阐述了该类药物在糖尿病合并CKD患者中的应用建议。
共识与其他指南建议一致,继续强调了RAS抑制剂,即ACEi或ARB是伴有高血压和蛋白尿(ACR≥300 mg/g)的糖尿病患者首选的一线治疗药物。值得注意的是,本共识特别强调了ns-MRA在糖尿病合并CKD患者的应用。ns-MRA常用药物包括艾沙利酮和非奈利酮,其中艾沙利酮对血钾影响有限,而非奈利酮已被证明可显著降低主要肾脏复合终点风险和次要心血管事件复合终点风险,现为世界唯一一种被批准用于减缓CKD进展和减少心血管事件的ns-MRA[20]。
2022年《KDIGO临床实践指南:慢性肾脏病患者的糖尿病管理》基于证据新增了ns-MRA非奈利酮的使用建议[8],推荐其用于T2DM合并CKD患者治疗;2022年ADA糖尿病管理系列指南的两度更新中均推荐非奈利酮用于T2DM合并CKD患者的治疗(A级),以改善心血管预后以及降低CKD进展的风险[7]。非奈利酮因明确的心肾获益,被推荐用于T2DM合并CKD患者,这一建议被纳入了该共识,并形成声明。
共识声明:对于血钾正常、eGFR≥25 ml·min-1·(1.73 m2)-1、使用RAS抑制剂最大耐受剂量后仍有蛋白尿(ACR ≥30 mg/g)的T2DM患者,建议使用经证实对肾脏和心血管有益的ns-MRA。
2022年ADA的糖尿病医疗护理和2022年KDIGO在CKD筛查和诊断、血糖监测、生活方式、治疗目标和药物管理等问题上保持一致。两者均建议在健康生活方式基础上包括药物治疗在内的综合管理可以改善临床肾脏和心血管结局。ADA和KDIGO建议以及现在的联合共识声明为糖尿病合并CKD患者干预措施的应用和优先次序提供了明确的指导。
姚慧娟,杨宇,徐阿晶. 2022版《ADA/KDIGO共识报告:慢性肾脏病患者的糖尿病管理》要点解读[J].中国全科医学,2023,26(12):1415-1421. [www.chinagp.net]
YAO H J,YANG Y,XU A J. Interpretation of Diabetes Management in Chronic Kidney Disease:a Consensus Report by the American Diabetes Association(ADA) and Kidney Disease:Improving Global Outcomes (KDIGO)[J]. Chinese General Practice,2023,26(12):1415-1421.
本文无利益冲突。



























