
代谢相关脂肪性肝病(MAFLD)是一组代谢应激相关的肝脏疾病,有研究表明血钾水平与MAFLD密切相关,但针对痛风患者二者的关系尚不清楚。
探讨痛风患者血钾水平与MAFLD的关系,旨在为痛风患者血钾水平的管理提供理论依据。
选取2014年4月至2017年3月于天津医科大学朱宪彝纪念医院住院的原发性痛风患者347例作为研究对象。根据脂肪肝严重程度分为单纯痛风组(n=96)、轻度脂肪肝组(n=136)及中重度脂肪肝组(n=115)。比较不同脂肪肝严重程度组一般资料、血清生化指标及超重/肥胖、胰岛素抵抗指标,采用Spearman秩相关分析探讨血钾水平与脂肪肝严重程度的关系,采用多因素Logistic回归分析探讨痛风患者MAFLD发生发展的影响因素。
痛风患者MAFLD患病率为72.3%(251/347)。Spearman秩相关分析结果显示血钾水平与脂肪肝严重程度、空腹血糖(FBG)、三酰甘油(TG)、体质指数(BMI)、腰臀比(WHR)及胰岛素抵抗指数(HOMA-IR)呈负相关(rs=-0.172、-0.118、-0.182、-0.222、-0.174、-0.197,P<0.05)。趋势χ2检验结果显示脂肪肝严重程度随着血钾水平的增加呈下降趋势(χ2趋势=15.784,P=0.015)。多因素Logistic回归分析结果显示,高龄〔OR=0.97,95%CI(0.95,0.999)〕、高钾〔OR=0.53,95%CI(0.29,0.97)〕是超重/肥胖痛风患者MAFLD发生发展的保护因素(P<0.05),高TG〔OR=1.16,95%CI(1.01,1.34)〕、高WHR〔OR=1.09,95%CI(1.04,1.13)〕是超重/肥胖痛风患者MAFLD发生发展的危险因素(P<0.05);高FBG〔OR=1.92,95%CI(1.12,3.31)〕是体质量正常痛风患者MAFLD发生发展的危险因素(P<0.05)。
对于超重/肥胖的痛风患者,维持血钾在参考范围偏高水平可能有助于预防MAFLD的发生、发展。

本刊2023年版权归中国全科医学杂志社所有
未经编辑部许可,不得任意转载和摘编
本刊所发表作品仅为作者观点,并不代表编委会和编辑部意见
如有印装质量问题请向本刊发行部调换
代谢相关脂肪性肝病(MAFLD)包括非酒精性脂肪肝与非酒精性脂肪性肝炎,其病理特征包括肝脏脂肪变性、肝细胞损伤及炎性反应等。MAFLD是代谢综合征的肝脏表现,与肥胖、高血压、糖尿病、高脂血症、高尿酸血症等多种代谢性疾病密切相关[1,2,3],其最常见的死因为心血管疾病事件。目前MAFLD已成为我国常见的慢性肝病[4],但仍缺乏特效治疗药物。最新研究证实血尿酸(SUA)水平与MAFLD呈正相关,SUA水平升高可作为MAFLD的独立预测因子[5],但具体机制尚不清楚。钾离子作为人体细胞内主要阳离子,对于维持正常的细胞功能和代谢平衡至关重要。既往多项研究发现在我国老年人群及新诊断2型糖尿病患者中血钾水平与MAFLD密切相关[6,7]。但关于痛风患者血钾水平与MAFLD的相关研究尚不足。本文通过病例对照研究初步探讨痛风患者血钾水平与MAFLD的相关性,旨在为痛风患者血钾水平的管理提供理论依据。
采用回顾性分析方法,选取2014年4月至2017年3月于天津医科大学朱宪彝纪念医院痛风科住院的痛风患者为研究对象。纳入标准:(1)年龄≥18岁;(2)符合原发性痛风诊断标准[8,9];(3)估算肾小球滤过率(eGFR)≥60 ml·min-1·(1.73 m2)-1。排除标准:(1)导致肝脏脂肪变性的非代谢相关因素,如酒精性肝病(饮酒折合乙醇量,男性>140 g/周,女性>70 g/周)、慢性乙型病毒性肝炎、慢性丙型病毒性肝炎、自身免疫性肝病、遗传代谢性肝病、药物性肝病等;(2)存在影响血钾水平的因素,如合并急慢性肾功能不全、原发性醛固酮增多症(PA)、库欣综合征、神经性厌食以及近期正在应用利尿剂、大量输血、急慢性腹泻、急性胃炎等情况;(3)严重肝功能衰竭、急性心脑血管疾病及恶性肿瘤。最终纳入347例患者,其中男342例,女5例,平均年龄(47.4±12.8)岁。研究对象均知情同意,本研究通过天津医科大学朱宪彝纪念医院医学伦理委员会批准(审批号:ZXYJNYYsMEC2022-2)。
收集患者年龄、性别、痛风病程、2型糖尿病史、原发性高血压病史、身高、体质量、腰围、臀围,并计算体质指数(BMI)、腰臀比(WHR);BMI≥24 kg/m2为超重/肥胖者,BMI<24 kg/m2为体质量正常者。用台式血压计连续测量3次右上肢血压,取平均值作为收缩压(SBP)和舒张压(DBP)指标。
嘱患者正常饮食3 d,禁食、禁水10~14 h后于次日清晨抽取肘静脉血。采用日立7070全自动生化分析仪检测丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、谷氨酰基转移酶(GGT)、总胆红素(TBiL)、直接胆红素(DBiL)、白蛋白(ALB)、球蛋白(GLB)、空腹血糖(FBG)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、SUA及血钾、血钠水平;采用日本TOSOH公司的HLC-723G7全自动糖化血红蛋白分析仪检测糖化血红蛋白(HbA1c);电化学发光法测定血清胰岛素水平。运用稳态模型评估胰岛素抵抗程度:胰岛素抵抗指数(HOMA-IR)=FBG(mmol/L)×空腹胰岛素水平(mU/L)/22.5。
患者空腹8 h以上,平卧位,右臂上举外展,由经验丰富的超声科医生采用美国LOGl7彩色超声诊断仪对患者进行腹部超声检查。参照中华医学会肝病学分会发布的《非酒精性脂肪性肝病诊疗指南(2010年修订版)》[10],具备以下2项者诊断为MAFLD:(1)肝脏近场回声弥漫性增强("明亮肝"),回声强于肾脏;(2)肝内管道结构显示不清;(3)肝脏远场回声逐渐衰减。并对脂肪肝严重程度进行判定,判定依据如下,(1)轻度脂肪肝:肝脏无增大,肝内回声增强,致密细腻,分布均匀,血管尚清,远场无衰减;(2)中重度脂肪肝:肝脏体积增大,肝内回声增强,致密细腻,部分光点稍增粗,血管模糊,似云雾状遮盖,远场明显衰减[11]。
根据脂肪肝严重程度将患者分为单纯痛风组(n=96)(无脂肪肝)、轻度脂肪肝组(n=136)、中重度脂肪肝组(n=115)。根据血钾水平四分位数将患者分为:Q1者(88例,血钾≤3.99 mmol/L)、Q2者(83例,血钾4.00~4.19 mmol/L)、Q3者(77例,血钾4.20~4.39 mmol/L)、Q4者(99例,血钾≥4.40 mmol/L)。
应用SPSS 26.0软件进行统计分析。符合正态分布的计量资料以( ±s)表示,多组间比较采用单因素方差分析,LSD-t检验进行组间两两比较。不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U秩和检验。计数资料以相对数表示,组间比较采用χ2检验或趋势性χ2检验。采用Spearman秩相关分析探讨血钾水平与脂肪肝严重程度的关系。采用多因素有序Logistic回归分析探讨MAFLD发生发展的影响因素。以P<0.05为差异有统计学意义。
±s)表示,多组间比较采用单因素方差分析,LSD-t检验进行组间两两比较。不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U秩和检验。计数资料以相对数表示,组间比较采用χ2检验或趋势性χ2检验。采用Spearman秩相关分析探讨血钾水平与脂肪肝严重程度的关系。采用多因素有序Logistic回归分析探讨MAFLD发生发展的影响因素。以P<0.05为差异有统计学意义。
3组患者年龄、2型糖尿病史比例、超重/肥胖比例、WHR比较,差异有统计学意义(P<0.05)。3组患者性别、痛风病程、原发性高血压病史比例及SBP、DBP比较,差异无统计学意义(P>0.05),见表1。
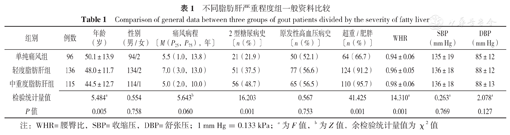
不同脂肪肝严重程度组一般资料比较
Comparison of general data between three groups of gout patients divided by the severity of fatty liver
不同脂肪肝严重程度组一般资料比较
Comparison of general data between three groups of gout patients divided by the severity of fatty liver
| 组别 | 例数 | 年龄(岁) | 性别(男/女) | 痛风病程〔M(P25,P75),年〕 | 2型糖尿病史〔n(%)〕 | 原发性高血压病史〔n(%)〕 | 超重/肥胖〔n(%)〕 | WHR | SBP(mm Hg) | DBP(mm Hg) |
|---|---|---|---|---|---|---|---|---|---|---|
| 单纯痛风组 | 96 | 50.1±13.9 | 94/2 | 5.5(1.0,13.8) | 21(21.9) | 50(52.1) | 64(66.7) | 0.94±0.06 | 135±19 | 85±12 |
| 轻度脂肪肝组 | 136 | 48.0±11.7 | 134/2 | 7.0(3.0,13.0) | 51(37.5) | 77(56.6) | 124(91.2) | 0.96±0.05 | 136±18 | 88±12 |
| 中重度脂肪肝组 | 115 | 44.5±12.7 | 114/1 | 5.0(2.0,10.0) | 56(48.7) | 65(56.5) | 110(95.7) | 0.98±0.06 | 136±18 | 88±13 |
| 检验统计量值 | 5.484a | 0.554 | 5.643b | 16.203 | 0.567 | 41.425 | 14.310a | 0.263a | 2.078a | |
| P值 | 0.005 | 0.758 | 0.060 | 0.001 | 0.753 | 0.001 | 0.001 | 0.769 | 0.127 |
注:WHR=腰臀比,SBP=收缩压,DBP=舒张压;1 mm Hg=0.133 kPa;a为F值,b为Z值,余检验统计量值为χ2值
3组患者ALT、AST、ALP、GGT、DBiL、FBG、TG、血钾、BMI、HOMA-IR比较,差异有统计学意义(P<0.05)。中重度脂肪肝组ALT、AST、GGT、FBG、TG、BMI、HOMA-IR高于单纯痛风组,而ALP、血钾低于单纯痛风组,差异有统计学意义(P<0.05);中重度脂肪肝组ALT、AST、DBiL、BMI、HOMA-IR高于轻度脂肪肝组,而ALP、血钾低于轻度脂肪肝组,差异有统计学意义(P<0.05);轻度脂肪肝组FBG、TG、BMI、HOMA-IR高于单纯痛风组,差异有统计学意义(P<0.05);3组TBiL、ALB、GLB、HbA1c、TC、HDL-C、LDL-C、SUA、血钠比较,差异无统计学意义(P>0.05),见表2。
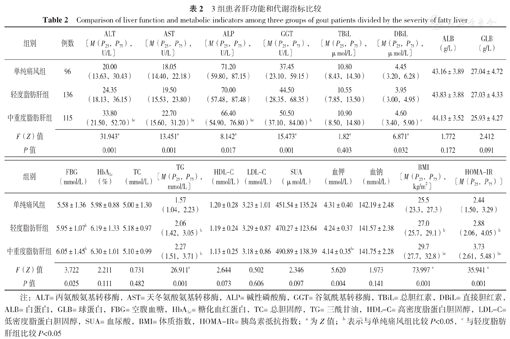
3组患者肝功能和代谢指标比较
Comparison of liver function and metabolic indicators among three groups of gout patients divided by the severity of fatty liver
3组患者肝功能和代谢指标比较
Comparison of liver function and metabolic indicators among three groups of gout patients divided by the severity of fatty liver
| 组别 | 例数 | ALT〔M(P25,P75),U/L〕 | AST〔M(P25,P75),U/L〕 | ALP〔M(P25,P75),U/L〕 | GGT〔M(P25,P75),U/L〕 | TBiL〔M(P25,P75),μmol/L〕 | DBiL〔M(P25,P75),μmol/L〕 | ALB(g/L) | GLB(g/L) |
|---|---|---|---|---|---|---|---|---|---|
| 单纯痛风组 | 96 | 20.00(13.63,30.43) | 18.05(14.40,22.18) | 71.20(59.80,87.15) | 37.45(23.10,59.15) | 10.80(8.43,14.30) | 4.45(3.20,6.28) | 43.16±3.89 | 27.04±4.72 |
| 轻度脂肪肝组 | 136 | 24.35(18.13,36.15) | 19.50(15.53,23.80) | 70.00(57.48,87.48) | 44.50(28.35,68.35) | 10.55(7.85,13.50) | 3.95(3.00,4.95) | 43.83±3.88 | 27.03±4.33 |
| 中重度脂肪肝组 | 115 | 33.80(21.50,52.70)bc | 22.70(15.60,31.20)bc | 66.40(54.90,76.80)bc | 50.50(37.10,84.00)b | 10.90(8.50,14.80) | 4.60(3.40,5.90)c | 44.13±3.52 | 25.93±4.27 |
| F(Z)值 | 31.943a | 13.451a | 8.142a | 15.473a | 1.82a | 6.871a | 1.772 | 2.412 | |
| P值 | 0.001 | 0.001 | 0.017 | 0.001 | 0.403 | 0.032 | 0.172 | 0.091 |
| 组别 | FBG(mmol/L) | HbA1c(%) | TC(mmol/L) | TG〔M(P25,P75),mmol/L〕 | HDL-C(mmol/L) | LDL-C(mmol/L) | SUA(μmol/L) | 血钾(mmol/L) | 血钠(mmol/L) | BMI〔M(P25,P75),kg/m2〕 | HOMA-IR〔M(P25,P75)〕 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 单纯痛风组 | 5.58±1.36 | 5.98±0.88 | 5.00±1.30 | 1.57(1.04,2.23) | 1.20±0.28 | 3.23±1.01 | 451.54±135.24 | 4.31±0.40 | 142.19±2.48 | 25.5(23.3,27.3) | 2.44(1.50,3.29) |
| 轻度脂肪肝组 | 5.95±1.07b | 6.19±1.33 | 5.18±0.97 | 2.06(1.42,3.05)b | 1.19±0.24 | 3.29±0.87 | 470.27±123.64 | 4.24±0.37 | 141.57±2.38 | 27.0(25.7,29.1)b | 2.88(2.06,4.05)b |
| 中重度脂肪肝组 | 6.05±1.45b | 6.30±1.01 | 5.10±0.99 | 2.27(1.51,3.71)b | 1.13±0.25 | 3.18±0.86 | 490.89±138.39 | 4.14±0.35bc | 141.75±2.28 | 29.7(27.7,32.8)bc | 3.73(2.61,5.48)bc |
| F(Z)值 | 3.722 | 2.211 | 0.731 | 26.911a | 2.644 | 0.502 | 2.346 | 5.620 | 1.973 | 73.997a | 35.941a |
| P值 | 0.025 | 0.111 | 0.482 | 0.001 | 0.073 | 0.606 | 0.097 | 0.004 | 0.141 | 0.001 | 0.001 |
注:ALT=丙氨酸氨基转移酶,AST=天冬氨酸氨基转移酶,ALP=碱性磷酸酶,GGT=谷氨酰基转移酶,TBiL=总胆红素,DBiL=直接胆红素,ALB=白蛋白,GLB=球蛋白,FBG=空腹血糖,HbA1c=糖化血红蛋白,TC=总胆固醇,TG=三酰甘油,HDL-C=高密度脂蛋白胆固醇,LDL-C=低密度脂蛋白胆固醇,SUA=血尿酸,BMI=体质指数,HOMA-IR=胰岛素抵抗指数;a为Z值;b表示与单纯痛风组比较P<0.05,c与轻度脂肪肝组比较P<0.05
Spearman秩相关分析结果显示,血钾水平与脂肪肝严重程度、FBG、TG、BMI、WHR、HOMA-IR呈负相关(rs=-0.172,-0.118,-0.182,-0.222,-0.174,-0.197,P<0.05);而与年龄、DBiL无相关性(rs=0.083,-0.028,P>0.05)。
痛风患者MAFLD患病率为72.3%(251/347)。痛风Q1者MAFLD患病率为80.7%(71/88)、痛风Q2者MAFLD患病率为78.3%(65/83)、痛风Q3者MAFLD患病率为59.8%(46/77)和痛风Q4者MAFLD患病率为69.7%(69/99)。趋势χ2检验结果显示,血钾水平与痛风患者脂肪肝严重程度存在线性关系,痛风患者脂肪肝严重程度随着血钾水平升高而降低(χ2趋势=15.784,P=0.015),见表3。
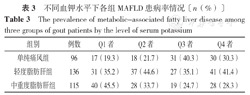
不同血钾水平下各组MAFLD患病率情况〔n(%)〕
The prevalence of metabolic-associated fatty liver disease among three groups of gout patients by the level of serum potassium
不同血钾水平下各组MAFLD患病率情况〔n(%)〕
The prevalence of metabolic-associated fatty liver disease among three groups of gout patients by the level of serum potassium
| 组别 | 例数 | Q1者 | Q2者 | Q3者 | Q4者 |
|---|---|---|---|---|---|
| 单纯痛风组 | 96 | 17(19.3) | 18(21.7) | 31(40.3) | 30(30.3) |
| 轻度脂肪肝组 | 136 | 31(35.2) | 37(44.6) | 27(35.1) | 41(41.4) |
| 中重度脂肪肝组 | 115 | 40(45.5) | 28(33.7) | 19(24.7) | 28(28.3) |
根据BMI将患者分为超重/肥胖者(BMI≥24 kg/m2)和体质量正常者(BMI<24 kg/m2)。以MAFLD严重程度(赋值:单纯痛风=0,轻度脂肪肝=1,中重度脂肪肝=2)为因变量,以可能对临床有意义的因素血钾、HOMA-IR、WHR(赋值:实测值×100)、FBG、TG、年龄(赋值为实测值)为自变量进行有序多因素Logistic回归分析,结果显示,高龄、高钾是超重/肥胖痛风患者MAFLD发生发展的保护因素(P<0.05),高TG、高WHR是超重/肥胖痛风患者MAFLD发生发展的危险因素(P<0.05);高FBG是体质量正常痛风患者MAFLD发生发展的危险因素(P<0.05),见表4。
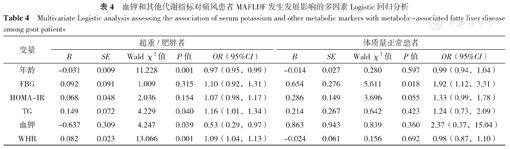
血钾和其他代谢指标对痛风患者MAFLDF发生发展影响的多因素Logistic回归分析
Multivariate Logistic analysis assessing the association of serum potassium and other metabolic markers with metabolic-associated fatty liver disease among gout patients
血钾和其他代谢指标对痛风患者MAFLDF发生发展影响的多因素Logistic回归分析
Multivariate Logistic analysis assessing the association of serum potassium and other metabolic markers with metabolic-associated fatty liver disease among gout patients
| 变量 | 超重/肥胖者 | 体质量正常患者 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| B | SE | Wald χ2值 | P值 | OR(95%CI) | B | SE | Wald χ2值 | P值 | OR(95%CI) | |
| 年龄 | -0.031 | 0.009 | 11.228 | 0.001 | 0.97(0.95,0.99) | -0.014 | 0.027 | 0.280 | 0.597 | 0.99(0.94,1.04) |
| FBG | 0.092 | 0.091 | 1.009 | 0.315 | 1.10(0.92,1.31) | 0.654 | 0.276 | 5.611 | 0.018 | 1.92(1.12,3.31) |
| HOMA-IR | 0.068 | 0.048 | 2.036 | 0.154 | 1.07(0.98,1.17) | 0.286 | 0.149 | 3.696 | 0.055 | 1.33(0.99,1.78) |
| TG | 0.149 | 0.072 | 4.229 | 0.040 | 1.16(1.01,1.34) | 0.214 | 0.267 | 0.642 | 0.423 | 1.24(0.73,2.09) |
| 血钾 | -0.637 | 0.309 | 4.247 | 0.039 | 0.53(0.29,0.97) | 0.863 | 0.943 | 0.839 | 0.360 | 2.37(0.37,15.04) |
| WHR | 0.082 | 0.023 | 13.066 | 0.001 | 1.09(1.04,1.13) | -0.024 | 0.061 | 0.156 | 0.692 | 0.98(0.87,1.10) |
MAFLD是一种与胰岛素抵抗、脂蛋白代谢紊乱以及遗传易感性等密切相关的代谢应激性肝病。MAFLD影响全球约25%的成年人,已成为全球重要的公共卫生问题之一,也是我国重要的肝病问题[1,12]。本研究通过分析发现,痛风患者MAFLD患病率为72.3%,且趋于年轻化。既往研究发现高尿酸血症可促进MAFLD的发生发展,同时MAFLD也会增加高尿酸血症的发生风险,并且增加痛风患者发生心血管疾病的风险[13,14]。但是,目前痛风患者MAFLD高发病率尚未得到重视,且临床上缺乏治疗MAFLD的特效药物。
肥胖人群和非肥胖人群发生MAFLD的机制不同,但均会发展为脂肪性肝炎和肝纤维化。非肥胖人群遗传易感性(如PNPLA3多态性等)似乎在MAFLD的发展中更重要[15]。肥胖人群中胰岛素抵抗是MAFLD的始动因素[16,17],其参与肝脏脂肪变性、非酒精性脂肪性肝炎以及肝纤维化的进展,这一过程涉及多种机制,包括遗传因素、肝脏脂肪沉积、能量代谢以及来自包括免疫细胞在内的各种细胞炎症信号传导等。目前多项研究证实肥胖与MAFLD密切相关,BMI、WHR对MAFLD具有较高的预测价值[2,18],本研究结果与之一致。既往已有多项研究证实,钾缺乏可导致胰岛素抵抗,纠正低钾血症可改善胰岛素敏感性[19,20]。最近研究发现,PA患者较非PA者更容易合并MAFLD,与不伴低钾血症的PA患者相比,伴低钾血症的PA患者MAFLD的患病率(27%与44%,P<0.05)更高,同时伴有更糟糕的代谢状态,包括更严重的胰岛素抵抗,较高的BMI、血脂异常、较高的SUA水平以及慢性炎性状态[21]。螺内酯联合维生素E治疗可以有效缓解PA合并MAFLD患者的胰岛素抵抗[22]。本研究显示,与单纯痛风组相比,轻度、中重度脂肪肝组的HOMA-IR更高,且随着病情进展而加重,与相关研究[23]结论一致。
钾是细胞内的一种阳离子电解质,是正常细胞功能所必需的。ELFASSY等[24]发现在美国出生和在美国居住时间较长的人群中,钾摄入量与较低的BMI和较小的腰围有关。另外,有研究认为全人群及男性人群膳食钾摄入量较高是MAFLD发病的保护因素[25]。目前已有研究表明血钾水平与MAFLD之间存在相关性[6,7]。本研究发现痛风患者血钾水平与脂肪肝严重程度、BMI、WHR、FBG、TG、HOMA-IR这些代谢指标呈负相关,对于超重/肥胖的痛风患者,维持血钾在参考范围偏高水平对预防MAFLD起到保护作用;而对于体质量正常的痛风患者这种作用却不存在,可能由于这两部分人群发生MAFLD的机制不同。因此,本研究认为对于超重/肥胖的痛风患者,维持血钾在参考范围偏高水平可能有助于预防MAFLD的发生。
血钾水平影响MAFLD的具体机制尚不明确,推测存在以下几种可能:(1)视黄醇结合蛋白(RBP4)目前被认为是一种新的人类脂肪因子,有研究表明补充钾会抑制RBP4的合成,从而预防盐相关性胰岛素抵抗[19],改善MAFLD。(2)盐皮质激素受体拮抗剂(MRA)为保钾型利尿剂,近期有研究证实盐皮质激素受体(MR)的激活在肝纤维化形成中起重要作用,用依普利酮阻断特异性MR具有抗肝脂肪变性和抗肝纤维化作用[26]。另外一项研究认为螺内酯治疗可通过抑制组织TG和尿酸积累来逆转多囊卵巢综合征相关的肝-卵巢组织损伤,有益于预防MAFLD的发生[27]。(3)已有研究认为地中海饮食可改善MAFLD进展[28],考虑与其富含水果和蔬菜有关,这种膳食结构除含有丰富的维生素外,同样具有较高的钾含量。而近年来,随着我国年轻人饮食模式的改变,缺乏水果、蔬菜的摄入,故年轻人发生MAFLD的风险更高。(4)机体长期处于慢性低钾状态时,患者常存在疲乏、肌肉无力、运动能力或耐力低下等情况,可直接影响生活方式和体质量增长,增加MAFLD发生风险。
我国居民膳食钾摄入量显著低于建议膳食目标。一项关于2000—2015年我国成年居民膳食钠、钾的摄入量变化趋势的Meta分析结果显示,我国成年居民钾的摄入量普遍偏低,仅达到WHO推荐摄入量的1/2左右,近年虽然略有增加,但变化较小,仍处于偏低水平[29]。2015年天津市成年居民膳食钾实际摄入量仅为(1 560.7±696.8)mg/d[30]。上述营养调查数据显示我国人群普遍缺钾,但目前国内基于痛风患者钾摄入量的研究尚不足。结合本研究结果及目前人群普遍钾摄入不足的现状,建议超重/肥胖的痛风患者,在保证安全的前提下适当补钾,使血钾维持在正常较高水平以预防MAFLD的发生。
本研究存在以下不足:(1)尽管超声作为诊断脂肪肝的一种无创、经济有效的筛查方法,在临床工作中被广泛接受,但肝活检仍是诊断的"金标准"。(2)PA在高血压患者中发病率较高,且大部分未被识别,而本研究主要依据病史和临床表现排除PA,未进行实验室验证,不排除存在一定比例的PA患者,干扰研究结果。(3)本研究纳入人群均为住院患者,大部分处于痛风性关节炎急性发作期,关节炎疼痛对食欲存在不同程度的影响,可能影响钾的摄入量。
综上所述,本研究发现痛风患者MAFLD发病率较高,随着血钾水平的升高,痛风患者MAFLD的患病率及中重度脂肪肝占比呈下降趋势,进一步分析发现对于超重/肥胖的痛风患者,血钾水平增加可降低MAFLD的发生风险。通过上述结论推测对超重/肥胖的痛风患者,维持血钾在参考范围偏高水平可能有助于预防MAFLD的发生发展。未来可行临床对照研究,探讨补钾治疗对MAFLD的严重程度及相关代谢指标的影响。
王俊伟,林令君,宋林凌,等.痛风患者血钾水平与代谢相关脂肪性肝病的相关性研究[J].中国全科医学,2023,26(12):1479-1484.[www.chinagp.net]
WANG J W,LIN L J,SONG L L,et al. Association between serum potassium and metabolic-associated fatty liver disease in patients with primary gout[J]. Chinese General Practice,2023,26(12):1479-1484.
本文无利益冲突。



























