
目前全球有多种治疗糖尿病的药物,但仍有很多糖尿病患者未能达到推荐的目标血糖水平,研发和应用新型降糖药迫在眉睫。2022年5月,美国食品药品监督管理局(FDA)批准葡萄糖依赖性促胰岛素多肽(GIP)和胰高糖素样肽-1(GLP-1)双重受体激动剂替西帕肽上市,辅助饮食和运动,每周注射1次以改善成人2型糖尿病患者的血糖控制。多项临床研究已验证其用于2型糖尿病的有效性和安全性,同时该药在肥胖症、心血管风险相关疾病、非酒精性脂肪性肝炎等疾病治疗方面也具有潜在的应用价值。本文通过对替西帕肽的作用机制、有效性和安全性进行综述,为其在我国上市后的临床应用提供参考。

本刊2023年版权归中国全科医学杂志社所有
未经编辑部许可,不得任意转载和摘编
本刊所发表作品仅为作者观点,并不代表编委会和编辑部意见
如有印装质量问题请向本刊发行部调换
2021年最新糖尿病流行病学数据显示,全球糖尿病患者高达5.37亿,中国患者约1.41亿,全球卫生支出的9%用于糖尿病,总额达9 660亿美元[1]。目前全球有多种糖尿病治疗药物,但仍有很多患者未能达到推荐的目标血糖水平,研发和应用新型降糖药物迫在眉睫[2]。2022-05-13,美国食品药品监督管理局(FDA)批准葡萄糖依赖性促胰岛素多肽(glucose-dependent insulinotropic polypeptide,GIP)和胰高糖素样肽-1(glucagon-like peptide-1,GLP-1)双重受体激动剂替西帕肽(tirzepatide)上市,辅助饮食和运动,每周注射1次以改善成人2型糖尿病(type 2 diabetes mellitus,T2DM)患者的血糖。该药在我国针对T2DM、肥胖症及心力衰竭等的5项Ⅲ期临床研究也正在推进中。
新型降糖药物的应用为糖尿病治疗带来获益的同时也带来了一定风险[3]。多项临床研究已验证替西帕肽用于T2DM的有效性和安全性,同时在肥胖症、心血管风险相关疾病、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)等疾病治疗方面也具有潜在的应用价值[4]。本文主要对替西帕肽的作用机制、有效性和安全性进行综述,为其在我国上市后的临床应用提供参考。
本文文献检索策略:计算机检索PubMed、Web of Science、中国知网(CNKI)、万方数据知识服务平台(Wanfang Data)等数据库,并手工补充检索纳入文献的参考文献。检索时间为建库至2022年6月,中文检索词包括"替西帕肽",英文检索词包括"tirzepatide""LY3298176"。文献纳入标准:替西帕肽的临床研究、基础研究和文献研究。文献排除标准:重复发表的文献,无法获取全文和数据的文献,年份陈旧、质量较差的文献等。
替西帕肽是一种单分子的多肽制剂,可激活人体GIP和GLP-1两种天然肠促胰素的受体。分子式为C225H348N48O68,分子量为4 813.45,是基于天然GIP序列的39个氨基酸组成的线性合成肽,与人GIP(1-42)共有19个氨基酸。替西帕肽包含了生物活性的N-末端GIP序列和艾塞那肽样C-末端序列[5],同时可结合类似司美格鲁肽边链的脂肪酸启动白蛋白结合并延长t1/2至116.7 h(约5 d),允许每周给药1次[6]。其药物结构可参考图1[7]。
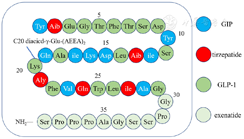

注:不同的颜色表示每个残基的来源;GIP=葡萄糖依赖性促胰岛素多肽,tirzepatide=替西帕肽,GLP-1=胰高糖素样肽-1,exenatide=艾塞那肽
替西帕肽改善T2DM患者血糖和控制体质量的作用机制尚未完全阐明[9]。GIP受体和GLP-1受体是调节糖脂和氨基酸代谢的B1类G蛋白偶联受体,两者均存在于胰腺β细胞中[10],这两种受体的激活导致环磷酸腺苷(cAMP)和葡萄糖依赖的胰岛素分泌增加[11],成为T2DM和肥胖症的治疗靶标[12]。GLP-1可以调整胰岛素分泌,控制血糖,同时延迟胃排空,抑制食欲[13,14];GIP的确切作用尚不明确,研究认为GIP可以双向调控胰岛素分泌,直接作用于皮下白色脂肪组织,改善胰岛素敏感性和脂肪缓冲能力,改善血液流动和储存能力;也可以抑制胃酸分泌、延缓胃动力,对保护胰岛、调整胰岛素分泌有一定的作用[15]。一项Ⅱ期临床试验证实替西帕肽可以显著改善血糖和控制体质量,且不增加胃肠道不良反应,提示替西帕肽在增强GLP-1受体激动剂活性之外,还有其他活性带来的获益,也表明GIP受体激动剂对双重受体激动剂的效果有显著贡献[16]。基于临床前研究结果,也有人提出GIP作为止吐剂,从而提高GLP-1受体激动剂的耐受性[17]。
THOMAS等[18]研究发现与度拉糖肽相比,替西帕肽在更大程度上改善了胰岛素抵抗和胰岛β细胞功能,替西帕肽的作用仅部分归因于体质量减轻,表明双重受体激动剂赋予了不同的血糖控制机制。TIM等[19]利用钳夹试验探索替西帕肽的作用机制,认为替西帕肽的降糖作用是通过改善β细胞功能的多个方面来实现的,包括改善胰岛素敏感性、胰岛素分泌第一/第二时相和胰岛β细胞的葡萄糖敏感性,从而显著降低空腹和餐后血糖。GIP可能会导致体质量增加[20],替西帕肽在GLP-1受体上表现出偏向cAMP信号[21],因此除了GIP受体信号转导外,GLP-1受体上的通路偏差可能与替西帕肽改善T2DM患者的血糖控制和体质量调节的疗效有关[22]。另外,替西帕肽通过不同的信号转导途径调节β细胞功能,激活腺苷酸环化酶,增加cAMP的胞内浓度,从而激活蛋白激酶A和cAMP直接激活的交换蛋白(Epac)[23]。Epac有两种亚型,1型可能对β细胞具有保护作用,2型则可促进葡萄糖诱导的胰岛素分泌,这可能是替西帕肽相较于选择性GLP-1受体激动剂具有更好降糖效果的原因之一。综上,替西帕肽并非GLP-1和GIP两种受体激动剂的简单相加,而是通过两者机制的协同互补,实现了"1+1>2"的效果。
SURPASS系列临床试验是比较替西帕肽与目前常用降糖药物或安慰剂有效性和安全性的研究。该系列研究结论一致显示替西帕肽具有显著的降糖及减重疗效。SURPASS-1研究[24]显示,5、10、15 mg替西帕肽组患者糖化血红蛋白(HbA1c)分别降低1.87%、1.89%、2.07%,安慰剂组HbA1c仅降低0.04%。SURPASS-2研究[25]是替西帕肽与司美格鲁肽(1 mg)头对头的研究,结果显示,5、10、15 mg替西帕肽组患者HbA1c平均降低了2.09%、2.37%、2.46%,而司美格鲁肽组患者HbA1c平均降低1.86%;所有剂量的替西帕肽均优于司美格鲁肽(1 mg),同时15 mg替西帕肽组HbA1c≤6.5%和<5.7%的患者占比分别为92%和51%。SURPASS-3研究[26]比较了在二甲双胍联用或不联用钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)的基础上,使用替西帕肽或滴定剂量德谷胰岛素的疗效和安全性,结果显示,5、10、15 mg替西帕肽组和德谷胰岛素组患者HbA1c分别降低了1.93%、2.20%、2.37%和1.34%;与德谷胰岛素组相比,3个替西帕肽组的患者达到HbA1c<7.0%的占比更高(82%~93%)。SURPASS-4研究[27]比较了替西帕肽与甘精胰岛素的降糖疗效,结果显示,5、10、15 mg替西帕肽组和甘精胰岛素组患者HbA1c分别降低了2.24%、2.43%、2.58%和1.44%。SURPASS-5研究[28]在甘精胰岛素联合或不联合二甲双胍降糖治疗的基础上比较不同剂量替西帕肽与安慰剂的疗效,结果显示,5、10、15 mg替西帕肽组和安慰剂组患者HbA1c分别降低了2.23%、2.59%、2.59%和0.93%;与安慰剂组相比,替西帕肽组患者HbA1c<7.0%的占比更高(85%~90%与34%)。
一项研究对替西帕肽及2 mg司美格鲁肽的疗效进行了比较,在40周时,5 mg替西帕肽与2 mg司美格鲁肽在降低HbA1c效果之间没有显著差异,10 mg和15 mg的替西帕肽较2 mg司美格鲁肽能显著降低HbA1c[29]。另一研究发现使用大剂量GLP-1受体激动剂的患者HbA1c达标率可达80%,而使用替西帕肽的患者HbA1c达标率可达97%,且62%的患者HbA1c<5.7%[30]。SURPASS-AP-Combo研究[31]评估了在二甲双胍基础上联用或不联用磺脲类药物的T2DM患者使用不同剂量替西帕肽与甘精胰岛素治疗的疗效差异,结果显示,5、10、15 mg替西帕肽组和甘精胰岛素组分别使患者的HbA1c降低了2.42%、2.43%、2.49%和0.95%,HbA1c<7%的患者占比更高(75.6%~84.9%与23.7%)。上述研究结果提示,5 mg替西帕肽与2 mg司美格鲁肽降糖疗效无显著差异,其他剂量的替西帕肽降糖疗效均高于当前降糖药物。
在减重方面:SURPASS-1研究[24]显示5、10、15 mg替西帕肽组和安慰剂组患者体质量分别降低7.0、7.8、9.5 kg和0.7 kg;SURPASS-2研究[25]显示5、10、15 mg替西帕肽组和司美格鲁肽组患者体质量分别降低7.8、10.3、12.4 kg和6.2 kg,且15 mg替西帕肽组实现体质量下降≥15%的患者高达40%。SURPASS-3研究[26]显示5、10、15 mg替西帕肽组患者体质量分别降低7.5、10.7、12.9 kg,而德谷胰岛素组则增加了2.3 kg。基于SURPASS-3研究的亚组分析[32]显示,相较于德谷胰岛素组,替西帕肽组肝脏脂肪含量、内脏脂肪组织体积和腹部皮下脂肪组织显著减少。SURPASS-4研究[27]显示5、10、15 mg替西帕肽组患者体质量分别降低7.1、9.5、11.7 kg,而甘精胰岛素组患者体质量增加了1.9 kg。SURPASS-5研究[28]显示5、10、15 mg替西帕肽组患者体质量分别降低6.2、8.2、10.9 kg,而安慰剂组患者体质量增加了1.7 kg。SURPASS-AP-Combo研究[31]显示5、10、15 mg替西帕肽组患者体质量分别降低5.0、7.0、7.2 kg,而甘精胰岛素组患者体质量增加了1.5 kg。以上患者均为T2DM患者,研究结果提示,替西帕肽降低T2DM患者体质量可能呈剂量依赖性。
SURMOUNT-1研究[33]是在肥胖或超重的非T2DM患者中开展的首个全球替西帕肽Ⅲ期临床研究,结果显示,5、10、15 mg替西帕肽组和安慰剂组患者体质量分别降低16、22、24 kg和2 kg。此外,替西帕肽组89%(5 mg)和96%(10 mg和15 mg)的患者达到了至少5%的体质量减轻,安慰剂组仅为28%;有55%(10 mg)和63%(15 mg)的替西帕肽患者体质量至少降低了20%,安慰剂组仅为1.3%。腰围与基线相比,5、10、15 mg替西帕肽组和安慰剂组分别降低了14.6、19.4、19.9 cm和3.4 cm。替西帕肽组患者的脂肪质量百分比也比瘦体质量减少了约3倍(脂肪质量减少了33.9%,而瘦体质量减少了10.9%)。研究进一步显示,相较于安慰剂组,替西帕肽组可分别降低收缩压7.2 mm Hg(1 mm Hg=0.133 kPa)、舒张压4.8 mm Hg。替西帕肽主要的降糖、减重临床研究结果总结见表1。
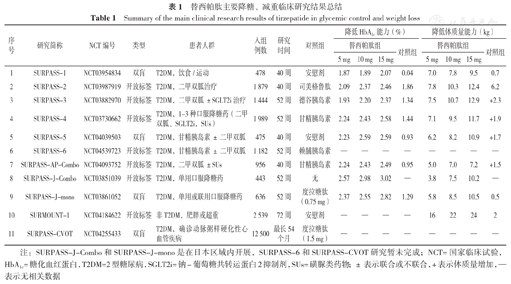
替西帕肽主要降糖、减重临床研究结果总结
Summary of the main clinical research results of tirzepatide in glycemic control and weight loss
替西帕肽主要降糖、减重临床研究结果总结
Summary of the main clinical research results of tirzepatide in glycemic control and weight loss
| 序号 | 研究简称 | NCT编号 | 类型 | 患者人群 | 入组例数 | 研究时间 | 对照组 | 降低HbA1c能力(%) | 降低体质量能力(kg) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 替西帕肽组 | 对照组 | 替西帕肽组 | 对照组 | ||||||||||||
| 5 mg | 10 mg | 15 mg | 5 mg | 10 mg | 15 mg | ||||||||||
| 1 | SURPASS-1 | NCT03954834 | 双盲 | T2DM,饮食/运动 | 478 | 40周 | 安慰剂 | 1.87 | 1.89 | 2.07 | 0.04 | 7.0 | 7.8 | 9.5 | 0.7 |
| 2 | SURPASS-2 | NCT03987919 | 开放标签 | T2DM,二甲双胍治疗 | 1 879 | 40周 | 司美格鲁肽 | 2.09 | 2.37 | 2.46 | 1.86 | 7.8 | 10.3 | 12.4 | 6.2 |
| 3 | SURPASS-3 | NCT03882970 | 开放标签 | T2DM,二甲双胍±SGLT2i治疗 | 1 444 | 52周 | 德谷胰岛素 | 1.93 | 2.20 | 2.37 | 1.34 | 7.5 | 10.7 | 12.9 | +2.3 |
| 4 | SURPASS-4 | NCT03730662 | 开放标签 | T2DM,1~3种口服降糖药(二甲双胍、SGLT2i,SUs) | 1 989 | 52周 | 甘精胰岛素 | 2.24 | 2.43 | 2.58 | 1.44 | 7.1 | 9.5 | 11.7 | +1.9 |
| 5 | SURPASS-5 | NCT04039503 | 双盲 | T2DM,甘精胰岛素±二甲双胍 | 475 | 40周 | 安慰剂 | 2.23 | 2.59 | 2.59 | 0.93 | 6.2 | 8.2 | 10.9 | +1.7 |
| 6 | SURPASS-6 | NCT04539723 | 开放标签 | T2DM,甘精胰岛素±二甲双胍 | 1 182 | 52周 | 赖脯胰岛素 | — | — | — | — | — | — | — | — |
| 7 | SURPASS-AP-Combo | NCT04093752 | 开放标签 | T2DM,二甲双胍±SUs | 956 | 40周 | 甘精胰岛素 | 2.24 | 2.43 | 2.49 | 0.95 | 5.0 | 7.0 | 7.2 | +1.5 |
| 8 | SURPASS-J-Combo | NCT03851039 | 开放标签 | T2DM,单用口服降糖药 | 443 | 52周 | 无 | 2.57 | 2.98 | 3.02 | — | 3.8 | 7.5 | 10.2 | — |
| 9 | SURPASS-J-mono | NCT03861052 | 双盲 | T2DM,单用或联用口服降糖药 | 636 | 52周 | 度拉糖肽(0.75 mg) | 2.37 | 2.55 | 2.82 | 1.29 | 5.8 | 8.5 | 10.5 | 0.5 |
| 10 | SURMOUNT-1 | NCT04184622 | 开放标签 | 非T2DM,肥胖或超重 | 2 539 | 72周 | 安慰剂 | — | — | — | — | 16 | 22 | 24 | 2 |
| 11 | SURPASS-CVOT | NCT04255433 | 双盲 | T2DM,确诊动脉粥样硬化性心血管疾病 | 12 500 | 最长54个月 | 度拉糖肽(1.5 mg) | — | — | — | — | — | — | — | — |
注:SURPASS-J-Combo和SURPASS-J-mono是在日本区域内开展,SURPASS-6和SURPASS-CVOT研究暂未完成;NCT=国家临床试验,HbA1c=糖化血红蛋白,T2DM=2型糖尿病,SGLT2i=钠-葡萄糖共转运蛋白2抑制剂,SUs=磺脲类药物;±表示联合或不联合,+表示体质量增加,—表示无相关数据
SURPASS-CVOT研究[34]是替西帕肽的全球Ⅲ期心血管结局试验,是全球首个采用获得心血管获益证据的降糖药作为活性对照药物的大型心血管结局研究,旨在评估替西帕肽相较于度拉糖肽在心血管结局中的非劣效性及优效性。该研究正在全球多个中心展开,包括了中国20多家医院,研究预计于2024年完成[35]。一项荟萃分析纳入了SURPASS研究公布的7项随机对照试验,旨在比较替西帕肽组和对照组之间首次发生的4项主要不良心血管事件(MACE-4:心血管死亡、心肌梗死、卒中和需要住院的不稳定型心绞痛)的发生时间,结果显示,替西帕肽组与对照组相比MACE-4的HR为0.80〔95%CI(0.57,1.11)〕,心血管死亡HR为0.90〔95%CI(0.50,1.61)〕,全因死亡HR为0.80〔95%CI(0.51,1.25)〕[36]。表明了替西帕肽并未增加T2DM患者发生主要不良心血管事件的风险。PATOULIAS等[37]对使用替西帕肽患者发生心房颤动的风险进行分析,结果显示替西帕肽不会增加T2DM患者发生心房颤动的风险。
GLP-1受体激动剂可以减少脂蛋白和乳糜微粒的产生,以及餐后三酰甘油、极低密度脂蛋白胆固醇和游离脂肪酸的产生[38],但影响的幅度并不大。长期服用GIP受体激动剂对血脂的影响尚不清楚[23]。尽管机制尚不完全清楚,在人体中输注GIP和GIP受体拮抗剂表明GIP受体激活增加了脂肪组织的血流并促进了脂肪组织的脂肪摄取[39,40]。一项研究证明,替西帕肽对血浆三酰甘油的影响明显大于GLP-1受体激动剂的影响[16]。另一项研究指出替西帕肽能降低载脂蛋白C-Ⅲ(apoC-Ⅲ)、载脂蛋白B(apoB)水平以及大脂蛋白颗粒(TRLP)和小低密度脂蛋白颗粒(LDLP)的数量,且呈剂量依赖性,提示对脂蛋白谱有净改善;但该研究作为一项回顾性分析,各组的生物标志物不完全匹配,存在一定的局限性[41]。基于SURPASS-2研究的回顾性分析发现在26周时,替西帕肽降低了如几丁质酶-3样蛋白-1(YKL-40)、细胞间黏附分子1(ICAM-1)、高敏C反应蛋白(hs-CRP)等几个与心血管风险相关的生物标志物[42]。基于多项获益,替西帕肽被认为是具有心脏代谢治疗效果的重要药物[43]。
替西帕肽的总体安全性和耐受性与GLP-1受体激动剂相似[46]。最常见的不良反应是胃肠道相关不良反应,如恶心、腹泻和便秘,通常为轻度至中度,常发生在剂量递增期间,一般不会导致停药[47],未发现明显的低血糖反应。替西帕肽在日本人群中的降糖疗效和安全性、药动/药效(PK/PD)特征与在欧美人群中观察到的一致,并无种族差异[8,48]。
SURPASS系列研究[24,25,26,27,28]显示,替西帕肽最常见的不良反应是短暂的轻中度胃肠道反应,包括恶心、腹泻和呕吐。与德谷胰岛素组相比,接受替西帕肽治疗患者的恶心(12.24%)、腹泻(15.17%)、食欲下降(6.12%)和呕吐(6.10%)的发生率更高[28];与司美格鲁肽组相比,严重低血糖反应(血糖<3.0 mmol/L)在5、10、15 mg替西帕肽组的发生率分别为0.6%、0.2%、1.7%[25]。5、10、15 mg替西帕肽组因不良反应导致的治疗中断率为4.3%、7.1%、6.2%,安慰剂组为2.6%[33]。FRIAS等[49]比较替西帕肽3种不同剂量递增方案和安慰剂组恶心发生率,12周时安慰剂组恶心发生率为7.7%,替西帕肽治疗组恶心发生率分别为24.1%(12 mg组:0~3周4 mg、4~7周8 mg、8~11周12 mg)、39.3%(15 mg-1组:0~1周2.5 mg、2~3周5 mg、4~7周10 mg、8~11周15 mg)、35.7%(15 mg -2组:0~3周2.5 mg、4~7周7.5 mg、8~11周15 mg)。表明较低的起始剂量和较小的剂量增量有利于减少药物不良反应。
SURPASS-4研究[27]显示替西帕肽表现出肾脏保护作用,有助于延缓已伴有心血管风险T2DM患者的慢性肾脏疾病(CKD)进展;与接受胰岛素治疗的患者相比,替西帕肽组患者的肾脏并发症更少。其中,替西帕肽组新发大量蛋白尿的发生率明显更低(HR=0.41);此外,在T2DM合并心血管高风险患者中,替西帕肽可降低CKD进展的风险标志——肾功能丧失率和尿蛋白排泄量。URVA等[50]研究探讨了不同肾功能损害情况下替西帕肽的药代动力学影响,研究将受试者按基础肾功能分为轻度肾损害组〔肾小球滤过率(eGFR)=60~89 ml·min-1·(1.73 m2)-1〕、中度肾损害组〔eGFR=30~59 ml·min-1·(1.73 m2)-1〕、重度肾损害组〔eGFR<30 ml·min-1·(1.73 m2)-1〕、终末期肾病患者组和肾功能正常组〔eGFR≥90 ml·min-1·(1.73 m2)-1〕,分析评价各肾功能损害组的血药浓度-时间曲线下面积(AUC)和最大血药浓度(Cmax)与肾功能正常组的比值。结果显示肾功能损害组和肾功能正常组之间的替西帕肽暴露情况相似,除中度肾损害组AUC增加25%~29%外,各肾损害组与肾功能正常组比较AUC和Cmax比值的90%CI均为1,替西帕肽暴露与eGFR之间没有明显的关系。研究认为替西帕肽对于肾功能受损的受试者可能不需要调整剂量[50]。
替西帕肽作为一种新型降糖药物显示了良好的降糖及减重作用,且初步证实对T2DM合并心血管疾病或CKD患者具有临床获益,进一步弥补了现有降糖药的不足,满足了更多T2DM患者的需求,在降糖、减重、心血管风险相关反应等领域临床应用前景广阔。期待替西帕肽这一优秀的新型降糖药物能够尽快应用于临床,为广大的中国T2DM患者带来更多的降糖治疗选择。从替西帕肽的作用机制上分析,单独应用替西帕肽低血糖发生率很低,这也是替西帕肽治疗组HbA1c达标率较高的原因之一,但在临床应用中也应该注意与胰岛素促泌剂或胰岛素联合治疗时需要及时调整上述两类药物的剂量,以避免低血糖反应发生。
替西帕肽暂未在我国上市,同时在国外临床应用时间短,今后应加强其安全性、有效性、经济性、药物相互作用、特殊人群用药等研究。当前替西帕肽仍有许多临床问题未得到解决,如其长期的疗效和安全性仍需进一步探索,包括更长的随访数据和关于心血管效应的信息;GLP-1受体激动剂有额外的临床获益,替西帕肽是否也有这些额外获益也值得研究。这些问题有待来自临床随机对照试验和真实世界研究的证据进行阐释,从而为其临床合理应用提供强有力的支持。
张丽娜,王岩,张抗怀,等.新型降糖药物替西帕肽的临床研究进展[J].中国全科医学,2023,26(15):1902-1908.[www.chinagp.net]
ZHANG L N,WANG Y,ZHANG K H,et al. Clinical research progress of tirzepatide:a new hypoglycemic agent[J]. Chinese General Practice,2023,26(15):1902-1908.
本文无利益冲突。



























