
乳腺癌相关淋巴水肿(BCRL)是困扰乳腺癌患者术后常见的慢性并发症,早期评估和预测BCRL风险尤为重要,但目前仍缺乏权威公认、适宜推广的风险预测模型。
本研究拟基于Meta分析构建并验证乳腺癌患者BCRL风险预测模型。
计算机检索PubMed、Embase、CINAHL、Scopus、Web of Science、Cochrane Library、中国知网、中国生物医学数据库、万方数据知识服务平台自建库至2021年11月发表的有关BCRL危险因素的前瞻性队列研究。由2名经过系统培训的研究者分别独立筛选文献、提取资料,并采用纽卡斯尔-渥太华量表(NOS)进行质量评价。采用Stata 17.0软件进行Meta分析。根据Meta分析结果提取合并效应量具有显著性的风险因素及合并风险值,构建Logistic回归预测模型。基于回归系数及合并风险值构建Logistic和Additive评分模型。选取2017年4月至2018年12月在北京大学人民医院乳腺中心招募的486例乳腺癌术后患者为模型验证集,采用受试者工作特征(ROC)曲线下面积(AUC)、Hosmer-Lemeshow检验评价评分模型的预测性能,采用决策曲线分析评价预测模型的临床实用性。
共纳入49项前瞻性队列研究、32 543例乳腺癌患者。Meta分析结果显示,乳腺癌患者BCRL发生率为20.6%〔95%CI(17.9%,23.3%)〕。49项研究中报告次数>5次且Meta分析合并效应量结果具有显著性的危险因素共5个,分别为:体质指数(BMI)〔RR=1.777,95%CI(1.515,2.085)〕、乳腺手术类型〔RR=1.320,95%CI(1.125,1.549)〕、腋窝手术类型〔RR=3.058,95%CI(2.325,4.020)〕、放疗〔RR=1.620,95%CI(1.214,2.160)〕、术后并发症〔RR=2.373,95%CI(1.278,4.405)〕。Logistic及Additive评分模型总分分别为0~34分、5~11分。Logistic及Additive评分模型的AUC分别为0.748〔95%CI(0.701,0.794)〕、0.737〔95%CI(0.691,0.784)〕,Hosmer-Lemeshow检验P值分别为0.185、0.763。Logistic评分模型最佳截断值为18分,灵敏度为81.7%,特异度为43.1%;Additive评分模型最佳截断值为8.5分,灵敏度为80.9%,特异度为42.8%。当阈值概率在20%~30%时,预测模型具有较高的临床净获益。
基于Meta分析构建的BCRL风险预测模型具有较好的预测性能,可作为BCRL风险评估工具,指导BCRL的分层管理,但其预测性能和临床实用性仍有待进一步验证和优化。

本刊2023年版权归中国全科医学杂志社所有
未经编辑部许可,不得任意转载和摘编
本刊所发表作品仅为作者观点,并不代表编委会和编辑部意见
如有印装质量问题请向本刊发行部调换
乳腺癌相关淋巴水肿(breast cancer-related lymphedema,BCRL)是乳腺癌患者术后常见的慢性并发症,发生风险伴随患者终身[1]。BCRL一旦发生,治疗棘手且容易反复发作,给患者的身心健康及经济状况带来诸多负面影响[2]。因此,早期评估和预测BCRL风险,变被动治疗为积极预防,最大限度减少BCRL的发生尤为重要。风险预测模型可帮助医务人员准确、快速地筛查高危人群,实现BCRL的分层预防和管理,同时有助于增强患者疾病认知,提高其对BCRL预防管理依从性[3]。探索和识别BCRL的风险因素一直是国内外研究者关注的重点,尽管已有多项研究建立了BCRL风险预测模型,但目前国内外仍然缺乏统一公认的、适宜临床推广应用的BCRL风险预测模型[4]。分析现有相关模型发现,不同预测模型纳入的风险因素变量存在差异,且大部分基于横断面研究或病例对照研究数据建模,存在样本量小、缺乏外部验证等不足[4,5,6,7]。因此,本研究基于前瞻性队列研究的Meta分析,系统分析和评价BCRL危险因素及综合危险度,扩大模型构建的样本量,构建具有循证依据的风险预测模型,以期实现BCRL高危人群的精准识别。
计算机检索PubMed、Embase、CINAHL、Scopus、Web of Science、Cochrane Library、CENTRAL、中国知网、中国生物医学数据库、万方数据知识服务平台自建库至2021年11月发表的有关BCRL危险因素的文章。采用主题词结合自由词的方式,检索语言为中文或英文。同时对纳入文献以及类似文献的参考文献进行手工检索,以补充检索结果。通过初步检索并与研究组成员讨论不断修订检索词,中文检索词主要包括"乳腺癌、乳癌、乳腺肿瘤、乳房肿瘤、乳腺肿物""淋巴水肿、上肢水肿、肿胀""风险因素、危险因素、预测因素、预测变量、影响因素、相关因素"等;英文检索词主要包括"breast cancer、breast neoplasm*、breast tumor*、breast tumour*、breast carcinoma""lymphoedema*、lymphedema*、lymphatic oedema*、lymphatic edema*、oedema*、edema*""Risk factor*、Risk variable*、predictor*、prediction、prognostic factor*、prognostic variable*、epidemiologic factor*、epidemiologic variable*、relevant factor*、relevant variable*、related factor*、related variable*、contributing factor*"等。PubMed检索策略见表1。

PubMed检索策略
Strategies for searching studies about breast cancer-related lymphedema in databases of PubMed
PubMed检索策略
Strategies for searching studies about breast cancer-related lymphedema in databases of PubMed
| 步骤 | 检索式 | 命中数量(篇) |
|---|---|---|
| #1 | "Breast Neoplasms" [Mesh] | 315 036 |
| #2 | "breast cancer" [Title/Abstract] OR "breast neoplasm*" [Title/Abstract] OR "breast tumor*" [Title/Abstract] OR "breast tumour*" [Title/Abstract] OR "Breast Carcinoma" [Title/Abstract] | 328 162 |
| #3 | #1 OR #2 | 409 101 |
| #4 | "lymphedema" [MeSH Terms] OR "Breast Cancer Lymphedema" [MeSH Terms] | 13 039 |
| #5 | "lymphoedema*" [Title/Abstract] OR "lymphedema*" [Title/Abstract] OR "lymphatic oedema*" [Title/Abstract] OR "lymphatic edema*" [Title/Abstract] OR "oedema*" [Title/Abstract] OR "edema*" [Title/Abstract] OR "arm oedema" [Title/Abstract] OR "arm edema" [Title/Abstract] OR "upper extremity oedema" [Title/Abstract] OR "upper limb oedema" [Title/Abstract] OR "upper extremity edema" [Title/Abstract] OR "upper limb edema" [Title/Abstract] OR "breast cancer lymphedema" [Title/Abstract] OR "breast cancer related lymphedema" [Title/Abstract] OR "breast cancer treatment related lymphedema" [Title/Abstract] OR "breast cancer lymphoedema" [Title/Abstract] OR "breast cancer related lymphoedema" [Title/Abstract] OR "breast cancer treatment related lymphoedema" [Title/Abstract] OR "breast cancer related arm lymphedema" [Title/Abstract] OR "lymphedemic" [Title/Abstract] OR "lymphedemic" [Title/Abstract] OR "swelling" [Title/Abstract] | 252 930 |
| #6 | #4 OR #5 | 257 765 |
| #7 | "Risk Factors" [MeSH Terms] OR "epidemiologic factors" [MeSH Terms] | 1 656 289 |
| #8 | "risk factor*" [Title/Abstract] OR "risk variable*" [Title/Abstract] OR "predictor*" [Title/Abstract] OR "prediction" [Title/Abstract] OR "predict factor*" [Title/Abstract] OR "prognostic factor*" [Title/Abstract] OR "prognostic variable*" [Title/Abstract] OR "epidemiologic factor*" [Title/Abstract] OR "epidemiologic variable*" [Title/Abstract] OR "relevant factor*" [Title/Abstract] OR "relevant variable*" [Title/Abstract] OR "related factor*" [Title/Abstract] OR "related variable*" [Title/Abstract] OR "contributing factor*" [Title/Abstract] | 1 445 977 |
| #9 | #7 OR #8 | 2 646 906 |
| #10 | #3 AND #7 AND #11 | 768 |
| #11 | #10 AND ((humans [Filter]) AND (Chinese [Filter] OR English [Filter])) | 626 |
纳入标准:(1)研究设计:前瞻性队列研究;(2)研究对象:确诊为单侧乳腺癌的女性患者;年龄≥18岁;基线及随访样本量均≥50例;(3)暴露:至少报告1项影响BCRL发生的危险因素变量且定义明确;报告多因素校正后的危险因素变量不同组间的效应值,如比值比(OR)、相对危险度(RR)或风险比(HR)及95%置信区间(95%CI);(4)结局指标:经客观测量(臂围测量、生物电阻抗分析法、红外线容量分析法等)、医疗诊断(电子病历或记录)或自我报告等明确判断为BCRL。排除标准:(1)研究对象存在肿瘤复发或其他部位恶性肿瘤、存在原发性BCRL或继发性BCRL病史。(2)术后3个月内发生的急性BCRL、隐匿性或亚临床期BCRL(臂围变化<2 cm,体积变化<3%)。(3)无法获取全文或重复发表的文献(选取最新最全的文献);信息不完整、数据不全的文献,如未报告OR/RR/HR及95%CI。(4)会议论文、学位论文、随机对照试验(RCT)数据的二次分析、综述等。
由2名经过系统培训的研究者分别独立筛选文献并交叉核对。采用EndNote文献管理软件进行软件和手工去重后,阅读题目和摘要进行初筛,然后追溯全文复筛。由1名研究者按预先制定数据提取表提取文献信息,另外2名研究者核对。提取内容主要包括文献基本信息、研究对象基本特征、水肿测量方法及诊断标准、多因素校正后的危险因素及效应指标等。文献筛选及资料提取过程中如有分歧,协商解决或咨询第三位研究者。
将Meta分析得到的危险因素作为自变量,将BCRL的发生率作为因变量构建Logistic回归预测模型。以Meta分析中对应危险因素合并后的综合危险度OR/RR值的自然对数计算模型中各危险因素的回归系数β,计算公式为β=ln(OR)[10]。常数项α为BCRL发生率与未发生率比值的自然对数:α=ln[P/(1-P)]。基于Logistic回归模型的BCRL风险预测模型为:Logit(P)=ln[P/(1-P)]=α+β1X1+β2X2+β3X3+...+βnXn,Xn表示第n个危险因素,βn表示第n个危险因素的回归系数。为方便临床应用,基于BCRL风险预测模型建立风险评分模型:对于Logistic评分模型,赋分方式为:当存在某个危险因素时,将该危险因素变量的回归系数βn乘以10,然后四舍五入取整数,即赋分为整数化的10βn,反之,不存在该危险因素时,赋分为0;Additive评分模型的建立以OR/RR值为基础,存在某危险因素时,该变量赋分为整数化的OR/RR值,参照变量赋分为1,BCRL的发生概率即为所有危险因素的评分之和[11]。
选择课题组前期研究中于2017年4月至2018年12月在北京大学人民医院乳腺中心招募的486例乳腺癌术后患者为模型验证集。研究对象纳入标准:(1)女性;(2)≥18周岁;(3)意识清楚、无认知功能及沟通障碍;(4)自愿参与研究。排除标准:(1)研究招募时正在接受放疗或化疗者;(2)双侧乳腺癌患者;(3)乳腺癌复发、转移者,或合并其他部位恶性肿瘤;(4)有心/肾源性、营养不良性水肿症状的患者;(5)上肢手术或受伤史的患者;(6)无法配合臂围测量者。采用问卷调查结合查阅病历的形式收集资料,采用上臂连周径测量法,即采用无弹性卷尺从手掌正中、肘部、腕横纹开始每间隔4 cm至腋根部进行测量。将任意一点两侧臂围差值≥2 cm作为BCRL的判断标准[12]。本研究模型验证部分的研究数据采集在开展前已经通过北京大学生物医学伦理委员会审批,伦理批号IRB00001052-15073。
采用Stata 17.0软件进行Meta分析。为保证结果的稳定性,仅保留纳入研究数量>5篇的危险因素。采用Q检验和I2统计量判断纳入研究间的异质性。采用随机效应模型计算各危险因素的综合危险度及95%CI。对非正态数据进行Logit转换。对纳入研究数量>10篇的危险因素,采用Egger's回归分析法评价发表偏倚。
模型验证的数据分析采用SPSS 26.0和R 4.1.3软件,采用受试者工作特征(ROC)曲线下面积(AUC)评价模型的预测能力及最佳截断值。AUC<0.7表示模型的诊断价值较低,AUC为0.7~0.9表示诊断价值中等,AUC>0.9表示模型的诊断价值较高[13]。取约登指数最大时的分值为最佳截断值,计算模型的灵敏度和特异度。采用Hosmer-Lemeshow拟合优度检验评价评分系统的准确度。采用rmda包进行决策曲线分析(decision curve analysis,DCA),评价模型的临床实用性。以P<0.05为差异有统计学意义。
数据库初检获得文献3 612篇,追踪参考文献获取73篇,剔重后剩余1 867篇。经标题及摘要筛选后剩余406篇追溯全文,全文阅读后最终纳入49篇文献[5,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,61],文献质量均较高(NOS评分≥7分)。文献筛选流程见图1。纳入研究基本特征及质量评价结果见表2、表3。
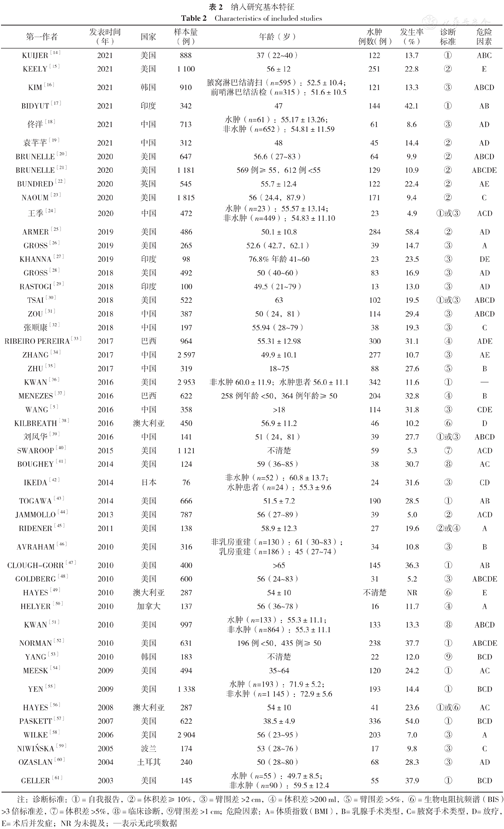
纳入研究基本特征
Characteristics of included studies
纳入研究基本特征
Characteristics of included studies
| 第一作者 | 发表时间(年) | 国家 | 样本量(例) | 年龄(岁) | 水肿例数(例) | 发生率(%) | 诊断标准 | 危险因素 |
|---|---|---|---|---|---|---|---|---|
| KUIJER[14] | 2021 | 美国 | 888 | 37(22~40) | 122 | 13.7 | ① | ABC |
| KEELY[15] | 2021 | 美国 | 1 100 | 56±12 | 251 | 22.8 | ② | E |
| KIM[16] | 2021 | 韩国 | 910 | 腋窝淋巴结清扫(n=595):52.5±10.4;前哨淋巴结活检(n=315):51.6±10.5 | 121 | 13.3 | ③ | ABCD |
| BIDYUT[17] | 2021 | 印度 | 342 | 47 | 144 | 42.1 | ① | AB |
| 佟洋[18] | 2021 | 中国 | 713 | 水肿(n=61):55.17±13.26;非水肿(n=652):54.81±11.59 | 61 | 8.6 | ③ | AD |
| 袁芊芊[19] | 2021 | 中国 | 312 | 48 | 45 | 14.4 | ② | AD |
| BRUNELLE[20] | 2020 | 美国 | 647 | 56.6(27~83) | 64 | 9.9 | ② | ABCD |
| BRUNELLE[21] | 2020 | 美国 | 1 181 | 569例≥55,612例<55 | 129 | 10.9 | ② | ABCDE |
| BUNDRED[22] | 2020 | 英国 | 545 | 55.7±12.4 | 122 | 22.4 | ② | AE |
| NAOUM[23] | 2020 | 美国 | 1 815 | 56(24.4,87.9) | 171 | 9.4 | ② | C |
| 王季[24] | 2020 | 中国 | 472 | 水肿(n=23):55.57±13.14;非水肿(n=449):54.83±11.10 | 23 | 4.9 | ①或③ | ACD |
| ARMER[25] | 2019 | 美国 | 486 | 50.1±10.8 | 284 | 58.4 | ② | AD |
| GROSS[26] | 2019 | 美国 | 265 | 52.6(42.7,62.1) | 39 | 14.7 | ③ | A |
| KHANNA[27] | 2019 | 印度 | 98 | 76.8%年龄41~60 | 23 | 23.5 | ③ | DE |
| GROSS[28] | 2018 | 美国 | 492 | 50(40~60) | 83 | 16.9 | ③ | AD |
| RASTOGI[29] | 2018 | 印度 | 100 | 49.5(21~79) | 13 | 13.0 | ③ | AD |
| TSAI[30] | 2018 | 美国 | 522 | 63 | 102 | 19.5 | ①或③ | ABCD |
| ZOU[31] | 2018 | 中国 | 387 | 50(24,81) | 114 | 29.4 | ③ | ABCD |
| 张顺康[32] | 2018 | 中国 | 197 | 55.94(28~79) | 38 | 19.3 | ③ | C |
| RIBEIRO PEREIRA[33] | 2017 | 巴西 | 964 | 55.31±12.98 | 300 | 31.1 | ④ | ADE |
| ZHANG[34] | 2017 | 中国 | 2 597 | 49.9±10.1 | 277 | 10.7 | ③ | AE |
| ZHU[35] | 2017 | 中国 | 319 | 18~75 | 88 | 27.6 | ⑤ | B |
| KWAN[36] | 2016 | 美国 | 2 953 | 非水肿60.0±11.9;水肿患者56.0±11.1 | 342 | 11.6 | ① | — |
| MENEZES[37] | 2016 | 巴西 | 622 | 258例年龄<50,364例年龄≥50 | 204 | 32.8 | ④ | B |
| WANG[5] | 2016 | 中国 | 358 | >18 | 114 | 31.8 | ③ | CDE |
| KILBREATH[38] | 2016 | 澳大利亚 | 450 | 56.9±11.2 | 46 | 10.2 | ⑥ | D |
| 刘风华[39] | 2016 | 中国 | 141 | 51(24,81) | 39 | 27.7 | ①或③ | ABCD |
| SWAROOP[40] | 2015 | 美国 | 1 121 | 不清楚 | 59 | 5.3 | ⑦ | ACD |
| BOUGHEY[41] | 2014 | 美国 | 124 | 59(36~85) | 38 | 30.7 | ⑧ | AC |
| IKEDA[42] | 2014 | 日本 | 76 | 非水肿(n=52):60.8±13.7;水肿患者(n=24):55.3±9.6 | 24 | 31.6 | ③ | CD |
| TOGAWA[43] | 2014 | 美国 | 666 | 51.5±7.2 | 190 | 28.5 | ① | AB |
| JAMMOLLO[44] | 2013 | 美国 | 787 | 56(27~89) | 39 | 5.0 | ② | ACD |
| RIDENER[45] | 2011 | 美国 | 138 | 58.9±12.3 | 27 | 19.6 | ②或④ | A |
| AVRAHAM[46] | 2010 | 美国 | 316 | 非乳房重建(n=130):61(30~83);乳房重建(n=186):45(27~74) | 34 | 10.8 | ③ | B |
| CLOUGH-GORR[47] | 2010 | 美国 | 400 | >65 | 145 | 36.3 | ① | AB |
| GOLDBERG[48] | 2010 | 美国 | 600 | 56(24~83) | 31 | 5.2 | ③ | ABCDE |
| HAYES[49] | 2010 | 澳大利亚 | 287 | 54±10 | 不清楚 | NR | ⑥ | E |
| HELYER[50] | 2010 | 加拿大 | 137 | 56(36~78) | 16 | 11.7 | ④ | A |
| KWAN[51] | 2010 | 美国 | 997 | 水肿(n=133):55.3±11.1;非水肿(n=864):55.3±11.1 | 133 | 13.3 | ⑧ | ABCD |
| NORMAN[52] | 2010 | 美国 | 631 | 196例<50,435例≥50 | 238 | 37.7 | ① | ABCDE |
| YANG[53] | 2010 | 韩国 | 183 | 不清楚 | 22 | 12.0 | ⑨ | BCD |
| MEESK[54] | 2009 | 美国 | 494 | 35~64 | 120 | 24.2 | ① | AC |
| YEN[55] | 2009 | 美国 | 1 338 | 水肿(n=193):71.9±5.2;非水肿(n=1 145):72.9±5.6 | 193 | 14.4 | ① | BCD |
| HAYES[56] | 2008 | 澳大利亚 | 287 | 54±10 | 41 | 23.6 | ①或⑥ | AC |
| PASKETT[57] | 2007 | 美国 | 622 | 38.5±4.9 | 336 | 54.0 | ① | BCD |
| WILKE[58] | 2006 | 美国 | 2 904 | 56(23~95) | 203 | 7.0 | ③ | A |
| NIWIN'SKA[59] | 2005 | 波兰 | 174 | 53(28~76) | 17 | 9.8 | ③ | C |
| OZASLAN[60] | 2004 | 土耳其 | 240 | 50(28~80) | 68 | 28.3 | ③ | AD |
| GELLER[61] | 2003 | 美国 | 145 | 水肿(n=55):49.7±8.5;非水肿(n=90):59.5±12.4 | 55 | 37.9 | ① | BCD |
注:诊断标准:①=自我报告,②=体积差≥10%,③=臂围差>2 cm,④=体积差>200 ml,⑤=臂围差>5%,⑥=生物电阻抗频谱(BIS)>3倍标准差,⑦=体积差>5%,⑧=临床诊断,⑨臂围差>1 cm;危险因素:A=体质指数(BMI),B=乳腺手术类型,C=腋窝手术类型,D=放疗,E=术后并发症;NR为未提及;—表示无此项数据
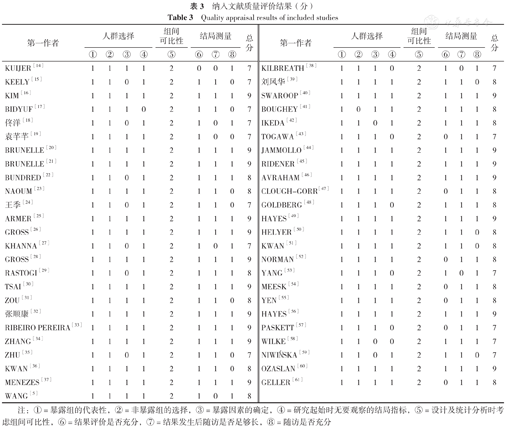
纳入文献质量评价结果(分)
Quality appraisal results of included studies
纳入文献质量评价结果(分)
Quality appraisal results of included studies
| 第一作者 | 人群选择 | 组间可比性 | 结局测量 | 总分 | 第一作者 | 人群选择 | 组间可比性 | 结局测量 | 总分 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| KUIJER[14] | 1 | 1 | 1 | 1 | 2 | 0 | 0 | 1 | 7 | KILBREATH[38] | 1 | 1 | 1 | 0 | 2 | 1 | 0 | 1 | 7 |
| KEELY[15] | 1 | 1 | 0 | 1 | 2 | 1 | 1 | 0 | 7 | 刘风华[39] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 0 | 8 |
| KIM[16] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 9 | SWAROOP[40] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 9 |
| BIDYUF[17] | 1 | 1 | 1 | 0 | 2 | 1 | 1 | 0 | 7 | BOUGHEY[41] | 1 | 0 | 1 | 1 | 2 | 1 | 1 | 1 | 8 |
| 佟洋[18] | 1 | 1 | 0 | 1 | 2 | 1 | 0 | 1 | 7 | IKEDA[42] | 1 | 1 | 0 | 1 | 2 | 1 | 1 | 1 | 8 |
| 袁芊芊[19] | 1 | 1 | 1 | 1 | 2 | 1 | 0 | 0 | 7 | TOGAWA[43] | 1 | 1 | 1 | 0 | 2 | 0 | 1 | 1 | 7 |
| BRUNELLE[20] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 9 | JAMMOLLO[44] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 9 |
| BRUNELLE[21] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 9 | RIDENER[45] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 9 |
| BUNDRED[22] | 1 | 1 | 0 | 1 | 2 | 1 | 1 | 1 | 8 | AVRAHAM[46] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 9 |
| NAOUM[23] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 0 | 8 | CLOUGH-GORR[47] | 1 | 1 | 1 | 1 | 2 | 0 | 1 | 1 | 8 |
| 王季[24] | 1 | 1 | 0 | 1 | 2 | 1 | 1 | 0 | 7 | GOLDBERG[48] | 1 | 1 | 1 | 0 | 2 | 1 | 1 | 1 | 8 |
| ARMER[25] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 9 | HAYES[49] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 9 |
| GROSS[26] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 9 | HELYER[50] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 0 | 8 |
| KHANNA[27] | 1 | 1 | 0 | 1 | 2 | 1 | 0 | 1 | 7 | KWAN[51] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 0 | 8 |
| GROSS[28] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 9 | NORMAN[52] | 1 | 1 | 1 | 1 | 2 | 0 | 1 | 1 | 8 |
| RASTOGI[29] | 1 | 1 | 0 | 1 | 2 | 1 | 1 | 1 | 8 | YANG[53] | 1 | 1 | 1 | 0 | 2 | 1 | 0 | 1 | 7 |
| TSAI[30] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 9 | MEESK[54] | 1 | 1 | 1 | 1 | 2 | 0 | 1 | 1 | 8 |
| ZOU[31] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 0 | 8 | YEN[55] | 1 | 1 | 1 | 1 | 2 | 0 | 1 | 1 | 8 |
| 张顺康[32] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 9 | HAYES[56] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 9 |
| RIBEIRO PEREIRA[33] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 9 | PASKETT[57] | 1 | 1 | 1 | 0 | 2 | 0 | 1 | 1 | 7 |
| ZHANG[34] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 9 | WILKE[58] | 1 | 1 | 0 | 0 | 2 | 1 | 1 | 1 | 7 |
| ZHU[35] | 1 | 1 | 0 | 1 | 2 | 1 | 1 | 0 | 7 | NIWIN'SKA[59] | 1 | 1 | 0 | 1 | 2 | 1 | 1 | 0 | 7 |
| KWAN[36] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 0 | 8 | OZASLAN[60] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 9 |
| MENEZES[37] | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 9 | GELLER[61] | 1 | 1 | 1 | 1 | 2 | 0 | 1 | 1 | 8 |
| WANG[5] | 1 | 1 | 1 | 1 | 2 | 1 | 0 | 1 | 8 | ||||||||||
注:①=暴露组的代表性,②=非暴露组的选择,③=暴露因素的确定,④=研究起始时无要观察的结局指标,⑤=设计及统计分析时考虑组间可比性,⑥=结果评价是否充分,⑦=结果发生后随访是否足够长,⑧=随访是否充分
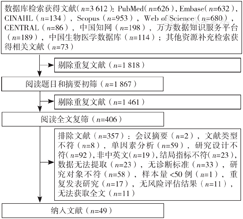

49项研究中报告次数>5次且Meta分析合并效应量结果具有显著性的危险因素共5个,分别为:体质指数(BMI)、乳腺手术类型、腋窝手术类型、放疗、术后并发症(P<0.05)。Egger's检验结果显示,BMI、乳腺手术类型、腋窝手术类型及放疗均不存在发表偏倚(P>0.05)。Meta分析及异质性检验结果见表4。同时Meta分析中,49项研究报告了BCRL的发生率(5.0%~58.4%),合并效应量结果显示,BCRL发生率为20.6%〔95%CI(17.9%,23.3%)〕。
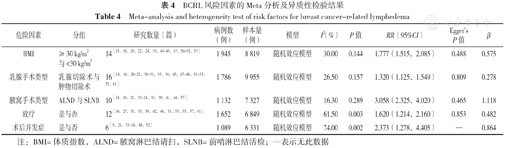
BCRL风险因素的Meta分析及异质性检验结果
Meta-analysis and heterogeneity test of risk factors for breast cancer-related lymphedema
BCRL风险因素的Meta分析及异质性检验结果
Meta-analysis and heterogeneity test of risk factors for breast cancer-related lymphedema
| 危险因素 | 分组 | 研究数量(篇) | 病例数(例) | 样本量(例) | 模型 | I2(%) | P值 | RR(95%CI) | Egger's P值 | β |
|---|---|---|---|---|---|---|---|---|---|---|
| BMI | ≥30 kg/m2与<30 kg/m2 | 14[15,18,20,22,24,33,43,44,45,47,50,51,52,57] | 1 945 | 8 819 | 随机效应模型 | 30.00 | 0.144 | 1.777(1.515,2.085) | 0.488 | 0.575 |
| 乳腺手术类型 | 乳腺切除术与肿物切除术 | 16[14,16,20,21,30,31,35,39,43,47,48,51,52,53,55,61] | 1 786 | 9 955 | 随机效应模型 | 26.50 | 0.157 | 1.320(1.125,1.549) | 0.809 | 0.278 |
| 腋窝手术类型 | ALND与SLNB | 10[14,16,21,23,24,31,39,41,44,57] | 1 132 | 7 327 | 随机效应模型 | 16.30 | 0.289 | 3.058(2.325,4.020) | 0.465 | 1.118 |
| 放疗 | 是与否 | 12[16,25,31,33,39,42,48,51,53,55,57,61] | 1 652 | 6 849 | 随机效应模型 | 61.50 | 0.003 | 1.620(1.214,2.160) | 0.853 | 0.482 |
| 术后并发症 | 是与否 | 6[5,21,33,34,48,52] | 1 089 | 6 331 | 随机效应模型 | 74.00 | 0.002 | 2.373(1.278,4.405) | — | 0.864 |
注:BMI=体质指数,ALND=腋窝淋巴结请扫,SLNB=前哨淋巴结活检;—表示无此数据
最终构建的Logistic风险预测模型为:Logit(P)=-1.349+0.575X1+0.278X2 +1.118X3 +0.482X4+0.864X5,X1、X2……X5分别为BMI、乳腺手术类型、腋窝手术类型、放疗、术后并发症。Logistic及Additive风险预测模型总分分别为0~34、5~11分,详见表5。
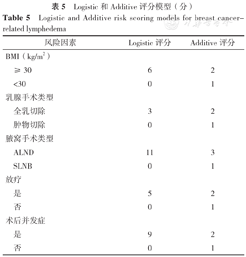
Logistic和Additive评分模型(分)
Logistic and Additive risk scoring models for breast cancer-related lymphedema
Logistic和Additive评分模型(分)
Logistic and Additive risk scoring models for breast cancer-related lymphedema
| 风险因素 | Logistic评分 | Additive评分 |
|---|---|---|
| BMI(kg/m2) | ||
| ≥30 | 6 | 2 |
| <30 | 0 | 1 |
| 乳腺手术类型 | ||
| 全乳切除 | 3 | 2 |
| 肿物切除 | 0 | 1 |
| 腋窝手术类型 | ||
| ALND | 11 | 3 |
| SLNB | 0 | 1 |
| 放疗 | ||
| 是 | 5 | 2 |
| 否 | 0 | 1 |
| 术后并发症 | ||
| 是 | 9 | 2 |
| 否 | 0 | 1 |
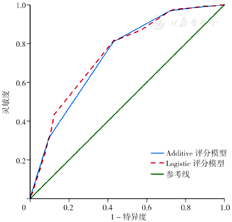
模型验证的486例乳腺癌术后患者中,共131例(26.95%)发生BCRL。Logistic及Additive风险预测模型的AUC分别为0.748〔95%CI(0.701,0.794)〕、0.737〔95%CI(0.691,0.784)〕(图2)。Logistic风险预测模型的最佳截断值为18分(总分0~34分),灵敏度为81.7%,特异度为43.1%;Additive风险预测模型的最佳截断值为8.5分(总分5~11分),灵敏度为80.9%,特异度为42.8%。Hosmer-Lemeshow检验分别为8.796(P=0.185)、1.158(P=0.763),模型拟合良好。DCA显示,当阈值概率为20%~30%时,基于Meta分析的Logistic风险预测模型具有较高的净获益,但阈值概率范围较窄,临床实用性有待进一步验证(图3)。

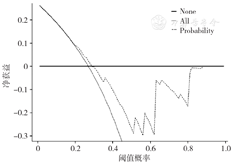

注:None表示所有样本是阴性,无干预,净获益为0;All表示所有样本是阳性,接受干预,净获益是斜率为负值的反斜线;Probability表示使用Logistic评分模型
本研究基于49项前瞻性队列研究对BCRL风险因素进行了Meta分析,共确定5个危险因素,除BMI,其他均为疾病及治疗相关因素,包括乳腺手术类型、腋窝手术类型、放疗以及术后并发症,这些因素已经在多项研究中得到证实[62]。以上疾病及治疗相关因素常难以改变或干预,提示临床医务人员在乳腺癌患者选择治疗方案时,应充分告知治疗获益及潜在并发症风险,提高其对风险的认知及对术后并发症(如BCRL)预防管理的重视程度[63]。
在探究BCRL风险因素时,重点关注其中的可干预变量能够为BCRL的风险管理提供更多有效的线索。近期研究也逐渐关注规律锻炼情况、体力活动水平等可控变量对BCRL的预测作用[64]。本研究结显示,BMI≥30 kg/m2的患者水肿风险会增加0.78倍左右。BMI是BCRL风险因素的这一结论已被多项研究证实[65,66],并且也是本研究发现的唯一可干预变量。但其机制目前尚不明确,一般认为,过多的脂肪组织会增加淋巴液的产生,挤压淋巴管,甚至造成淋巴管内皮损伤[7,67]。同时,肥胖也会增加术后感染、伤后愈合延迟等并发症的发生风险,进一步诱发BCRL[65]。TSAI等[7]对4项减重干预的RCT进行Meta分析,结果尚未发现水肿状况的显著改善,仅其中2项小样本研究支持体质量管理对减轻水肿程度的效果,未来仍需开展更多临床试验来评估体质量控制对BCRL的管理,尤其是预防作用。但考虑到体质量管理对患者疾病预后的益处,医务人员仍应通过提供健康教育、饮食-锻炼指导等[68],帮助患者合理控制体质量。
本研究通过合并多项前瞻性队列研究,扩大样本量,提高了研究对象的代表性,能够确保风险预测模型中各危险因素综合危险度的可靠性。并进一步将风险预测模型以Logistic及Additive评分模型的形式呈现,ROC曲线提示两个风险评分模型具有同等的预测效能,预测准确度分别为74.8%和73.7%,与LIU等[69]、MARTÍNEZ-JAIMEZ等[70]模型的预测准确度相似,略低于李惠萍等[11]、KWAN等[71]、WANG等[5]的模型。DCA结果显示,模型能够给患者带来净获益的阈值概率的范围较窄,原因可能为基于Meta分析结果模拟建模对变量综合危险度的估计存在偏差、研究数量限制了部分潜在预测变量的纳入、横断面数据影响模型验证的效果等。提示本模型对BCRL风险预测具有一定的临床应用价值,但模型的实用性还需进一步验证和提升。此外,研究显示,在乳腺癌患者中开展BCRL前瞻性监测项目可有效降低BCRL发生率[72]。国外研究者呼吁将BCRL前瞻性监测纳入乳腺癌护理路径中,但目前其推广实施仍然有限。2017年,郑思娣[73]率先在国内开展了前瞻性监测相关研究,但并未发现对BCRL预防的效果,可能与该研究随访期较短(仅为3个月),而BCRL较多发生在术后3个月以上有关。考虑到医疗资源有限的现状,建议应依据风险评估开展BCRL的分层级预防管理,针对患者的风险等级明确相应的随访监测频率及预防管理策略,以最大限度地提高BCRL预防管理的效率。结合本研究构建的风险评分模型,可依据Logistic评分模型≥18分(总分0~34分)或Additive评分模型≥8.5分(总分5~11分),筛选BCRL的高危人群,并将风险评估纳入乳腺癌术后常规护理中。但基于循证证据的BCRL的分层预防管理策略还有待开发。
虽然本研究基于大样本循证医学数据的合并,克服了单项研究的偏倚,但由于是对原始研究的二次分析,仍存在一些不足:首先,Meta分析纳入研究的异质性略高,可能原因包括不同研究间水肿测量方法和诊断标准不同、随访时间长短差异、不同研究校正的混杂因素有所差异等;其次,本研究采用横断面研究数据进行模型验证,未来应在大样本前瞻性数据中进一步验证和优化模型性能。
本研究通过Meta分析对BCRL危险因素进行定量综合,明确了BCRL发生的危险因素,包括BMI、乳腺手术类型、腋窝手术类型、放疗、术后并发症。并结合Logistic回归模型分别构建了Logistic和Additive风险评分模型,划分风险等级。虽然模型的预测效能有待进一步提升和优化,但仍然具有一定的临床应用和推广价值,能够为BCRL的风险评估提供科学、有效的工具,促进分层分级管理的落实,提高BCRL预防管理效率。
沈傲梅,路潜,符鑫,等.基于前瞻性队列研究的Meta分析构建乳腺癌相关淋巴水肿风险预测模型研究[J].中国全科医学,2023,26(17):2078-2088. [www.chinagp.net]
SHEN A M,LU Q,FU X,et al. Constructing a risk prediction model of breast cancer-related lymphedema based on a meta-analysis of prospective cohort studies[J]. Chinese General Practice,2023,26(17):2078-2088.
本文无利益冲突。



























